Какой самый легкоплавкий металл
Какой самый легкоплавкий металл — Справочник металлиста

Температура плавления – важная характеристика, которая чаще всего применяется именно к металлам. Она зависит от многих физических свойств веществ – их чистоты и кристаллической структуры. Какой металл наиболее легкоплавкий: Li, Al, Hg, Cu? Давайте выясним, кто из них действительно может называться таковым.
Наиболее легкоплавкие металлы
Плавление – процесс перехода из твердого состояния в жидкое. Он происходит под воздействием тепла, но зависит еще от ряда физических факторов, например от давления. Важную роль в том, насколько легко и тяжело вещество поддается плавлению, также играет его состав, размер кристаллов в решетке и прочность связей между атомами.
Температура плавления металлов очень разнится и может иметь даже минусовые значения. Она колеблется от -39 до +3410 градусов Цельсия. Тяжелее всего в жидкость превращаются молибден, вольфрам, хром, титан. Для этого процесса их требуется нагреть до температуры не менее 2000 градусов.
Наиболее легкоплавкими металлами являются галлий, ртуть, литий, олово, свинец, цинк, индий, висмут, таллий. Подробнее о некоторых из них читайте далее.
Ртуть
Полезный во многих сферах, но ядовитый металл был известен еще до нашей эры. Ртуть использовали античные и средневековые медики для лечения венерических и многих других заболеваний, алхимики пытались сделать из нее золото. Сегодня она применяется в электротехнике, приборостроении и органической химии.
Руть – это наиболее легкоплавкий металл на планете. При нормальных комнатных условиях она всегда жидкая, так как температура ее плавления составляет -39 градуса.
Ее пары очень опасны, поэтому ртуть содержат только в контейнерах и специальных стеклянных колбах.
На организм она действует как яд, отравляя его и выводя из строя нервную, иммунную, дыхательную и пищеварительную системы.
Галлий
Вторым в списке наиболее легкоплавких металлов находится галлий.
Он становится жидкостью при температуре выше 29,5 градусов Цельсия, и размягчить его можно просто подержав немного в руках.
При нормальных условиях галлий очень хрупкий, легко поддается механическому воздействию и окрашен в светло-серебристый, несколько голубоватый оттенок.
Металл очень рассеян в земной коре и не встречается в виде самородков. В природе его находят в составе различных минералов, таких как гранат, мусковит, турмалин, хлорит, полевой шпат. Кроме того, он содержится в морской воде. Галлий используют в высокочастотной электронике, для изготовления зеркал и различных сплавов.
Индий
В качестве простого вещества индий очень светлый, ковкий и мягкий настолько, что даже оставляет след, если им провести по бумаге. Он также является одним из наиболее легкоплавких металлов, но воздействуют на него только температуры выше 157 °C. Закипает он при 2072 градусах.
Как и галлий, индий не образует собственных месторождений, но содержится в различных рудах. Благодаря своей рассеяности в природе металл довольно дорогой. Его применяют в микроэлектронике, для изготовления легкоплавких сплавов, припоев, жидкокристаллических экранов для техники.
Олово
Олово плавится от температуры выше 231 градуса по Цельсию. Это пластичный и мягкий металл, светло-серебристого цвета. Оно существует четырех аллотропных модификациях, две из них появляются только при высоком давлении.
Олово довольно рассеяно в природе, но может образовывать собственные минералы, например, станнин и касситерит. Его используют в качестве покрытия для металлов для усиления их устойчивости к коррозии, а также для производства жести, фольги, разнообразных сплавов, посуды и деталей для музыкальных инструментов.
Литий
Литий – наиболее легкоплавкий металл, который становится жидкостью при температуре 180 градусов. Он мягкий, хорошо поддается ковке и механической обработке.
Он относится к щелочным металлам, но проявляет активность гораздо хуже остальных представителей группы.
Он медленно реагирует с влажным воздухом, а в сухой атмосфере остается практически стабильным
Металл встречается в сподумене, лепидолите, в месторождениях с оловом, висмутом и вольфрамом, содержится в морской воде и в звездных космических объектах.
Литий часто используется для изготовления гальванических элементов, аккумуляторов, применяют в качестве окислителя, а также в пиротехнике.
В сплавах с кадмием, медью и алюминием используется в космической, военной и авиационной технике.
Самый легкоплавкий металл: свойства и применение

Вы можете назвать самый легкоплавкий металл? Подсказка: в нормальном состоянии он жидкий, серебристый и очень ядовитый. Догадались? В любом случае давайте узнаем о нём побольше.
Какой самый легкоплавкий металл?
Ещё до нашей эры египтяне, шумеры и китайцы использовали это вещество для приготовления «пилюль бессмертия» и других препаратов, которые должны были даровать долгую жизнь. Оно применялось в красках и косметике. Римляне очищали им золото, а алхимики пытались получить золото прямо из него.
Древние греки решили назвать самый легкоплавкий металл «серебро» и «вода», что на латинском звучало как hydrargyrum. В праславянском языке его название звучало как «ртуть», но откуда произошло такое имя, неизвестно. Возможно, от слова «руда».
Её получали из киновари при помощи обжига или извлекали в жидком виде прямо из горных пород. В алхимии ртути соответствовал астрономический символ Меркурия. Она считалась матерью металлов и вместе с серой и солью была частью теории трёх начал.
Ртуть считалась основным элементом философского камня. И хотя мир знал о ней уже давно, описание её свойства и доказательство того, что это действительно металл, были представлены только в 1759 году. Сделали это Михаил Ломоносов и Иосиф Браун.
Свойства ртути
Итак, самый легкоплавкий металл – это ртуть. Для её плавления нужна температура от 234,32 К или -38,83 °С. Кроме неё, при низких температурах плавятся свинец, таллий, галлий, висмут, олово, кадмий. Закипает ртуть при 629,88 К или 356,73 градусов Цельсия, а при 4,155 К ведёт себя как сверхпроводник.
Она обладает серебристо-белым цветом с ярко выраженным блеском. В периодической таблице ей присвоен номер 80. Это единственный металл, который при комнатной температуре находится в жидком состоянии. В твёрдом состоянии она обладает ромбоэдрической решеткой.
Самый легкоплавкий металл малоактивен при небольших температурах. В таких условиях он слабо реагирует на окислительные растворы и многие газы. Не вступает в реакцию он и с кислородом воздуха, хотя прекрасно растворяется в царской водке.
С другими металлами ртуть образует различные сплавы, амальгамы. С органическими соединениями образует очень прочные связи. С хлором или йодом соединяется после нагревания, образуя ядовитые и практически не диссоциирующие вещества.
Воздействие на организм
Самый легкоплавкий металл обладает первой степенью токсичности. Он испаряется уже при комнатной температуре, и чем воздух горячее, тем выше скорость испарения. На организм человека ртуть действует отравляюще, поражая нервную, пищеварительную, дыхательную и другие системы. Это может привести к летальному исходу. Симптомы проявляются спустя 8-24 часа.
Длительное воздействие небольших доз ртути проявляется в виде хронических недугов. Человек становится раздражительным и вспыльчивым, страдает от нехватки сна и головных болей, теряет работоспособность, быстро устает.
Острые отравления могут иметь похожие симптомы вначале. Они также сопровождаются повышенной температурой, слабостью, рвотой и тошнотой, болью в желудке, дрожью во всем теле или в отдельных его частях. Вещество поражает почки, что проявляется частыми позывами к мочеиспусканию.
Широкое применение ртути нередко было причиной профессиональных отравлений. Так, в средние века её использовали для изготовления фетра для шляп. Симптомы, которые появлялись у мастеров, называли «болезнью старого шляпника».
Пищевые отравления ртутью возможны у тех, кто любит морепродукты. Металл отлично усваивается организмом морских обитателей, постепенно накапливаясь в нём. В регионах, где люди постоянно употребляют рыбу и другие продукты моря, могут возникать симптомы хронического отравления. Особенно часто они встречаются у жителей прибрежных областей Канады, Колумбии, Бразилии и Китая.
Применение и нахождение в природе
Самый легкоплавкий металл в мире находится в природе очень рассеяно. Общая его концентрация в земной коре составляет примерно 83 мг/т, что делает его довольно редким элементом. В больших количествах он находится в глинистых сланцах и сульфидных минералах, в особенности в сфалеритах и антимонитах. Встречается в ливингстонитах и метациннабаритах.
Несмотря на свою токсичность, ртуть применяется во многих сферах, например, в металлургии, медицине, химической промышленности, машиностроении, электротехнике и даже сельском хозяйстве. Самый легкоплавкий металл подходит для наполнения энергосберегающих ламп, термометров и барометров.
В тяжёлой промышленности вещество используют для ртутнопаровых турбин, вакуумных установок и диффузионных насосов. Им наполняют измерительные приборы, аккумуляторы, сухие батареи. Ртуть участвует в производстве кондиционеров, холодильников и стиральных машин. В сельском хозяйстве её применяют в составе пестицидов.
Какой металл является самым легкоплавким после ртути

Самым легкоплавким среди всех известных сегодня металлов является ртуть.
Имя человека, впервые открывшего этот чудо-металл, затерялось в глубине тысячелетий, но доподлинно известно, что ртуть была знакома человечеству еще за несколько веков до нашей эры.
Сегодня уже нельзя утверждать, что ртуть – это единственный металл, существующий в жидкой фазе при условиях, которые принято считать нормальными (750,06 мм рт. ст., 25°С).
Франций, очень редкий металл, находится в жидком состоянии уже при 15 – 23o С, но изучение этого вещества очень затруднено вследствие его высокой радиоактивности и малого периода полураспада.
При чуть более высоких температурах плавятся цезий и галлий, а именно при +28,5o С и при +29,8o С, соответственно. Ртуть же по температуре плавления бьет все рекорды среди металлов.
Переход ртути из твердого состояния в жидкое происходит при минус 38,89 °С!
До середины XVIII века считалось, что ртуть может находиться только в жидком и газообразном состояниях. Наука того времени вообще не относила ртуть к металлам, несмотря на присущие ей некоторые свойства этого класса соединений. Существование ртути в твердой форме было обнаружено случайно. В 1734 году в г.
Томске наблюдатель метеостанции, конный казак Саломатов, заметил, что в очень сильный мороз в его барометре застывает ртуть. О своем наблюдении он сообщил ученым Гмелину и Миллеру, членам Академии наук Санкт-Петербурга.
Однако непоколебимая уверенность ученых мужей в том, что ртуть не может быть твердой, помешала им серьезно воспринять эту информацию.
Спустя четверть века, зимой 1759 — 1760 гг., при проведении научных опытов замерзание ртути обнаружил ученый Иосиф Адам Браун. В Санкт-Петербурге в тот день, 14 декабря 1759 года, было очень холодно. Показания термометра доходили до -37° С. Браун ставил эксперимент, целью которого было максимально возможное понижение температуры вещества.
Ученый смешал в стеклянном сосуде уличный снег с небольшим количеством азотной кислоты и поместил в эту среду ртутный термометр для измерения температуры. И тогда Браун обнаружил, что ртуть в термометре застыла.
Это было сенсационное открытие! Ведь до тех пор ни в одном научном труде не было упоминания о том, что ртуть может существовать в твердой фазе.
Опыт Иосифа Адама Брауна был воспроизведен затем академиками Ломоносовым, Цейгером и Эпинусом. Они также подтвердили факт замерзания ртути. Той же зимой, в январе 1760 года, М. В.
Ломоносов обнаружил, что ртуть в твердой форме, так же как и в жидкой, обладает свойством электропроводности.
После экспериментов Ломоносова спорный вопрос о принадлежности ртути к классу металлов был решен окончательно.
Читать также: Подслушивающее устройство на расстоянии цена
легкоплавкие металлы — Группа цв. металлов с низкой tm, включающая Zn, Cd, Hg, Sn, Pb, Bi, Ti, Sb и элементы с ослабл. металлич. св вами: Ga, Ge. [http://metaltrade.ru/abc/a.htm] Тематики металлургия в целом EN low melting metals … Справочник технического переводчика
легкоплавкие металлы — [low melting metals группа цветных металлов с низкой tпл, включа ющая Zn, Cd, Hg, Sn, Pb, Bi, TI, Sb и элементы с ослабленными металлическими свойствами: Ga, Ge; Смотри также: Металлы щелочные металлы … Энциклопедический словарь по металлургии
легкоплавкие сплавы — [low melting alloys] сплавы с низкой tпл, основные компоненты которых легкоплавкие металлы: Hg (tпл = 39 °С), Ga (30 °С), In (156 °С), Sn (232 °С), Bi (271 *С), Pb (327 °С), Cd (321 °С) и Zn (419 °С) … Энциклопедический словарь по металлургии
Металлы — [metals] простые вещества, обладающие в обычных условиях характерными свойствами: высокой электро и теплопроводностью, отрицательным температурным коэффициентом электропроводности, способностью хорошо отражать электромагнитные волны,… … Энциклопедический словарь по металлургии
ультрачистые металлы — [ultra pure metals] высокочистые, особочистые металлы, в которых массовая доля примесей не превышает 1 • 10 3%. Основные стадии технологии производства ультрачистых металлы: получение чистых химических соединений, восстановление их до… … Энциклопедический словарь по металлургии
чистые металлы — [pure metals] металлы с низким содержанием примесей ( Энциклопедический словарь по металлургии
тугоплавкие металлы — [refractory metals] металлы, у которых tпл > fFe = 1539 °С (например, Cr, V, W, Mo, Nb и др.); применяют как легирующие добавки в стали, а также в качестве основы соответствующих специальных сплавов; Смотри также: Металлы щелочные металлы … Энциклопедический словарь по металлургии
радиоактивные металлы — [radioactive metals] металлы, занимающие места в Периодической системе элементов с атомный номер больше 83 (Bi), испускающие радиоактивные частицы: нейтроны, протоны, альфа , бетачастицы или гамма кванты. В природе обнаружены: At, Ac, Np, Pa, Ро … Энциклопедический словарь по металлургии
переходные металлы — [transition metals] элементы Iб и VIIIб подгруппы Периодической системы. У атомов переходных металлов внутренние оболочки заполнены только частично. Различают d металлы, у которых происходит постепенное заполнение 3d (от Se до Ni), 4d (от Y до… … Энциклопедический словарь по металлургии
Читать также: Сварочные работы при монтаже конструкций
первичные металлы — [primary metals] металлы, полученные из руды или рудных материалов, в отличие от вторичных металлов, полученных из отходов и лома (например, первичный и вторичный Al); Смотри также: Металлы щелочные металлы чистые металлы … Энциклопедический словарь по металлургии
Каждый металл или сплав обладает уникальными свойствами, в число которых входит температура плавления. При этом объект переходит из одного состояния в другое, в конкретном случае становится из твёрдого жидким.
Чтобы его расплавить, необходимо подвести к нему тепло и нагревать до достижения нужной температуры. В момент, когда достигается нужная точка температуры данного сплава, он ещё может остаться в твёрдом состоянии.
При продолжении воздействия начинает плавиться.
Наиболее низкая температура плавления у ртути — она плавится даже при -39 °C, самая высокая у вольфрама — 3422 °C. Для сплавов (стали и других) определить точную цифру крайне сложно. Все зависит от соотношения компонентов в них. У сплавов она записывается как числовой промежуток.
Как происходит процесс
Элементы, какими бы они ни были: золото, железо, чугун, сталь или любой другой — плавятся примерно одинаково. Это происходит при внешнем или внутреннем нагревании.
Внешнее нагревание осуществляется в термической печи. Для внутреннего применяют резистивный нагрев, пропуская электрический ток или индукционный нагрев в электромагнитном поле высокой частоты.
Воздействие при этом примерно одинаковое.
Когда происходит нагревание, усиливается амплитуда тепловых колебаний молекул. Появляются структурные дефекты решётки, сопровождаемые разрывом межатомных связей. Период разрушения решётки и скопления дефектов и называется плавлением.
В зависимости от градуса, при котором плавятся металлы, они разделяются на:
- легкоплавкие — до 600 °C: свинец, цинк, олово;
- среднеплавкие — от 600 °C до 1600 °C: золото, медь, алюминий, чугун, железо и большая часть всех элементов и соединений;
- тугоплавкие — от 1600 °C: хром, вольфрам, молибден, титан.
В зависимости от того, каков максимальный градус, подбирается и плавильный аппарат. Он должен быть тем прочнее, чем сильнее будет нагревание.
Вторая важная величина — градус кипения. Это параметр, при достижении которого начинается кипение жидкостей. Как правило, она в два раза выше градуса плавления. Эти величины прямо пропорциональны между собой и обычно их приводят при нормальном давлении.
Если давление увеличивается, величина плавления тоже увеличивается. Если давление уменьшается, то и она уменьшается.
Таблица характеристик
Металлы и сплавы — непременная основа для ковки, литейного производства, ювелирной продукции и многих других сфер производства. Чтобы не делал мастер (ювелирные украшения из золота, ограды из чугуна, ножи из стали или браслеты из меди), для правильной работы ему необходимо знать температуры, при которых плавится тот или иной элемент.
Читать также: Работа мини дрелью по дереву
Чтобы узнать этот параметр, нужно обратиться к таблице. В таблице также можно найти и градус кипения.
Среди наиболее часто применяемых в быту элементов показатели температуры плавления такие:
- алюминий — 660 °C;
- температура плавления меди — 1083 °C;
- температура плавления золота — 1063 °C;
- серебро — 960 °C;
- олово — 232 °C.
Как понятно из этой части таблицы, самый легкоплавкий металл — ртуть, которая при плюсовых температурах уже находится в жидком состоянии.
Градус кипения всех этих элементов почти вдвое, а иногда и ещё выше градуса плавления. Например, у золота он 2660 °C, у алюминия— 2519 °C, у железа — 2900 °C, у меди — 2580 °C, у ртути — 356,73 °C.
У сплавов типа стали, чугуна и прочих металлов расчёт примерно такой же и зависит от соотношения компонентов в сплаве.
Максимальная температура кипения у металлов — у рения— 5596 °C. Наибольшая температура кипения — у наиболее тугоплавящихся материалов.
Бывают таблицы, в которых также указана плотность металлов. Самым лёгким металлом является литий, самым тяжёлым — осмий. У осмия плотность выше, чем у урана и плутония, если рассматривать её при комнатной температуре.
К лёгким металлам относятся: магний, алюминий, титан. К тяжёлым относится большинство распространённых металлов: железо, медь, цинк, олово и многие другие. Последняя группа — очень тяжёлые металлы, к ним относятся: вольфрам, золото, свинец и другие.
Ещё один показатель, встречающийся в таблицах — это теплопроводность металлов. Хуже всего тепло проводит нептуний, а лучший по теплопроводности металл — серебро. Золото, сталь, железо, чугун и прочие элементы находится посередине между этими двумя крайностями. Чёткие характеристики для каждого можно найти в нужной таблице.
Какой металл считается самым тугоплавким

Металл с давних времён используются человеком в различных сферах деятельности. Чтобы получить качественное металлическое изделие, важно подобрать хороший материал, оценивая при этом его характеристики. Важный параметр — тугоплавкость. Для изготовления некоторых изделий подходят только самые тугоплавкие металлы.
Исторические сведения
Прежде чем изучать характеристики самых тугоплавких металлов в мире следует ознакомиться с их историей открытия. Металлообработка известна человеку несколько тысяч лет. Однако активное получение тугоплавких металлов началось только со второй половины 19 века.
Изначально они использовались только в электротехнике. С появлением новых технологий в строении самолётов, машин, поездов и ракет детали с высоким показателем плавления начали использоваться активнее. Пик популярности заготовок, выдерживающих температуры более 1000 градусов, пришёлся на середину 20 века.
Определение
Тугоплавкий металл — отдельный класс, к которому относятся металлические заготовки, выдерживающие воздействие критически высоких температур. Обычно у представителей этого класса температура плавления более 1600 градусов, что считается точкой плавления железа. К ним относят благородные сплавы. Их ещё называют представителями платиновой группы.
Виды
Виды металлов и сплавов, обладающие устойчивостью к повышенным температурам:
- Вольфрам. Впервые о нем узнали в 1781 году. Чтобы расплавить, его потребовалось разогреть до 3380 градусов. Вольфрам считается самым тугоплавким. Изготавливается он из порошка, который обрабатывается химическим способом. Сначала смесь разогревается, а затем подвергается давлению. На выходе получаются спрессованные заготовки.
- Ниобий. Плавится при 2500 градусах. Обладает высокой теплопроводностью, обрабатывается не так сложно, как вольфрам. Изготавливается из порошка, который запекают и обрабатывают с помощью высокого давления. Из ниобия делают проволоку, трубы и ленту.
- Молибден. Визуально его можно спутать с вольфрамом. Изготавливается он из порошка при запекании и воздействии давлением. Как и вольфрам обладает парамагнетическими свойствами. Используется в радиоэлектронике, изготовлении промышленного оборудования, печей и электродов.
- Тантал. Плавится при 3000 градусах. Чтобы сделать проволоку из тантала или закалить материал, его не нужно нагревать до критических температур. Используется для изготовления элементов в радиоэлектронике (конденсаторы, пленочные резисторы). Популярен в ядерной промышленности.
- Рений. Материал, который ученые открыли позже остальных. Найти его можно в медной и платиновой руде. Используется на промышленном производстве, как легирующая добавка.
К материалам с высокими температурами плавления относится и хром. Благодаря своим уникальным характеристикам он применяется в различных сферах промышленности. Обладает повышенной устойчивостью к критическим температурам и коррозийным процессам. Однако стоит учитывать его хрупкость.
Свойства
Чтобы понимать, где лучше использовать материал, нужно знать свойства тугоплавких металлов. Из них изготавливаются детали для промышленного оборудования, техники и электроники. Характеристики тяжелых тугоплавких металлов будут описаны ниже.
Физические свойства
- Плотность — до 10000 кг/м3. У вольфрама этот показатель достигает 19000 кг/м3.
- Средняя температура плавления — 2500 градусов по Цельсию. Самая высокая температура плавления металла у вольфрама — 3390 градусов.
- Удельная теплоёмкость — 400 Дж.
Тугоплавкие предметы не выдерживают ударов и падений.
Химические свойства
- Это твердые вещества, обладающие высокой химической активностью.
- Прочная межатомная структура.
- Сопротивляемость длительному воздействию кислот и щелочей.
- Высокий показатель парамагнитности.
Эти материалы имеют некоторые недостатки. Главным из них является трудный процесс обработки и изготовления продукции из него.
Применение
Изначально тугоплавкие металлы использовались при изготовлении конденсаторов и транзисторов для радиоэлектроники. Количество их сфер применения увеличилось только к середине 20 века. Промышленной комплекс расширился до изготовления деталей для станков, автомобилей, самолётов и ракет.
Сплавы, выдерживающие воздействие критических температур, начали использоваться для изготовления посуды. Тугоплавкие металлы применяются в процессе производства строительных и соединительных материалов. Из них делают детали для бытовых приборов и электроники.
Самым тугоплавким считается вольфрам. Его температура плавления в 3390 градусов превышает показатели других материалов. Однако нельзя забывать про то, что при падении вольфрамовой детали с высоты, она треснет или разобьётся на отдельные части.
Вольфрам — Самый ТУГОПЛАВКИЙ Металл На ЗЕМЛЕ!
Остальные материалы с высоким показателем плавления, немногим отличаются от вольфрама. Используются в машиностроении, кораблестроении, ядерной энергетики, изготовлении промышленного оборудования.
Их разработка и исследование продолжается и по сей день.
Какой металл считается самым тугоплавким Ссылка на основную публикацию
Самый легкоплавкий металл

Каждый человек множество раз держал в руках самый легкоплавкий металл, причём без всяких последствий. Речь идет о ртути, грозном и загадочном элементе из подгруппы цинка, занимающем в периодической таблице атомный номер 80.
Общие сведения
Название переводится с греческого, как «серебряная вода». На латинском звучит как hydrargyrum, а в русском это толкование праславянского — «катиться». Первая цивилизация шумеров уже вовсю использовала ртуть. Металл добывали из киновари (сульфида ртути) просто обжигая руду, или же из пород, где его видно в виде небольших вкраплений.
Это редкий элемент — общая доля в земных недрах составляет всего 83 мг на одну тонну, причем чаще в рассеянной форме, чем в виде месторождений. Больше всего ее содержится в сульфидах и сланцах, а всего в мире имеется более 20 минералов со ртутью.
Самый легкоплавкий металл
Это единственный из металлов, который может находиться в жидком состоянии при обычной температуре. Такой же и бром, только он относится к галогенам. Твердеет ртуть (и плавится) при -39 °С.
Всего 7 металлов плавятся при минусовой температуре. Литр ртути очень тяжелый — 13,5 кг, а закипит она при +357°С.
Ртуть в природе
Интересно что доказательства ее принадлежности к металлам были опубликованы только в середине XVIII века Брауном и Ломоносовым. Они смогли заморозить ртуть и убедиться в ее металлических свойствах: ковкости, электропроводности, расширении при нагреве.
Самый токсичный металл
Ртути принадлежит высочайшая степень токсичности. Это самый ядовитый из всех нерадиоактивных элементов на планете, который начинает распространять свои пары при комнатной температуре. Если рядом присутствует человек, происходит поражение пищеварения, легких и нервной системы, причём первые признаки интоксикации наступают очень быстро, через 8 часов.
Симптомы отравления ртутью
И даже воздействие небольших доз, но длительный период, способно проявить себя в виде хронических заболеваний. Нервная система в первую очередь реагирует раздражением, недосыпанием, головными болями и быстрой усталостью. Выводится ртуть через почки. Начинаются частые позывы к мочеиспусканию, повышение температуры, рвота, слабость, тошнота, дрожь в теле.
Самая известная экологическая трагедия XX века, болезнь Минамата, вызвана отравлением метилртутью. Промышленное загрязнение бухты этого японского города в 1956 году привело к 3 тыс. жертв.
Люди всегда знали о токсических свойствах ртути. Например, при изготовлении фетровых шляп использовались ртутные соединения, но другого способа тогда не было. У мастеров часто развивались поражения нервной системы и слабоумие. Поэтому безумный Шляпник, описанный Льюисом Кэрроллом в «Алисе в стране чудес», совсем не выдуманный персонаж.
Безумный Шляпник из «Алисы в стране чудес»
В обычной жизни пищевые отравления грозят любителям морепродуктов. Ртуть содержится и растворяется в морской воде, накапливаясь в организмах его обитателей.
Симптомы хронического отравления часто встречаются в прибрежных районах по всему миру. Особенно страдают беременные и дети, у которых это основная пища. Умеренная олигофрения диагностируется там намного чаще, чем у тех групп, где морская рыба не является основным источником питания.
Хищники, поедая мелочь, сохраняют и приумножает отраву в своих организмах. У каждой четвертой выловленной рыбы содержание металла превышает допустимые пределы. Особенно много его в тунце и лобстере. Экологи бьют тревогу, а компании по производству рыбных продуктов открещиваются. И никакая тепловая обработка не делает мясо менее токсичным.
Использование самого легкоплавкого металла в быту
Несмотря на токсичность, человечество до сих пор не может отказаться от ртути.
Хорошая электропроводимость делает ее незаменимой в энергосберегающих лампах, паровых турбинах, вакуумных и диффузных насосах. Умение реагировать на малейшие колебания температуры и давления используется в барометрах и термометрах.
Батарейки, энергосберегающие лампы, аккумуляторы, контакты выключателей — везде содержится этот высокоионизированный металл. В градуснике находится от 1 до 2 гр этого металла (в стандартных российских 1 гр).
Но и эти несколько граммов полностью испарятся из помещения только в течение 20 лет. При концентрации менее 0,25 мгм3 ртуть оседает в легких. При более высоких дозах организм начинает впитывать яд через кожу.
Мужчины менее чувствительны к парам, чем дети и женщины.
Вы можете найти ртуть в холодильнике, стиральной машине и кондиционере. Сельское хозяйство чаще всего использует соли ртути в составе пестицидов. Взрывчатка содержит фульминат ртути, антисептики — сульфат.
Фульминат ртути (взрывчатое вещество)
Не могут отказаться от ртути при окрашивании бортов корабля. Морские микроорганизмы всегда селятся там и существенно разрушают обшивку. Только краска на основе «серебряной воды» помогает сохранить судно.
Человечество с самых древних времен использовало ртуть для добычи из руды драгоценных металлов. Ртуть создает сплавы со всеми металлами (амальгамация) и только благодаря ей добыча серебра и золота в Мексике конкистадорами, начиная XVI века, достигла таких впечатляющих размеров и изменила весь мир.
Добыча золота ртутью
Никогда ртуть не транспортируют в самолетах, причем дело не в токсичности. Ртуть хорошо вступает в контакт со всеми металлами, делая их ломкими. Особенно это касается алюминиевых сплавов — случайная авария может повредить самолет.
Использование самого легкоплавкого металла в медицине
Ядовитый металл чаще всего встречался в эликсирах бессмертия и лекарствах для продления жизни. Алхимики пробовали добывать золото прямо из ртути, только сначала ее надо было нагреть. Ртуть называли праматерью металлов, она входила в теорию трех начал (с серой и солью) и была основным элементом философского камня.
Даже магические действия шаманов не могли обойтись без ртути. Распыляемым порошком киновари отпугивали нечистых духов. Несмотря на токсичность, «серебряную воду» активно использовали древние врачи практически во всех сферах своей деятельности.
Древнеегипетские жрецы клали немного ртути в сосуд и помещали в горло фараона, чтобы обезопасить его в загробной жизни.
В Индии йоги пили ртутно-серный напиток и утверждали, что таким образом можно продлить жизнь. Одним из самых вопиющих случаев в древности было лечение заворота кишок с помощью данного химического элемента.
Врачи были уверены, что жидкое серебро должно замечательно проходить сквозь человеческие кишки, распрямляя их. Но данный способ почему-то не прижился, так как у пациентов от большого объема высокоплотного «лекарства» происходил разрыв желудка.
Утверждают, что Иван Грозный стал жертвой именно ртути. Предположительно, ему или лечили сифилис, или давали лекарства, содержащие ртуть. То, что русский царь умер в результате ртутной интоксикации и имел деформации костей, свойственные глубоким старикам, уже доказано несколькими учеными.
Историки отмечали, что перед смертью царь очень изменился. Постоянная свирепость, искаженные черты лица, на теле не осталось ни единого волоса. Постоянные эпилептические припадки служили очередным доказательством отравления.
Интересно, что мгновенно покончить с жизнью с помощью ртути ни у кого не получалось. Когда самоубийцы выпивали металл — все они выживали. Самыми опасными являются пары и раствор, а сама ртуть никогда не растворится в желудке и выйдет из организма.
В 70-х годах в продаже можно было встретить множество препаратов с ртутью: мочегонные, слабительные, в мазях для отбеливания лица и антисептиках.
Амальгама серебра не так давно была распространенным пломбировочным стоматологическим материалом в России и до сих пор используется в дешевых пломбах за рубежом.
Пломба из амальгамы
Самый легкоплавкий металл на планете необходим человечеству по-прежнему. А вот смогут ли люди дружить с ним, не отравляя жизнь вокруг — очень спорный вопрос…
Наиболее легкоплавкие металлы: свойства, особенности, физические характеристики

Температура плавления – важная характеристика, которая чаще всего применяется именно к металлам. Она зависит от многих физических свойств веществ – их чистоты и кристаллической структуры. Какой металл наиболее легкоплавкий: Li, Al, Hg, Cu? Давайте выясним, кто из них действительно может называться таковым.
Тугоплавкие металлы — характеристики, свойства и применение
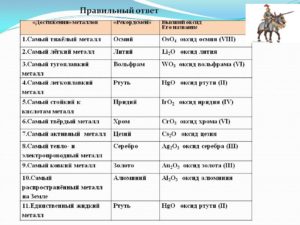
Еще с конца 19 века были известны тугоплавкие металлы. Тогда им не нашлось применения. Единственная отрасль, где их использовали, была электротехника и то в очень ограниченных количествах.
Но все резко поменялось с развитием сверхзвуковой авиации и ракетной техники в 50-е года прошлого столетия.
Производству потребовались новые материалы, способные выдерживать значительные нагрузки в условиях температур свыше 1000 ºC.
Список и характеристики тугоплавких металлов
Тугоплавкость характеризуется повышенным значением температуры перехода из твердого состояния в жидкую фазу. Металлы, плавление которых осуществляется при 1875 ºC и выше, относят к группе тугоплавких металлов. По порядку возрастания температуры плавки сюда входят следующие их виды:
- Ванадий
- Хром
- Родий
- Гафний
- Рутений
- Вольфрам
- Иридий
- Тантал
- Молибден
- Осмий
- Рений
- Ниобий.
Современное производство по количеству месторождений и уровню добычи удовлетворяют только вольфрам, молибден, ванадий и хром. Рутений, иридий, родий и осмий встречаются в естественных условиях довольно редко. Их годовое производство не превышает 1,6 тонны.
Жаропрочные металлы обладают следующими основными недостатками:
- Повышенная хладноломкость. Особенно она выражена у вольфрама, молибдена и хрома. Температура перехода у металла от вязкого состояния к хрупкому чуть выше 100 ºC, что создает неудобства при их обработке давлением.
- Неустойчивость к окислению. Из-за этого при температуре свыше 1000 ºC тугоплавкие металлы применяются только с предварительным нанесением на их поверхность гальванических покрытий. Хром наиболее устойчив к процессам окисления, но как тугоплавкий металл он имеет самую низкую температуру плавления.
К наиболее перспективным тугоплавким металлам относят ниобий и молибден. Это связано с их распространённостью в природе, а, следовательно, и низкой стоимостью в сравнении с другими элементами данной группы.
Помимо этого, ниобий зарекомендовал себя как металл с относительно низкой плотностью, повышенной технологичностью и довольно высокой тугоплавкостью. Молибден ценен, в первую очередь, своей удельной прочностью и жаростойкостью.
Самый тугоплавкий металл встречаемый в природе — вольфрам. Его механические характеристики не падают при температуре окружающей среды свыше 1800 ºC. Но перечисленные выше недостатки плюс повышенная плотность ограничивают его область использования в производстве. Как чистый металл он применяется все реже и реже. Зато увеличивается ценность вольфрама как легирующего компонента.
Физико-механические свойства
Металлы с высокой температурой плавления (тугоплавкие) являются переходными элементами. Согласно таблице Менделеева выделяют 2 их разновидности:
- Подгруппа 5A – тантал, ванадий и ниобий.
- Подгруппа 6A – вольфрам, хром и молибден.
Наименьшей плотностью обладает ванадий – 6100 кгм3, наибольшей вольфрам – 19300 кгм3. Удельный вес остальных металлов находится в рамках этих значений. Эти металлы отличаются малым коэффициентом линейного расширения, пониженной упругостью и теплопроводностью.
Данные металлы плохо проводят электрический ток, но обладает таким качеством как сверхпроводимость. Температура сверхпроводящего режима составляет 0,05-9 К исходя из вида металла.
Абсолютно все тугоплавкие металлы отличаются повышенной пластичностью в комнатных условиях. Вольфрам и молибден помимо этого выделяются на фоне остальных металлов более высокой жаропрочностью.
Коррозионная стойкость
Жаропрочным металлам свойственна высокая стойкость к большинству видов агрессивных сред. Сопротивление коррозии элементов 5A подгрупп увеличивается от ванадия к танталу. Как пример, при 25 ºC ванадий растворяется в царской водке, между тем как ниобий полностью инертен по отношению к данной кислоте.
Тантал, ванадий и ниобий отличаются устойчивостью к воздействию расплавленных щелочных металлов. При условии отсутствия в их составе кислорода, которые значительно усиливает интенсивность протекания химической реакции.
Молибден, хром и вольфрам имеют большую сопротивляемость к коррозии. Так азотная кислота, которая активно растворяет ванадий, значительно менее воздействует на молибден. При температуре 20 ºC данная реакция вообще полностью останавливается.
Все тугоплавкие металлы охотно вступают в химическую связь с газами. Поглощение водорода из окружающей среды ниобием осуществляется при 250 ºC. Тантал при 500 ºC. Единственный способ остановить эти процессы – проведение вакуумного отжига при 1000 ºC. Стоит заметить, что вольфрам, хром и молибден куда менее склонны к взаимодействию с газами.
Как уже было сказано ранее, лишь хром отличается сопротивляемостью к окислению. Данное свойство обусловлено его способностью образовывать твердую пленку оксида хрома на своей поверхности. Растворение кислорода хромом происходит только при 700 С. У остальных тугоплавких металлов процессы окисления начинаются ориентировочно при 550 ºC.
Хладноломкость
Распространению использования жаропрочных металлов в производстве мешает обладание ими повышенной склонности к хладноломкости. Это означает, что при падении температуры ниже определенного уровня происходит резкое возрастание хрупкости металла. Для ванадия такой температурой служит отметка в -195 ºC, для ниобия -120 ºC, а вольфрама +330 ºC.
Наличие хладноломкости жаропрочными металлами обусловлено содержанием примесями в их составе. Молибден особой чистоты (99,995%) сохраняет повышенные пластические свойства вплоть до температуры жидкого азота. Но внедрение всего 0,1% кислорода сдвигает точку хладноломкости к -20 С.
Области применения
До середины 40-х годов тугоплавкие металлы использовались только как легирующие элементы для улучшения механических характеристик стальных цветных сплавов на основе меди и никеля в электропромышленности. Соединения молибдена и вольфрама применялись также в производстве твердых сплавов.
Техническая революция, связанная с активным развитием авиации, ядерной промышленности и ракетостроения, нашла новые способы использования тугоплавких металлов. Вот неполный перечень новых сфер применения:
8 Легкоплавкие металлы и сплавы на их основе
Каждый металл и их сплавы имеют различные свойства. Одно из таких свойств — температура плавления. Каждый металл плавится при разной температуре. Все что нужно для перевода вещества из твёрдого состояния в жидкое — источник тепла, который будет разогревать металл до определенной температуры.
Так как у каждого металла температура плавления различная, можно определить менее устойчивый металл к температуре и более. Так самый легкоплавкий металл — ртуть, он готов перейти в жидкое состоянии при температуре равно 39 градусов по цельсию. А вот вольфрам( из чего собственно и сделаны вольфрамовые электроды для аргоновой сварки), расплавится только по достижению температуры в 3422 градусов цельсии.

Что касается сплавов, таких как сталь и прочих, определить температуру, при которой те будут плавиться, довольно сложно. Вся сложность в их составе… Так как состав разный, то и температура плавления различная. Как правило, для сплавов указывается диапазон температур, при которых он будет плавиться. Вообще, температура плавления металлов интересная тема.
Способы плавления
Способов плавления два — внешний и внутренний. Каждый из способов по своему эффективен. Во время применений внешнего способа плавления, на металл или сплав воздействуют теплом с наружи, на пример в печи. А в случае с внутренним, через металл пропускается высокий разряд электрического тока или воздействуют электромагнитным полем.

На фото индукционный электромагнитный нагреватель металла для кузнечного дела.
Самый легкоплавкий металл
- Общие сведения
- Самый токсичный металл
- Использование самого легкоплавкого металла в быту
- Использование самого легкоплавкого металла в медицине
Каждый человек множество раз держал в руках самый легкоплавкий металл, причём без всяких последствий. Речь идет о ртути, грозном и загадочном элементе из подгруппы цинка, занимающем в периодической таблице атомный номер 80.
Общие сведения
Название переводится с греческого, как «серебряная вода». На латинском звучит как hydrargyrum, а в русском это толкование праславянского — «катиться».
Первая цивилизация шумеров уже вовсю использовала ртуть.
Металл добывали из киновари (сульфида ртути) просто обжигая руду, или же из пород, где его видно в виде небольших вкраплений.
Это редкий элемент — общая доля в земных недрах составляет всего 83 мг на одну тонну, причем чаще в рассеянной форме, чем в виде месторождений. Больше всего ее содержится в сульфидах и сланцах, а всего в мире имеется более 20 минералов со ртутью.
Самый легкоплавкий металл
Это единственный из металлов, который может находиться в жидком состоянии при обычной температуре. Такой же и бром, только он относится к галогенам. Твердеет ртуть (и плавится) при -39 °С.
Всего 7 металлов плавятся при минусовой температуре. Литр ртути очень тяжелый — 13,5 кг, а закипит она при +357°С.
Ртуть в природе
Интересно что доказательства ее принадлежности к металлам были опубликованы только в середине XVIII века Брауном и Ломоносовым. Они смогли заморозить ртуть и убедиться в ее металлических свойствах: ковкости, электропроводности, расширении при нагреве.
Самый токсичный металл
Ртути принадлежит высочайшая степень токсичности.
Это самый ядовитый из всех нерадиоактивных элементов на планете, который начинает распространять свои пары при комнатной температуре.
Если рядом присутствует человек, происходит поражение пищеварения, легких и нервной системы, причём первые признаки интоксикации наступают очень быстро, через 8 часов.
Симптомы отравления ртутью
И даже воздействие небольших доз, но длительный период, способно проявить себя в виде хронических заболеваний.
Нервная система в первую очередь реагирует раздражением, недосыпанием, головными болями и быстрой усталостью. Выводится ртуть через почки.
Начинаются частые позывы к мочеиспусканию, повышение температуры, рвота, слабость, тошнота, дрожь в теле.
Самая известная экологическая трагедия XX века, болезнь Минамата, вызвана отравлением метилртутью. Промышленное загрязнение бухты этого японского города в 1956 году привело к 3 тыс. жертв.
Люди всегда знали о токсических свойствах ртути. Например, при изготовлении фетровых шляп использовались ртутные соединения, но другого способа тогда не было.
У мастеров часто развивались поражения нервной системы и слабоумие.
Поэтому безумный Шляпник, описанный Льюисом Кэрроллом в «Алисе в стране чудес», совсем не выдуманный персонаж.
Безумный Шляпник из «Алисы в стране чудес»
В обычной жизни пищевые отравления грозят любителям морепродуктов. Ртуть содержится и растворяется в морской воде, накапливаясь в организмах его обитателей.
Симптомы хронического отравления часто встречаются в прибрежных районах по всему миру. Особенно страдают беременные и дети, у которых это основная пища. Умеренная олигофрения диагностируется там намного чаще, чем у тех групп, где морская рыба не является основным источником питания.
Хищники, поедая мелочь, сохраняют и приумножает отраву в своих организмах. У каждой четвертой выловленной рыбы содержание металла превышает допустимые пределы.
Особенно много его в тунце и лобстере. Экологи бьют тревогу, а компании по производству рыбных продуктов открещиваются.
И никакая тепловая обработка не делает мясо менее токсичным.
Использование самого легкоплавкого металла в быту
Несмотря на токсичность, человечество до сих пор не может отказаться от ртути.
Хорошая электропроводимость делает ее незаменимой в энергосберегающих лампах, паровых турбинах, вакуумных и диффузных насосах. Умение реагировать на малейшие колебания температуры и давления используется в барометрах и термометрах.
Батарейки, энергосберегающие лампы, аккумуляторы, контакты выключателей — везде содержится этот высокоионизированный металл. В градуснике находится от 1 до 2 гр этого металла (в стандартных российских 1 гр).
Но и эти несколько граммов полностью испарятся из помещения только в течение 20 лет. При концентрации менее 0,25 мгм3 ртуть оседает в легких. При более высоких дозах организм начинает впитывать яд через кожу.
Мужчины менее чувствительны к парам, чем дети и женщины.
Вы можете найти ртуть в холодильнике, стиральной машине и кондиционере. Сельское хозяйство чаще всего использует соли ртути в составе пестицидов. Взрывчатка содержит фульминат ртути, антисептики — сульфат.
Фульминат ртути (взрывчатое вещество)
Не могут отказаться от ртути при окрашивании бортов корабля. Морские микроорганизмы всегда селятся там и существенно разрушают обшивку. Только краска на основе «серебряной воды» помогает сохранить судно.
Человечество с самых древних времен использовало ртуть для добычи из руды драгоценных металлов. Ртуть создает сплавы со всеми металлами (амальгамация) и только благодаря ей добыча серебра и золота в Мексике конкистадорами, начиная XVI века, достигла таких впечатляющих размеров и изменила весь мир.
Добыча золота ртутью
Никогда ртуть не транспортируют в самолетах, причем дело не в токсичности. Ртуть хорошо вступает в контакт со всеми металлами, делая их ломкими. Особенно это касается алюминиевых сплавов — случайная авария может повредить самолет.
Таблицы плавления металлов и сплавов
Ниже, представлены таблицы, для наглядного знакомства с температурами плавления тех или иных металлов и их сплавов.
Таблица температуры плавления легкоплавких металлов и сплавов
Таблица с температурами плавления легкоплавких металлов
| Название | Обозначение | Плавление | Кипение |
| Олово | Sn | 232°C | 2600°C |
| Свинец | Pb | 327°C | 1750°C |
| Цинк | Zn | 420°C | 907°C |
| Калий | K | 63,6°C | 759°C |
| Натрий | Na | 97,8°C | 883°C |
| Ртуть | Hg | 38,9°C | 356.73°C |
| Цезий | Cs | 28,4°C | 667.5°C |
| Висмут | Bi | 271,4°C | 1564°C |
| Палладий | Pd | 327,5°C | 1749°C |
| Полоний | Po | 254°C | 962°C |
| Кадмий | Cd | 321,07°C | 767°C |
| Рубидий | Rb | 39,3°C | 688°C |
| Галлий | Ga | 29,76°C | 2204°C |
| Индий | In | 156,6°C | 2072°C |
| Таллий | Tl | 304°C | 1473°C |
| Литий | Li | 18,05°C | 1342°C |
Таблица температуры плавления среднеплавких металлов и сплавов
Таблица температур плавления среднеплавких металлов и сплавов
| Название | Обозначение | t Плавления | t Кипения |
| Алюминий | Al | 660°C | 2519°C |
| Германий | Ge | 937°C | 2830°C |
| Магний | Mg | 650°C | 1100°C |
| Серебро | Ag | 960°C | 2180°C |
| Золото | Au | 1063°C | 2660°C |
| Медь | Cu | 1083°C | 2580°C |
| Железо | Fe | 1539°C | 2900°C |
| Кремний | Si | 1415°C | 2350°C |
| Никель | Ni | 1455°C | 2913°C |
| Барий | Ba | 727°C | 1897°C |
| Бериллий | Be | 1287°C | 2471°C |
| Нептуний | Np | 644°C | 3901,85°C |
| Протактиний | Pa | 1572°C | 4027°C |
| Плутоний | Pu | 640°C | 3228°C |
| Актиний | Ac | 1051°C | 3198°C |
| Кальций | Ca | 842°C | 1484°C |
| Радий | Ra | 700°C | 1736,85°C |
| Кобальт | Co | 1495°C | 2927°C |
| Сурьма | Sb | 630,63°C | 1587°C |
| Стронций | Sr | 777°C | 1382°C |
| Уран | U | 1135°C | 4131°C |
| Марганец | Mn | 1246°C | 2061°C |
| Константин | 1260°C | ||
| Дуралюмин | Сплав алюминия, магния, меди и марганца | 650°C | |
| Инвар | Сплав никеля и железа | 1425°C | |
| Латунь | Сплав меди и цинка | 1000°C | |
| Нейзильбер | Сплав меди, цинка и никеля | 1100°C | |
| Нихром | Сплав никеля, хрома, кремния, железа, марганца и алюминия | 1400°C | |
| Сталь | Сплав железа и углерода | 1300°C — 1500°C | |
| Фехраль | Сплав хрома, железа, алюминия, марганца и кремния | 1460°C | |
| Чугун | Сплав железа и углерода | 1100°C — 1300°C |
Таблица температуры плавления тугоплавких металлов и сплавов
Таблица температур плавления тугоплавких металлов и сплавов
| Название | Обозначение | t Плавления °C | t Кипения °C |
| Вольфрам | W | 3420 | 5555 |
| Титан | Ti | 1680 | 3300 |
| Иридий | Ir | 2447 | 4428 |
| Осмий | Os | 3054 | 5012 |
| Платина | Pt | 1769,3 | 3825 |
| Рений | Re | 3186 | 5596 |
| Хром | Cr | 1907 | 2671 |
| Родий | Rh | 1964 | 3695 |
| Рутений | Ru | 2334 | 4150 |
| Гафний | Hf | 2233 | 4603 |
| Тантал | Ta | 3017 | 5458 |
| Технеций | Tc | 2157 | 4265 |
| Торий | Th | 1750 | 4788 |
| Ванадий | V | 1910 | 3407 |
| Цирконий | Zr | 1855 | 4409 |
| Ниобий | Nb | 2477 | 4744 |
| Молибден | Mo | 2623 | 4639 |
| Карбиды гафния | 3890 | ||
| Карбиды ниобия | 3760 | ||
| Карбиды титана | 3150 | ||
| Карбиды циркония | 3530 |





Самый тугоплавкий металл на земле
Любознательных людей наверняка интересует вопрос, какой металл самый тугоплавкий? Прежде чем дать на него ответ, стоит разобраться с сами понятием тугоплавкости.
Все известные науки металлы имеют разную температуру плавления в связи с различной степенью устойчивости связей между атомами в кристаллической решетке.
Чем слабее эта связь, тем меньшая температура требуется, чтобы ее разорвать.
Самые тугоплавкие металлы в мире используются в чистом виде или в составе сплавов для производства деталей, которые работают в экстремальных термических условиях.
Они позволяют эффективно противостоять высоким температурам и значительно продляют эксплуатационный период агрегатов.
Но стойкость металлов данной группы к термическому воздействию заставляет металлургов прибегать к нестандартным методам их производства.
Какой металл самый тугоплавкий?
Самый тугоплавкий металл на Земле был открыт в 1781 году шведским ученым Карлом Вильгельмом Шееле. Новый материал получил название вольфрам. Шееле удалось синтезировать триокись вольфрама путем растворения руды в азотной кислоте.
Чистый металл был выделен двумя годами позже испанскими химиками Фаусто Фермином и Хуаном Хосе де Элюар. Новый элемент не сразу получил признание и был взят на вооружение промышленниками.
Дело в том, что технологии того времени не позволяли обрабатывать столь тугоплавкое вещество, поэтому большинство современников не придали особого значения научному открытию.
Вольфрам был оценен гораздо позже. На сегодняшний день его сплавы используются при производстве термостойких деталей для различных отраслей промышленности. Нить накаливания в газоразрядных бытовых лампах также изготавливается из вольфрама.
Также он применяется в аэрокосмической промышленности для производства ракетных сопел, используется в качестве многоразовых электродов в газодуговой сварке.
Кроме тугоплавкости вольфрам также обладает высокой плотностью, что позволяет использовать его для изготовления высококачественных клюшек для гольфа.
Соединения вольфрама с неметаллами также широко применяется в промышленности.
Так сульфид используется в качестве термостойкой смазки, способной переносить температуры до 500 градусов по Цельсию, карбид служит для изготовления резцов, абразивных дисков и сверл, способных обрабатывать самые твердые вещества и переносить высокие температуры нагрева. Рассмотрим, наконец, промышленное получение вольфрама. Самый тугоплавкий металл имеет температуру плавления 3422 градуса по Цельсию.
Как получают вольфрам?
В природе чистый вольфрам не встречается. Он входит в состав горных пород в виде триоксида, а также вольфрамитов железа, марганца и кальция, реже меди или свинца. По оценкам ученых содержание вольфрама в земной коре в среднем составляет 1,3 грамма на одну тонну.
Это достаточно редкий элемент по сравнению с другими видами металлов. вольфрама в руде после добычи обычно не превышает 2%.
Поэтому добытое сырье отправляется на обогатительные фабрики, где методом магнитной или электростатической сепарации массовая доля металла доводится до отметки 55-60%.
Процесс его получения разделяется на технологические этапы. На первом этапе выделяют чистый триоксид из добытой руды. Для этого используют метод термического разложения.
При температурах от 500 до 800 градусов по Цельсию все лишние элементы расплавляются, а тугоплавкий вольфрам в виде оксида легко можно собрать из расплава.
На выходе получается сырье с содержанием оксида шестивалентного вольфрама на уровне 99%.
Полученное соединение тщательно измельчают и проводят восстановительную реакцию в присутствии водорода при температуре 700 градусов по Цельсию. Это позволяет выделить чистый металл в виде порошка.
Далее его спрессовывают под высоким давлением и спекают в водородной среде при температурах 1200-1300 градусов по Цельсию.
После этого полученная масса отправляется в электрическую плавильную печь, где под воздействием тока нагревается до температуры свыше 3000 градусов. Так вольфрам переходит в расплавленное состояние.
Для окончательной очистки от примесей и получения монокристаллической структурной решетки используется метод зонной плавки.
Он подразумевает, что в определенный момент времени расплавленной находится только некоторая зона из общей площади металла.
Постепенно двигаясь, эта зона перераспределяет примеси, в результате чего в конечном итоге они скапливаются в одном месте и их легко можно удалить из структуры сплава.
Готовый вольфрам поступает на склад в виде штабиков или слитков, предназначенных для последующего производства нужной продукции. Для получения сплавов вольфрама все составные элементы измельчают и смешивают в виде порошка в необходимых пропорциях. Далее производится спекание и плавка в электрической печи.
| Основным составным веществом алюминевого сплава является, как становится ясно из названия, алюминий. К другим, наиболее распространенным элементами, которые входят в состав сплавов на основе алюминия, можно отнести медь, железо, цинк… |
Ртуть
Полезный во многих сферах, но ядовитый металл был известен еще до нашей эры. Ртуть использовали античные и средневековые медики для лечения венерических и многих других заболеваний, алхимики пытались сделать из нее золото. Сегодня она применяется в электротехнике, приборостроении и органической химии.
Руть – это наиболее легкоплавкий металл на планете. При нормальных комнатных условиях она всегда жидкая, так как температура ее плавления составляет -39 градуса. Ее пары очень опасны, поэтому ртуть содержат только в контейнерах и специальных стеклянных колбах. На организм она действует как яд, отравляя его и выводя из строя нервную, иммунную, дыхательную и пищеварительную системы.
Галлий
Вторым в списке наиболее легкоплавких металлов находится галлий. Он становится жидкостью при температуре выше 29,5 градусов Цельсия, и размягчить его можно просто подержав немного в руках. При нормальных условиях галлий очень хрупкий, легко поддается механическому воздействию и окрашен в светло-серебристый, несколько голубоватый оттенок.
Металл очень рассеян в земной коре и не встречается в виде самородков. В природе его находят в составе различных минералов, таких как гранат, мусковит, турмалин, хлорит, полевой шпат. Кроме того, он содержится в морской воде. Галлий используют в высокочастотной электронике, для изготовления зеркал и различных сплавов.
Источник https://ometalledo.ru/kakoj-samyj-legkoplavkij-metall.html
Источник https://smontage.ru/stanki/samyj-plavkij-metall-v-mire.html
Источник