Серебро: свойства, пробы, покрытия и особенности драгоценного металла
В предыдущей статье ТД Серебро рассказал о том, почему некоторые металлы считаются драгоценными. Оказалось, этому есть простое объяснение: они обладают уникальными химическими, физическими и эстетическими свойствами.
Каждый металл уникален по-своему, но в нашей компании с особым уважением относятся к благородному серебру. Оно стало основой ассортимента торгового дома, является одним из главных металлов ювелирного дела и очень широко востребовано в лёгкой и тяжёлой промышленности. С серебром связаны удивительные факты и несколько мифов — некоторые мы подтвердим, другие развеем, и всё это будет интересно.

Дисклеймер: мы не стремимся рассказать всё, а хотим дать вам общее понимание тех вещей, которые будут полезны при выборе украшений. Мы же ювелирная компания. Если вы хотите глубоко разобраться в этих вопросах, стоит подумать о специальном образовании.
Физика
Серебро — драгоценный металл белого цвета. Его плотность 10,5 г/см³, температура правления 960,5°С, температура кипения 2210°С, твёрдость по методу Бринелля в отожжённом состоянии (после отжига) 25 кгс/мм². Неспециалисту эти цифры говорят мало, но они очень важны для тех, кто занимается обработкой материала. В зависимости от этих показателей к металлу прикладываются разные силы и методы, чтобы придать готовым изделиям желаемые свойства.
Отжиг — это высокотемпературная обработка для придания металлу более устойчивого состояния, устранения неоднородностей, снятия напряжений из-за деформации. Сплавы серебра отжигаются при температуре 600–650°С с выдержкой до десяти минут в зависимости от массы и с резким охлаждением. Отжигу подвергаются практически все ювелирные украшения из серебра.
Серебро хорошо полируется, имеет высокую отражательную способность, обладает хорошей ковкостью и самыми высокими из всех металлов тепло- и электропроводностью.
Химия
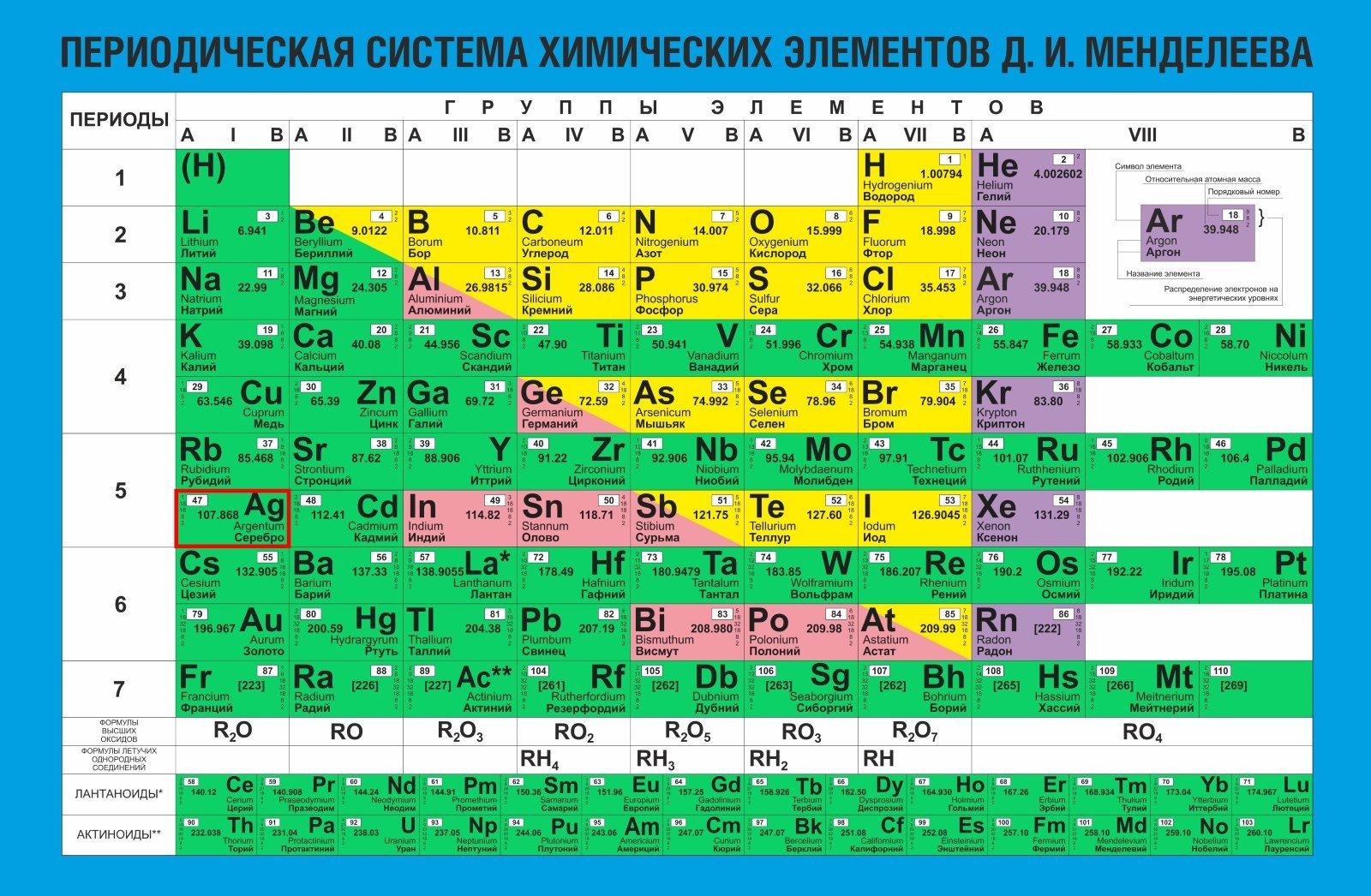
Серебро устойчиво в воде, практически не реагирует с кислородом воздуха при комнатной температуре, но из-за наличия в воздухе сероводорода со временем покрывается тончайшим тёмным налётом сульфида серебра. Также серебро реагирует с озоном, образуя налёт оксида серебра. Вот то самое потемнение, которое считают главным недостатком этого металла.
Медь, которая является наиболее распространённой лигатурой сплавов серебра, тоже образует налёт — из сульфида меди. Чем больше содержание меди в сплаве, тем быстрее потемнеет изделие, а чем меньше, тем менее сплав подвержен потускнению, поэтому наиболее устойчивыми считаются сплавы от 875 до 960 пробы.
Лигатура — сплав из двух и более компонентов, который добавляется к драгоценному металлу для доведения ювелирного сплава до определённой пробы, изменения цвета сплава, а также придания различных полезных свойств. Процесс добавления лигатуры называют легированием.
Серебро растворяется в азотной и горячей концентрированной серной кислоте. Как и золото, оно взаимодействует со щёлочными растворами цианидов. Вероятно, с этими вещами вы никогда не столкнётесь. А если столкнётесь, будьте очень осторожны.
Сплавы серебра
Чистое серебро — тяжёлый (легче свинца, но тяжелее меди и твёрже золота), необычайно пластичный серебристо-белый металл с коэффициентом отражения света около 100%, поэтому в чистом виде серебро обычно используют только для покрытия украшений из сплавов серебра, из недрагоценных металлов, как компонент золотых и серебряных лигатур и припоев.
В изготовлении ювелирных украшений, чтобы повысить твёрдость и прочность материала, серебро обрабатывают в сплавах с другими металлами. Чаще всего это двухкомпонентные сплавы серебра с медью в различном процентном соотношении и с незначительным количеством примесей.
Серебряные сплавы слегка различаются по оттенкам и обладают приблизительно одинаковыми механическими свойствами. Из сплавов с низким содержанием серебра изготавливают предметы сервировки стола, декоративные настольные украшения. Для производства ювелирных изделий используют сплавы высокой пробы. Они достаточно пластичны, хорошо сочетаются с цветными камнями, жемчугом и эмалью.
Пробы серебра
В Российской Федерации принята метрическая система проб. Метрическая проба — это количество миллиграммов основного благородного металла, не менее которого содержит один грамм сплава.
Например, в серебряном сплаве 925 пробы на грамм приходится 925 миллиграммов серебра. Для простоты можно считать, что при 925 пробе в сплаве 92,5% серебра.
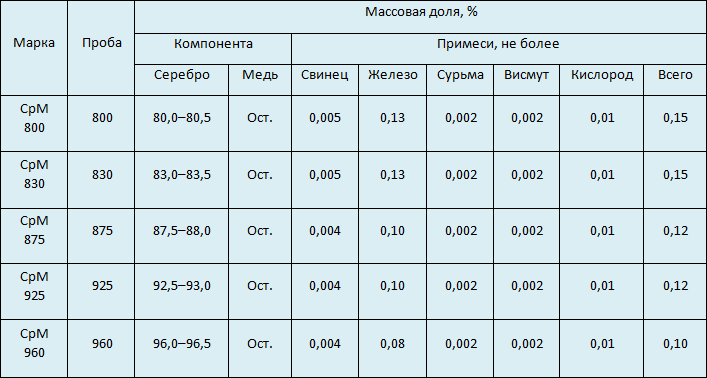
- 800. Сплав с высоким содержанием меди, из-за чего имеет желтоватый оттенок. Подходит для столовых приборов.
- 830. Свойства идентичны 800-й пробе. Применяется для декоративных украшений.
- 875. Используется при промышленном изготовлении ювелирных и бытовых изделий — например, ручек.
- 916. Применяется для производства предметов столовой сервировки с покрытием эмалью.
- 925. По цвету и антикоррозийным свойствам не отличается от чистого серебра. Этот сплав широко применяется для изготовления ювелирных украшений.
- 960. Применяется для изготовления филигранных изделий.
- 999. Подходит для хранения металла в слитках и серебрения, то есть покрытия украшений тонким слоем серебра для защиты и улучшения декоративных свойств.
В производстве ювелирных украшений наиболее распространены 875 и 925 пробы. Современный российский ГОСТ 30649-99 описывает пять марок сплавов на основе серебра. Во всех лигатурой является медь.
Покрытия изделий из серебра
В настоящее время наиболее технологичными видами и способами покрытий изделий из серебра являются:
- «Белое» кипячение — кипячение в серной или соляной кислоте для снижения содержания реагирующей с сероводородом меди в тонком поверхностном слое изделия. Поверхность приобретает матовый оттенок.
- Гальваническое покрытие — нанесение тонкого слоя драгоценного металла электрогальваническим методом. В настоящее время гальваника является самым популярным способом защиты и декорирования ювелирных изделий из серебра. В зависимости от металла, выполняющего функцию защитного слоя, используют следующие виды покрытий:
- Серебрение — покрытие тонким слоем чистого серебра, которое слабее сплавов реагирует с сероводородом воздуха.
- Родирование — покрытие слоем белого, и, реже, чёрного или жёлтого родия. Родий является драгоценным металлом платиновой группы. Он износостоек, не темнеет, обладает красивым зеркальным светло-стальным блеском, поэтому в последние 10–15 лет стал одним из самых популярных покрытий на ювелирном рынке. Родиевое покрытие в случае ремонта при пайке чернеет и трескается. В этом случае старое покрытие приходится снимать и наносить новое.
- Золочение — покрытие золотом. Активно применяется для полного или частичного декорирования изделий из серебра.
- Пассивирование (пассивация) — перевод верхнего слоя сплава в пассивное состояние, резко замедляющее коррозийные процессы. Выполняет исключительно защитную функцию.
- Оксидирование — разновидность пассивирования, создание на поверхности металла плотной плёнки оксидов, предохраняющих его от коррозии. Является одновременно методом декоративного и защитного покрытия.
- Электорофорезное осаждение — покрытие органическим пенополиуретаном или акрилом путём погружения в водный раствор эпоксидной или акриловой смолы под воздействием напряжения. Выполняет только защитную функцию.
Применение
Из серебра изготавливают украшения, часы, предметы сервировки стола, украшения для интерьера, письменные принадлежности, декоративные элементы оружия. Серебро можно сочетать с золотом, эмалью, чернью, драгоценными и полудрагоценными камнями, жемчугом, кораллами, слоновой костью. Металл широко востребован в химической промышленности, при производстве зеркал, а также как защитное и декоративное покрытие. Высокие тепло- и электропроводность делают серебро полезным при производстве электроники и электротехники.
Мифы о серебре
- Чернеет поддельное серебро, а настоящее (старое, качественное) не чернеет
Подделка тоже может чернеть по самым разным причинам, но если вы внимательно прочитали нашу статью, то поняли, что образование тонкого слоя оксида или сульфида серебра нормально для этого металла, это его химическая особенность. А в старых украшениях в качестве лигатур использовали не медь, а палладий и платину. Такой сплав действительно не темнел, зато был намного дороже. Это химия, ничего личного.
- Серебро обеззараживает
Это чистая правда, серебро обладает бактериостатическими свойствами, замедляя развитие бактерий, и бактерицидным эффектом, убивая бактерии с помощью ионов серебра. Но это проявляется только в концентрации, которая может оказаться вредной и для нас с вами, ведь серебро — тяжёлый металл, оно откладывается в организме и может вызвать отравление. Носить его безопасно, а вот есть мы не рекомендуем.
А ещё вы можете вытащить ложки, кольца и подвески из воды: в таком случае выделяется так мало ионов серебра, что они не в состоянии ничего обеззаразить. Это также значит, что можно не бояться серебряной посуды и столовых приборов. Если пользоваться специальным ионизатором, эффект будет, но с ним легко превысить допустимую концентрацию и опять же получить отравление.
Если вы читаете на английском, вот отчёт ВОЗ о применении серебра для обеззараживания, который в целом повторяет вышеприведённые выводы и говорит о недостатке информации для далекоидущих выводов в большинстве исследований на эту тему.
- Серебро прогоняет нечисть
Этот миф мы предлагаем вам проверить самостоятельно. Найдите вампира и пронзите серебряным мечом, но соблюдайте меры предосторожности: если меч родированный, эффект может разочаровать.
Магний — лёгкий, ковкий металл серебристо-белого цвета.
Ма́гний — элемент второй группы (по старой классификации — главной подгруппы второй группы), третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 12. Обозначается символом Mg (лат. Magnesium). Простое вещество магний — лёгкий, ковкий металл серебристо-белого цвета.

В 1695 году из минеральной воды Эпсомского источника в Англии выделили соль, обладавшую горьким вкусом и слабительным действием. Аптекари назвали её «горькой солью», а также «английской» или «эпсомской солью». Минерал эпсомит представляет собой кристаллогидрат сульфата магния и имеет химическую формулу MgSO4 · 7H2O. Латинское название элемента происходит от названия древнего города Магнезия в Малой Азии, в окрестностях которого имеются залежи минерала магнезита.
В 1792 году Антон фон Рупрехт выделил из белой магнезии восстановлением углём неизвестный металл, названный им австрием. Позже было установлено, что «австрий» представляет собой магний крайне низкой степени чистоты, поскольку исходное вещество было сильно загрязнено железом.
В 1808 г. английский химик Гемфри Дэви с помощью электролиза увлажнённой смеси магнезии и оксида ртути получил амальгаму неизвестного металла, которому дал название «магнезиум», сохранившееся до сих пор во многих странах. В России с 1831 года принято название «магний». В 1829 г. французский химик А. Бюсси получил магний, восстанавливая его расплавленный хлорид металлическим калием. В 1830 г. М. Фарадей получил магний электролизом расплавленного хлорида магния.

Физические свойства
Магний — металл серебристо-белого цвета с гексагональной решёткой, обладает металлическим блеском; пространственная группа P 63/mmc, параметры решётки a = 0,32029 нм, c = 0,52000 нм, Z = 2. При обычных условиях поверхность магния покрыта довольно прочной защитной плёнкой оксида магния MgO, которая разрушается при нагреве на воздухе до примерно 600 °C, после чего металл сгорает с ослепительно белым пламенем с образованием оксида и нитрида магния Mg3N2. Скорость воспламенения магния намного выше скорости одёргивания руки, поэтому при поджоге магния человек не успевает одёрнуть руку и получает ожог. На горящий магний желательно смотреть только через темные очки или стекло, так как в противном случае есть риск получить световой ожог сетчатки и на время ослепнуть.
Плотность магния при 20 °C — 1,738 г/см³, температура плавления 650 °C, температура кипения 1090 °C, теплопроводность при 20 °C — 156 Вт/(м·К).
Магний высокой чистоты пластичен, хорошо прессуется, прокатывается и поддаётся обработке резанием.

Химические свойства
При нагревании на воздухе магний сгорает с образованием оксида и небольшого количества нитрида. При этом выделяется большое количество теплоты и света.
Магний хорошо горит даже в углекислом газе.
Раскаленный магний энергично реагирует с водой, вследствие чего горящий магний нельзя тушить водой.
Щелочи на магний не действуют, в кислотах он растворяется с бурным выделением водорода.
Смесь порошка магния со взрывом реагирует с сильными окислителями, например с сухим перманганатом калия.

Применение
Металлический магний применяется для восстановления титана до металла из тетрахлорида титана.
Используется для получения лёгких и сверхлёгких литейных сплавов (самолётостроение, производство автомобилей), а также в пиротехнике и военном деле для изготовления осветительных и зажигательных ракет. Со второй половины ХХ века магний в чистом виде и в составе сплава кремния с железом — ферросиликомагния, стал широко применяться в чугунолитейном производстве благодаря открытию его свойства влиять на форму графита в чугуне, что позволило создать новые уникальные конструкционные материалы для машиностроения — высокопрочный чугун (чугун с шаровидным графитом — ЧШГ и чугун с вермикулярной формой графита -ЧВГ), сочетающие в себе свойства чугуна и стали.
Сплавы на основе магния является важным конструкционным материалом в авиационной и автомобильной промышленности благодаря их лёгкости и прочности.
Магний в виде чистого металла, а также его химические соединения (бромид, перхлорат) применяются для производства энергоёмких резервных электрических батарей (например, магний-перхлоратный элемент, серно-магниевый элемент, хлористосвинцово-магниевый элемент, хлорсеребряно-магниевый элемент, хлористомедно-магниевый элемент, магний-ванадиевый элемент и др.) и сухих элементов (марганцево-магниевый элемент, висмутисто-магниевый элемент, магний-м-ДНБ элемент и др.). Химические источники тока на основе магния отличаются очень высокими значениями удельных энергетических характеристик и высокой ЭДС.
Гидрид магния — один из наиболее ёмких аккумуляторов водорода, применяемых для его компактного хранения и получения.
Оксид магния MgO применяется в качестве огнеупорного материала для производства тиглей и специальной футеровки металлургических печей.
Перхлорат магния, Mg(ClO4)2 — (ангидрон) применяется для глубокой осушки газов в лабораториях, и в качестве электролита для химических источников тока с применением магния.
Фторид магния MgF2 — в виде синтетических монокристаллов применяется в оптике (линзы, призмы).
Бромид магния MgBr2 — в качестве электролита для химических резервных источников тока.
Свойство магния гореть белым ослепительным пламенем широко используется в военной технике для изготовления осветительных и сигнальных ракет, трассирующих пуль и снарядов, зажигательных бомб. В смеси с соответствующими окислителями он также является основным компонентом заряда светошумовых боеприпасов.
Магний является жизненно-важным элементом, который находится во всех тканях организма и необходим для нормального функционирования клеток. Участвует в большинстве реакций обмена веществ, в регуляции передачи нервных импульсов и в сокращении мышц, оказывает спазмолитическое и антиагрегантное действие. Оксид и соли магния традиционно применяются в медицине в кардиологии, неврологии и гастроэнтерологии (аспаркам, сульфат магния, цитрат магния). В то же время, использование солей магния в кардиологии при нормальном уровне ионов магния в крови является недостаточно обоснованным.
Наиболее интересным природным ресурсом магния является минерал бишофит. Оказалось, что магниевые эффекты бишофита в первую очередь проявляются при транскутанном (через кожу) применении в лечении патологии опорно-двигательного аппарата. Бишофитотерапия использует биологические эффекты природного магния в лечении и реабилитации широкого круга заболеваний, в первую очередь — позвоночника и суставов, последствий травм, нервной и сердечно-сосудистой систем.
Магниевый порошок с окисляющими добавками (нитрат бария, перманганат калия, гипохлорит натрия, хлорат калия и т. д.) применялся (и применяется сейчас в редких случаях) в фотоделе в химических фотовспышках (магниевая фотовспышка).
Магниево-серные батареи являются одними из самых перспективных, теоретически превосходя ёмкость ионно-литиевых, однако пока эта технология находится на стадии лабораторных исследований в силу непреодолённости некоторых технических препятствий.



Стихи про магний
Магний — есть на то и магний,
Чтобы быть в земле родной.
Он металл, он очень плавкий.
Белый цвет, не золотой.
Он везде играет место.
Человек, трава и тварь.
Хлорофилл — его покой.
Сердцу даже снимет боль.
Щелочей не образует.
С щелочью реакций нет.
Но с кистой образует
Соль и водород, как нет?
Он горит так эффективно,
Что ослепнуть просто можно.
Загорится он так ярко,
Свет тушите, господа!
Для фотографа он важен.
Для врача, а что же нет?
Да и сотня душ, да в плен
В нем найдет спасения свет.
Минералов очень много:
Кизерит, доломит, брусит.
Магнезит, эпсомит, карналлит.
И в воде из моря много.
Напоследок, ради факта,
Я скажу тебе секрет:
Не носи с собой брони ты,
Лучше магний да вода!
Я – магний, легкий, серебристый.
Сгораю даже очень быстро,
Сверкая вспышкою огня.
(Фотограф раньше знал меня).
Люблю я серу, хлор, азот.
Люблю я также водород.
Других оксидов не боюсь,
К воде – спокойней отношусь.
Белок сшиваю я в клубок,
Работать мозгу я помог,
Чтоб лист зеленый не был хилым –
Вхожу в состав я хлорофилла.
Мамы, папы, ребятишки,
Вспомните про фотовспышки,
От которых вы мигали.
Вспышке много лет, ребята.
Знайте, Магний поджигали
Все фотографы когда-то.
Загораясь в Кислороде,
Магний вспыхивает ярко,
Снопы света производит.
Если фейерверки в парках,
Или праздничный салют,
Значит, Магний тут как тут!
Сей металл – вполне активный,
Яркий, легкий и спортивный!
В природе магний — горы доломита
Нагромождает в горные хребты.
В асбесте, тальке он, и в магнезите,
В голубизне морских глубин.
Он символом земной жизни
На голубой планете стал,
Ведь магний это фотосинтез
И жизнь зеленого листа.
Без магния нет хлорофилла
И жизни как таковой
Он чудодейственная сила
В нем жизни всей круговорот
Химически он энергичен,
И химикам помог не раз
Внеси его хоть в пламя спички
Он вспыхнет и сгорит тотчас.
Сплав с алюминием легчайший
Дает он марки «Электрон»,
В когорту сплавов им крылатых
Как равноценный входит он.
А ты в аптеку загляни-ка
И убедиться сам изволь!
Там магний тоже знаменитость
Ведь он — слабительная соль!
В таблицу снова загляните,
Соседа натрия найдите.
Про магний скажете в момент:
«Он двухвалентный элемент».
Сравните с щелочным металлом.
Различны эти вещества:
Слабее металличность стала,
Зато валентность возросла.
Свободный магний не ищите,
Металла не найти в горе,
Содержится он в магнезите (MgCO3),
А магнезит — в земной коре.
Возьмите магний в виде ленты.
Он серебрится и блестит.
А подожжете, так мгновенно
Он ярко вспыхнет и сгорит.
С «т» на конце он непременно
Железо поднимает вверх.
Придёт «и краткое» на смену,
И он устроит фейерверк.
(Магний)
Он — угрожает нам бедой,
Подбросит огненные очи;
И — запророчит к полуночи,
Тряхнув священной бородой…
Так в ночи вспыхивает магний,
Бьёт электрический магнит;
И над поклонниками Агни,
Взлетев, из джунглей заогнит…
Серебро, описание металла, свойства и характеристики, полезные факты
Всё про драгоценный металл серебро, от легенды до фактов и описания

Один из драгоценных металлов – серебро (Ag), оно знакомо человечеству давно, также как золото раньше оно добывалось самородками, его еще не выплавляли из руды. Серебро использовалось в течение тысячелетий в качестве украшений и посуды, для торговли и в качестве основы для многих денежных систем. Из всех металлов чистое серебро имеет самый белый цвет, самую высокую оптическую отражательную способность и самую высокую тепловую и электрическую проводимость. Кроме того, галогениды серебра являются светочувствительными.
Благодаря вышеупомянутым свойствам серебро имеет множество промышленных применений, таких как зеркала, электротехнические и электронные изделия и фотография, что является крупнейшим конечным применением серебра. Каталитические свойства серебра делают его идеальным для использования в качестве катализатора в реакциях окисления; например, получение формальдегида из метанола и воздуха с помощью серебряных сит или кристаллитов, содержащих минимум 99,95 мас.% серебра.
Это мягкий металл отличается хорошей пластичностью, легко поддается обработке. Плавится при температуре – 962 градуса, имеет плотность – 10,5 г/куб.см. Из серебра изготавливают ювелирные украшения, посуду, монеты. Значительный вклад серебра в электронную промышленность, из него изготавливают различные детали для точных приборов, проволоку и так далее.
Серебро в чистом виде — тяжелый металл. Обладает высокой теплопроводностью и имеет высокую электропроводимость. Это благородный металл, не растворяется в соляной кислоте и серной. Но при нагретых кислотах и отсутствия кислорода, может вступить в реакцию.
Похожиестатьи
Как расплавить серебро, чтобы сделать украшения
Как отличить золото от подделок в домашних условиях: особенности, рекомендации
Сусальное золото, характеристики и описание, вопросы
Растворяется в ртути, образуется амальгама. Для травления серебра применяется хлорное железо. Красивый белый цвет металл позволяет изготавливать из него изумительные ювелирные украшения. В связи с тем, что серебро мягкий металл для изделий из него используют смеси, добавками служат цветные металлы, самый применяемый – медь.
Серебро активно вступает в связь с различными молекулами, поэтому вода в серебряной посуде обеззараживается, а малая концентрация металла служит укрепляющим организм средством для человека.

Однако следует помнить, что серебро, это металл и пить воду, которая имеет его ионы, не следует. Драгоценный металл применяется для изготовления некоторых лекарств и зубных паст, используется производстве строительных материалов. Редко можно встретить в природе самородки серебра, сегодня его добывают из руды, затем обогащают, проводя через электрический ток. При такой обработке чистое серебро оседает в виде кристаллов, затем его превращают в сплавы. Для изготовления украшений применяется сплав серебра и меди.

Получается прочный сплав, который прекрасно обрабатывается и полируется, имеет красивый цвет. Проба на сплав устанавливается так же, как и на золото, в зависимости от процентного содержания драгоценного металла. При низкой пробе, серебро быстро темнеет. Постоянный уход за ювелирным украшением позволяет владельцу наслаждаться красотой и изяществом серебра.
Серебро часто играет вторую скрипку с другим драгоценным металлом, золотом, но этот элемент обладает особыми свойствами, которые заслуживают хорошего внешнего вида.
Например, из всех металлов чистое серебро является лучшим проводником тепла и электричества, согласно Национальной лаборатории линейных ускорителей им . Джефферсона . Это также лучший отражатель видимого света, поэтому его обычно используют для изготовления зеркал — хотя серебро тускнеет и становится темно-серым при воздействии воздуха, что требует периодической полировки.
Чистое серебро слишком мягкое для таких продуктов, как ювелирные изделия и посуда, поэтому лучшими вилками и ножами в семье, скорее всего, являются стерлинговое серебро, сплав из 92,5% серебра и 7,5% меди (хотя иногда используются другие металлы). Серебро также используется в некоторых электрониках и батареях. По данным Королевского химического общества (RSC), поскольку металл обладает антимикробными свойствами, наночастицы серебра можно вплетать в одежду, чтобы предотвратить накопление бактерий на отложениях пота и масел.
Только факты о серебре
- Атомный номер (количество протонов в ядре): 47
- Атомный символ (в периодической таблице элементов): Ag
- Атомный вес (средняя масса атома): 107,8682
- Плотность: 10,501 грамм на кубический сантиметр
- Фаза при комнатной температуре: Твердый
- Температура плавления: 1763,2 градуса по Фаренгейту (961,78 градуса по Цельсию)
- Точка кипения: 3924 F (2 162 C)
- Количество изотопов (атомов одного и того же элемента с разным количеством нейтронов): 66; 2 конюшня
- Наиболее распространенные изотопы: Ag-107 (естественная численность 51,839%) и Ag-109 (естественная численность 48,161%)
История серебра
История серебра долгая. По данным RSC, первые свидетельства добычи серебра датируются 3000 г. до н.э. в Турции и Греции. Древние люди даже придумали, как очищать серебро. Они нагрели серебряную руду и выпустили над ней воздух, процесс, называемый купелированием. Серебро не реагирует на воздух, но основные металлы, такие как свинец и медь, окисляются и отделяются от драгоценного металла.
Серебро образуется в звездных взрывах, называемых сверхновыми, как и золото. Исследование, опубликованное в сентябре 2012 года в журнале Astronomy and Astrophysics, показало, что маленькие звезды, которые взрываются, производят серебро, в то время как большие звезды производят золото.
Серебро действительно взорвалось на Земле, однако, когда европейцы высадились в Новом Свете в 1492 году. Испанские завоеватели обнаружили, что Южная Америка была домом для богатых жил серебра и серебряной руды, и они с энтузиазмом добывали это богатство;Согласно данным Серебряного института , отраслевой торговой группы, 85% серебра, производимого в мире, приходилось на Боливию, Перу и Мексику в период между 1500 и 1800 годами.
Серебро сыграло большую роль в создании возможности ранней фотографии. Нитрат серебра (серебро в сочетании с молекулами азота и кислорода) использовался на фотографических пластинах в первых, неуклюжих камерах, согласно RSC, потому что он реагирует на свет, становясь черным — позволяя фотографам захватывать мгновение света. Даже с появлением цифровых камер серебро остается частью традиционного фотографического процесса.
По состоянию на 2003 год, имеются самые последние данные за год, 1920 метрических тонн серебра ежегодно использовалось для фотографических целей. Электрическое и электронное использование было вторым наиболее распространенным единым промышленным применением серебра: в 2003 году в провода и гаджеты было вложено 1230 метрических тонн. Ювелирные изделия, стерлинговое серебро и гальванические изделия из серебра заняли третье место, использовав всего 486 метрических тонн. Еще 1,
Кто знал эти данные?
- Атомный символ серебра — Ag, который, кажется, имеет мало отношения к названию элемента. На самом деле Ag — сокращение от argentums, латинское слово для серебра. Слово «серебро» происходит от англосаксонского слова seolfor.
- Первым огромным серебряным ударом в Соединенных Штатах был Comstock Lode в Неваде, впервые обнаруженный в 1857 году двумя братьями, которые умерли до того, как смогли воспользоваться преимуществами своего требования. По данным Online Nevada , в период с 1859 по 1992 год с земли было добыто 305 779 612,48 долларов.
- Там нет сомнений по этому поводу; серебро красиво, и люди давно так думали. В феврале 2014 года археологи обнаружили находку из серебра, в том числе пять сережек-обручей , на участке в 3200 лет в Израиле.
- Серебро обладает антимикробными свойствами, но это не делает его хорошим вариантом для домашних средств. Поставщики гомеопатии иногда продают коллоидное серебро для различных жалоб на здоровье, но употребление этого вещества имеет странный побочный эффект: кожа становится синей .
- Оставьте хорошее серебро в ящике между Рождествами, и оно может потускнеть. Так как же серебряные экспонаты музея остаются такими блестящими? Они покрыты прозрачными лаками. Исследователи работают над созданием покрытий нанометровой толщины, которые могут заменить современные лаки с ручной росписью чем-то более тонким, полностью невидимым и долговечным.
Текущее исследование
Антимикробные свойства серебра положили этот элемент в сумку с приемами врача; По данным Wounds International , серебро использовалось для предотвращения заражения травмами в течение сотен лет. Серебро не убивает микробы в металлической форме, в которой оно не реагирует. Металл действует против бактерий только в ионной форме — он должен потерять электрон, чтобы стать положительно заряженным. Положительно заряженный ион серебра воздействует на стенки бактериальных клеток и нарушает другие микробные процессы.
Пациенты с ожогами могут использовать серебряно-антибиотические кремы при травмах, а в некоторых больницах используют серебряные повязки для лечения кожных язв и других средств для ухода за ранами.
Однако в этой области ведутся дебаты об эффективности этих повязок, особенно после того, как обзор 2010 года, опубликованный в Кокрановской базе данных системных обзоров, показал, что они не ускоряют заживление ран. Однако в 2012 году рабочая группа медицинских работников Wounds International утверждала, что повязки могут быть полезны при локализованных инфекциях.
Некоторые производители использовали антимикробную магию серебра как маркетинговую возможность, создавая наполненный серебром текстиль, призванный помешать вонючим бактериям создать магазин в ткани.
Проблема, по словам Бернда Новака, исследователя из Empa, Швейцарской федеральной лаборатории материаловедения и технологии, заключается в том, что вы не знаете, что получаете в этих тканях, наполненных серебром. На самом деле, производители могут даже не знать, что они делают.
« Они могут добавлять компаунд, но, возможно, во время производства, всего этого умирая и делая ткань, они могут трансформировать некоторые материалы», — сказал Новак в интервью Live Science. В многочисленных исследованиях он и его коллеги обнаружили, что формы серебра, предположительно присутствующие в этих высокотехнологичных текстильных изделиях, редко бывают теми, которые на самом деле внедрены в ткань.
«Все они содержат огромное разнообразие различных серебряных форм, и иногда форма, которая должна была быть там, составляла, возможно, 30 процентов, а остальные 70 процентов были другими серебряными формами», — сказал Новак.
Это важно, потому что некоторые формы серебра взаимодействуют с бактериями не так легко, как другие. Например, погруженное в волокно серебро буквально тускнеет, смешиваясь с серой с образованием сульфида серебра. По словам Новака, сульфид серебра не работает. Это не реагирует, чтобы убить бактерии.
В идеале в ткани, наполненной серебром, вместо обычного серебра будут использоваться наночастицы, поскольку наночастицы высвобождаются с правильной скоростью, чтобы сохранить тонкую серебряную пленку на ткани, предотвращая бактериальную опору. Однако в настоящее время, по словам Новака, нет хорошего способа указать на ткань и точно сказать, что серебро в ней находится в нано-форме.
На самом деле, при прохождении рубашки с обычными серебряными нитями через шайбу будет выделяться больше наночастиц серебра, чем при использовании рубашки, наполненной наносеребром, во время цикла полоскания, сообщил Новак и его коллеги в журнале ACS Nano в июне 2014 года .
По словам Новака, существуют способы улучшить эксплуатационные характеристики тканей, наполненных серебром, в том числе встраивать серебро непосредственно в волокна, а не обрабатывать их поверхности. В конечном счете, однако, серебро может быть слишком реактивным, чтобы быть подходящим для ткани. В конце концов, бесполезно, если ваша одежда тускнеет, как серебро.
Химики классифицируют серебро как переходный металл . Переходные металлы являются элементами между группами 2 и 13 в периодической таблице. Периодическая таблица представляет собой диаграмму, которая показывает, как химические элементы связаны друг с другом. Более 40 элементов, все металлы, попадают в диапазон переходных металлов.
Серебро также классифицируется как драгоценный металл. Драгоценные металлы не очень распространены в земной коре. Они привлекательны и не очень химически активны. Эти свойства делают металл желательным в ювелирных изделиях, монетах и искусстве. Приблизительно полдюжины металлов около серебра в периодической таблице — также драгоценные металлы. К ним относятся золото, платина, палладий, родий и индий.
Серебро использовалось людьми на протяжении тысячелетий. Это часто происходит как свободный элемент в природе. Это может также быть извлечено из его руд довольно легко. Эти свойства позволили ранним людям легко узнать о серебре.
Сегодня самое важное использование серебра в фотографии. В фотографии используются три соединения серебра: хлорид серебра (AgCl), бромид серебра (AgBr) и йодид серебра (AgI). Серебро также используется для изготовления электрооборудования, зеркал, медицинского и стоматологического оборудования, а также ювелирных изделий. Это часто используется, чтобы сделать сплавы с золотом для некоторых из этих заявлений. Сплав изготавливается путем плавления и смешивания двух или более металлов. Смесь имеет свойства, отличные от свойств отдельных металлов.
Открытие и присвоение имен
Серебро, вероятно, было впервые обнаружено после золота и меди. Золото и медь часто встречаются в природе как свободные элементы. Они имеют очень характерные цвета, которые позволили ранним людям легко находить эти металлы.
Серебро также встречается в виде свободного металла, но гораздо реже, чем золото или медь. В какой-то момент люди научились добывать серебро из его руд. Но это открытие должно было произойти очень рано в истории человечества. Археологи (ученые, изучающие древние цивилизации) обнаружили в Египте серебряные предметы, датируемые примерно 3400 г. до н.э. Рисунки на некоторых из самых старых пирамид показывают людей, работающих с металлом, вероятно, добывающих серебро из его руд.
Другие ранние культуры также использовали серебро. Письменные записи из Индии описывают металл еще в 900 г. до н.э. Серебро было широко распространено в Америке, когда впервые появились европейцы.
Библия содержит много ссылок на серебро. Металл использовался как способ оплаты за предметы. Он также украшал храмы, дворцы и другие важные здания. Библия также содержит разделы, описывающие изготовление серебра.
Слово «серебро» восходит, по крайней мере, к 12 веку нашей эры. Похоже, оно произошло от старого английского слова, использованного для описания металла seolfor. Символ серебра (Ag), однако, происходит от его латинского названия argentum. Название, возможно, произошло от греческого слова argos, что означает «блестящий» или «белый».
Физические свойства
Серебро — это мягкий белый металл с блестящей поверхностью. Это самый пластичный и ковкий металл. Пластичный означает, что может быть втянут в тонкие провода. Податливость означает, что она может быть забита тонкими листами. Серебро имеет два других уникальных свойства. Он проводит тепло и электричество лучше, чем любой другой элемент. Он также очень хорошо отражает свет.
Температура плавления серебра составляет 961,5 ° C (1762 ° F), а его температура кипения составляет примерно от 2000 до 2200 ° C (от 3600 до 4000 ° F). Его плотность составляет 10,49 грамм на кубический сантиметр.
Рисунки на некоторых из самых старых пирамид показывают людей, работающих с металлом, вероятно, добывающих серебро из его руд.
Химические свойства
Серебро очень неактивный металл. Он не реагирует с кислородом в воздухе при нормальных условиях. Однако он медленно реагирует с соединениями серы в воздухе. Продуктом этой реакции является сульфид серебра (Ag 2 S), соединение черного цвета. На поверхности серебра и других посеребренных предметов со временем образуется тусклость — сульфид серебра.
Серебро плохо реагирует с водой, кислотами или многими другими соединениями. Он не горит, кроме как серебряный порошок.
Появление в природе
Серебро — довольно редкий элемент в земной коре. Его численность оценивается примерно в 0,1 части на миллион. Это также найдено в морской воде. Считается, что его изобилие составляет около 0,01 части на миллион.
Серебро обычно встречается в сочетании с рудами других металлов, особенно свинцовых . Наиболее распространенными серебряными рудами являются аргентит (Ag 2 S); кераргирит или «серебро рога» (AgCl); прустит (3Ag 2 S ○ As 2 S 3 ); и пираргирит (Ag 2 S ○ Sb 2 S 3 ).
Крупнейшими производителями серебра в мире являются Мексика, Перу, США, Канада, Польша, Чили и Австралия. В Соединенных Штатах серебро добывается примерно на 76 рудниках в 16 штатах. Крупнейшими государственными производителями являются Невада, Айдахо и Аризона. На эти три штата приходится около двух третей всего серебра, добываемого в Соединенных Штатах.
Изотопы
Существуют два естественных изотопа серебра: серебро-107 и серебро-109. Изотопы — это две или более формы элемента. Изотопы отличаются друг от друга по их массовому числу. Число, написанное справа от имени элемента, является массовым числом. Массовое число представляет количество протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого одного элемента может варьироваться. Каждая вариация является изотопом.
Известно также около 16 радиоактивных изотопов серебра. Радиоактивный изотоп — это тот, который распадается на части и испускает некоторую форму радиации. Радиоактивные изотопы образуются, когда очень маленькие частицы обжигают атомы. Эти частицы прилипают к атомам и делают их радиоактивными.
Ни один из радиоактивных изотопов серебра не имеет коммерческого использования.
Снижение, которое развивается в течение долгого времени на серебряных изделиях и других посеребренных объектах, является сульфидом серебра.
экстракция
Руды, богатые серебром, давно исчезли из-за добычи. Сегодня серебро обычно поступает из руд, которые содержат очень небольшое количество металла. Эти суммы могут варьироваться от нескольких тысячных
Небольшой процент серебра, произведенного в Соединенных Штатах, используется для монет. Старый серебряный доллар «Мир», показанный здесь, чеканился с 1921 по 1935 год.унции за тонну руды до 100 унций за тонну. Металл чаще всего производится как побочный продукт добычи других металлов. После удаления первичного металла отходы часто содержат небольшое количество серебра. Эти отходы обрабатываются химическими веществами, которые реагируют с серебром. Серебро может быть затем извлечено электролизом . Электролиз — это процесс, при котором соединение разрушается при пропускании через него электрического тока.
Использование и соединения
Около 10 процентов серебра, произведенного в Соединенных Штатах, используется в монетах, ювелирных изделиях и произведениях искусства. Одним из способов использования серебра является сплавы с золотом. Золото очень желательно для монет и ювелирных изделий. Но он слишком мягкий, чтобы использовать его в чистом виде.
Однако добавление серебра в золото делает сплав намного прочнее и долговечнее. Большинство «золотых» объектов сегодня — это на самом деле сплавы, часто сплавы серебра и золота.
Однако другие объекты используют гораздо больше серебряного металла. Около половины произведенного в Соединенных Штатах серебра уходит на фотопленку . Чистое серебро сначала превращается в соединение: хлорид серебра, бромид серебра или йодид серебра. Затем этот состав используется для изготовления фотопленки (см. Прилагаемую боковую панель).
Второе по важности использование серебра — это электрическое и электронное оборудование. Около 20 процентов всего произведенного серебра используется для этой цели. Серебро на самом деле является наиболее желательным из всех металлов для электрооборудования. Электричество течет через серебро легче, чем через любой другой металл. Однако в большинстве случаев используются такие металлы, как медь или алюминий , потому что они дешевле.
Важная роль серебра в проявлении
T принимая к фотографии зависит от простой химической идеи: Свет может вызвать электроны двигаться вокруг. Вот что это значит: Серебристый металл будет соединяться с хлором, бромом или йодом с образованием соединений. Как пример: в этой реакции каждый атом серебра теряет один электрон на атом хлора. Атом серебра становится «на один электрон меньше» того, что он обычно имеет. Одноэлектронно-короткий атом серебра называется ионом серебра.
Фотопленка покрыта тонким слоем хлорида серебра, бромида серебра или йодида серебра. Это означает, что пленка покрыта многими ионами серебра. Ионы серебра бесцветны, поэтому у фотопленки нет цвета.
Что происходит, когда фотопленка подвергается воздействию света? Свет дает энергию электронам в фотопленке. Некоторые из этих электронов возвращаются к ионам серебра, превращая их обратно в атомы:
Но атомы серебра не бесцветны. Они черные. Таким образом, фотопленка, подверженная воздействию света, становится черной в каждой точке, где свет попадает на ион серебра.
Конечно, при съемке не все фильмы получают одинаковое количество света. Например, изображение человека будет иметь области, которые становятся намного ярче, чем другие. Так что некоторые места в фильме становятся очень темными, а другие — менее темными.
Необходимы дополнительные шаги, чтобы «разработать» фотопленку или сделать из нее картинку. Но первый шаг в фотографировании — это замена ионов серебра обратно на атомы серебра с помощью света.
Но иногда электрическое устройство настолько важно, что его стоимость не учитывается. Например, электрические устройства на космических кораблях, спутниках и самолетах должны работать надежно и эффективно. Стоимость использования серебра не так важна, как в бытовых приборах. Таким образом, серебро используется для электропроводки и соединений в этих устройствах.
В некоторых случаях, серебро покрытие решает практическую задачу , где дороже серебро будет работать лучше. Посеребрение — это процесс, с помощью которого очень тонкий слой серебра наносится поверх другого металла. Серебро настолько податливо, что его можно забивать тоньше, чем лист бумаги. Серебро это тонкое можно наносить на другой металл.
Затем другой металл приобретает некоторые свойства серебряного покрытия. Например, он может очень хорошо работать в качестве отражателя, потому что серебро является таким хорошим отражателем. Не имеет значения, является ли второй металл хорошим отражателем или нет. Серебряное покрытие служит отражающей поверхностью в комбинации.
Около пятой части всего произведенного серебра используется во многих других продуктах. Например, это часто используется в зубных амальгамах. Амальгама — это сплав, в котором ртуть является одним из используемых металлов. Серебряные амальгамы хорошо подходят для пломбирования разрушенных зубов. Они нетоксичны и не разрушаются и не вступают в реакцию с другими материалами очень легко. Серебро также используется в специализированных батареях, в том числе серебряно- цинковых и серебро- кадмиевых .
Электричество течет через серебро легче, чем через любой другой металл.
Влияние на здоровье
Серебро является умеренно токсичным элементом. Когда металл или его соединения попадают на кожу, они могут вызвать голубоватый внешний вид , известный как аргирии или argyrosis. Вдыхание серебряной пыли может иметь серьезные долгосрочные последствия для здоровья. Максимальная рекомендуемая выдержка для серебряной пыли составляет 0,1 миллиграмма на кубический метр воздуха.
Источник https://uvelir.info/articles/serebro-svojstva-probyi-pokryitiya-i-osobennosti-dragotsennogo-metalla/
Источник https://xn—-7sbbblh9b0av4l.xn--j1amh/blog/2017/11/20/%D0%BC%D0%B0%D0%B3%D0%BD%D0%B8%D0%B9-%D0%BB%D1%91%D0%B3%D0%BA%D0%B8%D0%B9-%D0%BA%D0%BE%D0%B2%D0%BA%D0%B8%D0%B9-%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB-%D1%81%D0%B5%D1%80%D0%B5%D0%B1%D1%80%D0%B8%D1%81/
Источник https://drag-zoloto.ru/dragocennye-metally/serebro-opisanie-metalla-svojstva-i-harakteristiki-poleznye-fakty/