Содержание
Чем дейтериевая вода отличается от обычной?

Виды воды
Формулу воды(H2O) знают даже те, кто почти не учил в школе химию, а вот про ее тяжелую разновидность слышал далеко не каждый. В привычной для нас жидкости содержится 2 атома водорода и 1 кислорода. В типичном состоянии водород содержит только один протон, но также существуют атомы, в которых находится 2 или 3 ядра, их считают изотопами. Химические свойства элемента настолько близки к атому обычного водорода, что он образует такие же молекулы. Поэтому вместо привычной легкой воды существует еще и дейтерия, которая значительно отличается от нее.
Физические свойства
По некоторым параметрам D2O (дейтериевая вода) схожа с обычной жидкостью, но в остальных параметрах они кардинально отличаются. Рассмотрим основные из них:
- Цвет. Тяжелая и легкая вода не отличаются по этому параметру. Во всех состояниях D2O остается прозрачной. Поэтому ее легко перепутать с питьевой жидкостью, особенно если ее налить в кружку или графин. Отличия заметны только по вкусу, в ней как будто присутствует сахар. Изменение цвета у сверхтяжелой воды происходит только при наличии примесей.
- Запах. Вода в сточных водах и D2O не отличаются и по этому критерию. Гнилось, хлористость и другие посторонние примеси говорят о проблемах резервуара, но не о качестве жидкости.
- Температура кипения. У легкой воды этот процесс запускается при 100 °C, а у тяжелой — 101,7 °C. Такие же небольшие отличия есть еще по температуре кристаллизации, разница составляет 3,82 ед.
- Молекулярная масса. При рассмотрении того, какая вода тяжелее, получается, что D2O весит больше, но тоже лишь на 2 ед. Благодаря этому меняется скорость обменных процессов.
- Растворимость. Сверхтяжелая вода быстро перемешивается с этанолом, но соль размешать в ней уже труднее, поэтому для бытовых нужд она не подходит.
Как ее получают?
70 лет назад жидкость добывали только во время электролиза, но по мере развития технологий появился ректификационный водород и изотопный обмен в разных модификациях.
Сейчас на производстве используют метод, во время которого используют жидкость из электролитических цехов. Так появляется водород, а жидкость при этом содержит около 0,2% тяжелой воды. В результате изотопного обмена концентрация повышается до 10%. После этого начинается ступенчатый электролиз с щелочью, там показатель увеличивается до 99%.

Стоимость полученного раствора определяют в зависимости от его чистоты. Дома получить такую жидкость без специального оборудования не удастся.
Где используют?
Когда ученые только обнаружили тяжелую воду и выявили ее основные свойства, они не могли найти применение этому веществу. Оксид дейтерия не использовался 5 лет, после стал очевиден процесс деления ядер, поэтому для жидкости нашли промышленное применение.
Ядерные технологии
Сейчас мнения физиков раздваиваются, поскольку некоторые ученые видят настолько большой потенциал у тяжелой воды, что называют ее топливом будущего. Она уже используется для регулирования термоядерного синтеза, правда вносит в этот процесс свои коррективы.
Из-за высокой перспективности некоторые государства даже контролируют коммерческий оборот и устанавливают свои нормативы. Такие меры оправданы, поскольку иначе возникнет риск создания неконтролируемых установок, которые работают на природном уране.
Лаборатория, медицина
Оксид дейтерия используется во всех отраслях, где становится актуален. В медицине его адаптировали для предотвращения быстрого размножения микроорганизмов, биологи тоже активно пользуются этим свойством. Сейчас тяжелая вода используется еще и в качестве растворителя или индикатора при выполнении анализов.

Полностью влияние D2O на живые организмы все еще не изучено. Некоторые считают, что она действует почти также, как тяжелые металлы в воде. Ученые провели серию экспериментов и обнаружили неоднозначные результаты, которые менялись в зависимости от концентрации тяжелой воды в обычной жидкости:
- 20% — домашний скот активно растет и набирает мышечную массу, а куры больше несутся;
- 50% — живые организмы быстрее развиваются, у них наступает раннее половое созревание;
- 70% — наступает преждевременное старение, ухудшается обмен веществ, появляются опухоли, некоторые органы отказывают.

Ядерные реакторы
Благодаря своим физическим свойствам жидкость способна замедлить нейроны, которые регулируют синтез. Тяжелая вода избавляет от необходимости установки нефритовых стержней, которые опасны из-за радиоактивности и угрозы взрыва. В реакторах элемент используют еще в качестве носителя, который отводит тепло из зоны с цепной реакцией.

Влияние на людей
D2O содержится в атмосфере тысячелетиями, поэтому в небольших количествах она попадает в питьевую воду. В таком виде жидкость не опасна. Проводить эксперименты с повышением ее концентрации не рекомендуется, поскольку даже во время экспериментов с животными еще не удалось достичь стабильного результата.
Иногда люди сравнивают металлы в сточных водах и D2O, но даже по физическим свойствам они отличаются. Тяжелая вода почти не проходит через клеточные мембраны, из-за этого организм быстро угнетается, замедляются химические реакции.

Несколько стаканов высококонцентрированной тяжелой воды не навредят здоровью и самочувствию. Некоторые врачи используют ее для лечения гипертонии. Однако, к этому процессу подходят с осторожностью, поскольку есть высокий риск развития побочных эффектов.
Тяжелые металлы в воде
Некоторые путают жесткую и тяжелую воду, хотя это два совершенно разных понятия. В первом случае подразумевается наличие тяжелых металлов, среди которых железо, марганец, свинец, медь и ртуть.
Очистка воды от тяжелых металлов происходит через фильтры. Методом обратного осмоса или сорбции из жидкости удаляют нежелательные элементы. С тяжелой водой такого сделать не получится. Ни одно очистительное сооружение не справится с этим, поскольку между частицами дейтерия и протия нет существенной разницы.

Тяжелая вода содержится в организме каждого человека и регулярно попадает в питьевую воду. Она широко используется в промышленной отрасли и считается перспективным топливом, но все ее свойства и влияние на живые организмы до конца остаются не изучены.
Тяжёлые металлы в воде
ТЯЖЕЛЫЕ МЕТАЛЛЫ В ЭКОЛОГИЧЕСКОМ МОНИТОРИНГЕ ВОДНЫХ СИСТЕМ
HEAVY METALS IN ECOLOGICAL MONITORING OF WATER SYSTEMS
Some aspects of environmental pollution, especially that of surface waters by heavy metals, are discussed on interdisciplinary level. A dual biological role of metals as life components and as toxicants is marked. Analytical work is necessary for regular evaluation of environmental state.
Г.К.Будников
Казанский Государственный Университет
Среди загрязнителей биосферы, представляющих наибольший интерес для различных служб контроля ее качества, металлы (в первую очередь тяжелые, то есть имеющие атомный вес больше 40) относятся к числу важнейших. В значительной мере это связано с биологической активностью многих из них. На организм человека и животных физиологическое действие металлов различно и зависит от природы металла, типа соединения, в котором он существует в природной среде, а также его концентрации. Многие тяжелые металлы проявляют выраженные комплексообразующие свойства. Так, в водных средах ионы этих металлов гидратированы и способны образовывать различные гидроксокомплексы, состав которых зависит от кислотности раствора. Если в растворе присутствуют какие-либо анионы или молекулы органических соединений, то ионы этих металлов образуют разнообразные комплексы различного строения и устойчивости. В ряду тяжелых металлов одни крайне необходимы для жизнеобеспечения человека и других живых организмов и относятся к так называемым биогенным элементам. Другие вызывают противоположный эффект и, попадая в живой организм, приводят к его отравлению или гибели. Эти металлы относят к классу ксенобиотиков, то есть чуждых живому. Специалистами по охране окружающей среды среди металлов-токсикантов выделена приоритетная группа. В нее входят кадмий, медь, мышьяк, никель, ртуть, свинец, цинк и хром как наиболее опасные для здоровья человека и животных. Из них ртуть, свинец и кадмий наиболее токсичны. К возможным источникам загрязнения биосферы тяжелыми металлами относят предприятия черной и цветной металлургии (аэрозольные выбросы, загрязняющие атмосферу, промышленные стоки, загрязняющие поверхностные воды), машиностроения (гальванические ванны меднения, никелирования, хромирования, кадмирования), заводы по переработке аккумуляторных батарей, автомобильный транспорт.
Кроме антропогенных источников загрязнения среды обитания тяжелыми металлами существуют и другие, естественные, например вулканические извержения: кадмий обнаружили сравнительно недавно в продуктах извержения вулкана Этна на острове Сицилия в Средиземном море. Увеличение концентрации металлов-токсикантов в поверхностных водах некоторых озер может происходить в результате кислотных дождей, приводящих к растворению минералов и пород, омываемых этими озерами. Все эти источники загрязнения вызывают в биосфере или ее составляющих (воздухе, воде, почвах, живых организмах) увеличение содержания металлов-загрязнителей по сравнению с естественным, так называемым фоновым уровнем. Хотя, как было упомянуто выше, попадание металла-токсиканта может происходить и путем аэрозольного переноса, в основном они проникают в живой организм через воду. Попав в организм, металлы-токсиканты чаще всего не подвергаются каким-либо существенным превращениям, как это происходит с органическими токсикантами, и, включившись в биохимический цикл, они крайне медленно покидают его.
Для контроля качества поверхностных вод созданы различные гидробиологические службы наблюдений. Они следят за состоянием загрязнения водных экосистем под влиянием антропогенного воздействия. Поскольку такая экосистема включает в себя как саму среду (воду), так и другие компоненты (донные отложения и живые организмы – гидробионты), сведения о распределении тяжелых металлов между отдельными компонентами экосистемы имеют весьма важное значение. Надежные данные в этом случае могут быть получены при использовании современных методов аналитической химии, позволяющих определить содержание тяжелых металлов на уровне фоновых концентраций.
Нужно отметить, что успехи в развитии методов анализа позволили решить такие глобальные проблемы, как обнаружение основных источников
загрязнения биосферы, установление динамики загрязнения и трансформации загрязнителей, их перенос и миграцию. При этом тяжелые металлы были классифицированы как одни из важнейших объектов анализа. Поскольку их содержание в природных материалах может колебаться в широких пределах, то и методы их определения должны обеспечивать решение поставленной задачи. В результате усилий ученых-аналитиков многих стран были разработаны методы, позволяющие определять тяжелые металлы на уровне фемтограммов (10 − 15 г) или в присутствии в анализируемом объеме пробы одного (!) атома, например никеля в живой клетке. К сложной и многогранной проблеме, которую представляют собой химические загрязнения окружающей среды тяжелыми металлами и которая охватывает различные дисциплины и уже превратилась в самостоятельную междисциплинарную область знаний, профессиональный интерес проявляют не только химики-аналитики, биологи и экологи (их деятельность традиционно связана с этой проблемой), но и медики. В потоке научной и научно-популярной информации, а также в средствах массовой информации все чаще появляются материалы о влиянии тяжелых металлов на состояние здоровья человека. Так, в США обратили внимание на проявление агрессивности у детей в связи с повышенным содержанием в их организме свинца. В других регионах планеты рост числа правонарушений и самоубийств также связывают с повышением содержания этих токсикантов в окружающей среде. Представляет интерес обсуждение некоторых химических и эколого-химических аспектов проблемы распространения тяжелых металлов в окружающей среде, в частности в поверхностных водах.
В течение достаточно длительного времени существовало твердое убеждение, что важные биологические функции выполняют только натрий, калий, магний, железо и кальций, которые в целом дают почти 99% всех атомов металла в организме человека и (кроме железа) также относятся к группе макроэлементов. Гидратированные атомы четырех из этих металлов, а именно: натрия, калия, магния и кальция, участвуют в процессах осмоса и передачи нервных сигналов, а также обусловливают прочность костной ткани скелета. Железо входит в состав молекулы гемоглобина – важнейшего белка, участвующего в связывании кислорода атмосферы и переносе его клеткам органов и тканей, то есть в процессе дыхания. Интерес к функциям переходных элементов, которые (в том числе железо) относятся к тяжелым металлам и содержатся в организме в следовых количествах, проявился сравнительно недавно. Сформировался новый раздел науки – бионеорганическая химия, изучающая структуру, свойства и реакции соединений биогенных элементов in vivo. Из-за низкого содержания в живом организме их стали называть микроэлементами.
Важность микроэлементов в осуществлении жизненных функций человека в отношении многих элементов уже доказана (марганец, цинк, молибден, фтор, иод и селен), в отношении других (хром, никель, ванадий, олово, мышьяк, кремний) вероятна. Главный критерий, по которому отличают макроэлементы от микроэлементов – потребность организма в элементе, определяемая в мг/кг массы в сутки. Все перечисленные микроэлементы в организме функционируют либо в форме гидратированных ионов, либо, подобно железу, в виде координационных соединений.
Известно также, что в теле человека содержится большинство непереходных металлов, причем именно в следовых количествах, например: ртуть из зубных пломб, свинец, сурьма и мышьяк из типографской краски газет и книг, медь, олово, марганец и алюминий из кухонной посуды. Однако в первую очередь будут рассмотрены не эти металлы, а жизненно важные, то есть биогенные. В организме человека и животных в процессе осуществления жизнедеятельности протекает множество ферментативных химических реакций, сопровождающихся разрывом весьма прочных связей, то есть таких, которые в лабораторных установках могут быть осуществлены только в жестких условиях, например при высоких давлении или температуре.
Хотя молекула металлсодержащего фермента способна выдержать многие тысячи каталитических циклов, все-таки метаболические процессы, происходящие в живом организме, могут привести к разрушению части ферментов и выводу из организма соответствующего количества металлов. Поэтому появляется необходимость возмещать эти потери, поскольку недостаток микроэлементов приведет к нарушению жизнедеятельности организма, что может выразиться в различных заболеваниях. Вводимое количество микроэлементов можно регулировать диетой, а в случае необходимости, например для профилактики заболевания, приемом специальных препаратов, выпускаемых, как правило, в форме добавок к пищевым продуктам. В качестве примера можно привести хорошо известные комплексы витаминов и микроэлементов, применяемые в питании спортсменов и профессиональных групп, работающих в экстремальных условиях внешней среды.
Среднее содержание металлсодержащих соединений в организме человека сохраняется приблизительно постоянным. Например, концентрация цинксодержащих компонентов (этот элемент входит в структуру активного центра важнейшего гормона инсулина, регулирующего уровень сахара в крови) составляет 138 мкМ. В сыворотке их содержание больше и равно 226 мкМ, в плазме ∼ 47 мкМ.
Медьсодержащие соединения в крови присутствуют при концентрации ∼ 15 мкМ, в сыворотке – 16– 18 мкМ, в плазме – 18 мкМ. Медь входит в состав некоторых ферментов, например фенолазы и гемоцианина, способных, подобно гемоглобину, переносить кислород. Кроме того, медь как химический элемент необходима при биосинтезе самого гемоглобина.
Следует отметить, что прочность химических связей белков и других биологически важных компонентов крови с ионами любого металла достаточна для того, чтобы значительную часть времени своего пребывания в организме металл находился в виде комплекса с белками, аминокислотами и другими биологически активными соединениями. Поэтому при попадании в организм избытка металлов последние могут вызвать нарушение его функций, отравление или гибель. Степень такого воздействия зависит не только от концентрации, превышающей некоторый уровень, но и от природы металла, прежде всего его комплексообразующей способности. Так, если комплексообразующая способность металла-токсиканта достаточно велика, то он может вытеснить биогенный металл-катализатор из активного центра в результате конкурентного взаимодействия или же связать с собой подавляющую часть биологически активных соединений, используемых для синтеза того или иного жизненно важного фермента.
Следует обратить внимание и на то, что биологической ценностью обладают лишь доступные биогенные элементы, содержащиеся в пищевых продуктах в виде солей органических кислот и других растворимых химических соединений, чаще всего комплексных. В литературе, посвященной оценке качества пищевых продуктов, приводятся сведения о содержании тех или иных микроэлементов во фруктах, овощах, мясе, молоке и т.д.
Понятия макрои микроэлементов не всегда четко различимы, если это разделение применять по отношению к разным группам организмов. Например, для растений набор жизненно необходимых микроэлементов явно отличен от такового для высших животных. Однако и для растений требуется определенный уровень содержания микроэлементов в почве, что обычно достигается внесением так называемых микроудобрений, по сути дела представляющих собой набор биогенных микроэлементов: цинка, ванадия, молибдена, меди, кобальта, железа, марганца.
Важнейшим показателем качества среды обитания является степень чистоты поверхностных вод. Металл-токсикант, попав в водоем или реку, распределяется между компонентами этой водной экосистемы. Однако не всякое количество металла вызывает расстройство данной системы. При оценке способности экосистемы сопротивляться внешнему токсическому воздействию принято говорить о буферной емкости экосистемы. Так, под буферной емкостью пресноводных экосистем по отношению к тяжелым металлам понимают такое количество металла-токсиканта, поступление которого существенно не нарушает естественного характера функционирования всей изучаемой экосистемы. При этом сам металл-токсикант распределяется на следующие составляющие: 1) металл в растворенной форме; 2) сорбированный и аккумулированный фитопланктоном, то есть растительными микроорганизмами; 3) удерживаемый донными отложениями в результате седиментации взвешенных органических и минеральных частиц из водной среды; 4) адсорбированный на поверхности донных отложений непосредственно из водной среды в растворимой форме; 5) находящийся в адсорбированной форме на частицах взвеси. На рис. 1 схематически представлено распределение металлов-токсикантов (M) в водной экосистеме.
На формы нахождения металлов в водах оказывают влияние гидробионты (например, моллюски). Так, при изучении поведения меди в поверхностных водах наблюдают сезонные колебания ее концентрации: в зимний период они максимальны, а летом вследствие активного роста биомассы снижаются. При осаждении взвешенных органических частиц, которые обладают способностью адсорбировать ионы меди, последние переходят в донные отложения, что и приводит к наблюдаемому эффекту. Следует также отметить, что интенсивность этого процесса зависит от скорости седиментации взвесей, то есть косвенно от таких факторов, как размеры и заряд адсорбирующих ионы меди частиц.
Кроме аккумулирования металлов за счет адсорбции и последующей седиментации в поверхностных водах происходят другие процессы, отражающие устойчивость экосистем к токсическому воздействию такого рода загрязнителей. Наиболее важный из них состоит в связывании ионов металлов в водной среде растворенными органическими веществами. При этом общая концентрация токсиканта в воде не меняется. Тем не менее принято считать, что наибольшей токсичностью обладают гидратированные ионы металлов, а связанные в комплексы опасны в меньшей мере либо даже почти безвредны. Специальные исследования показали, что между общей концентрацией металла-токсиканта в природных поверхностных водах и их токсичностью нет однозначной зависимости.
В природных поверхностных водах содержится множество органических веществ, 80% которых составляют высокоокисленные полимеры типа гумусовых веществ, проникающих в воду из почв. Остальная часть органических веществ, растворимых в воде, представляет собой продукты жизнедеятельности организмов (полипептиды, полисахариды, жирные и аминокислоты) или же подобные по химическим свойствам примеси антропогенного происхождения. Все они, конечно, претерпевают различные превращения в водной среде. Но все они в то же время являются своего рода комплексообразующими реагентами, связывающими ионы металлов в комплексы и уменьшающими тем самым токсичность вод.
Различные поверхностные воды по-разному связывают ионы металлов-токсикантов, проявляя при этом различную буферную емкость. Воды южных озер, рек, водоемов, имеющих большой набор природных компонентов (гумусовые вещества, гуминовые кислоты и фульвокислоты) и их высокую концентрацию, способны к более эффективной природной детоксикации по сравнению с водами водоемов Севера и умеренной полосы. Таким образом, при прочих равных условиях токсичность вод, в которых оказались загрязнители, зависит и от климатических условий природной зоны. Следует отметить, что буферная емкость поверхностных вод по отношению к металлам-токсикантам определяется
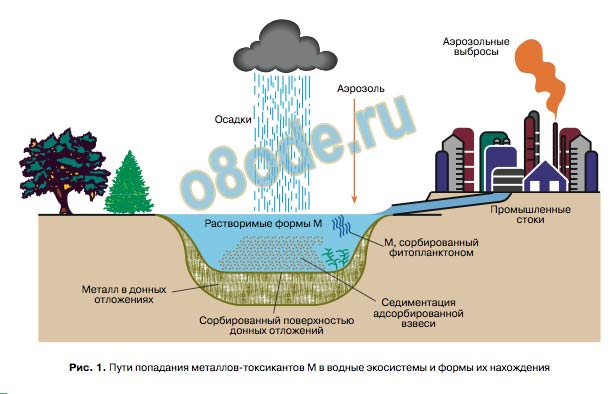
Пути попадания металлов-токсикантов M в водные экосистемы и формы их нахождения не только наличием растворенного органического вещества и взвесей, но и аккумулирующей способностью гидробионтов, а также кинетикой поглощения ионов металлов всеми компонентами экосистемы, включая комплексообразование с растворенными органическими веществами. Все это говорит о сложности процессов, протекающих в поверхностных водах при попадании в них металлов-загрязнителей. На рис. 2 показана схема распределения металлов-токсикантов в природных поверхностных водах, отражающая в общих чертах химические и физикохимические процессы их связывания в различные формы. Интересно отметить, что гуминовые кислоты, эти специфические природные высокомолекулярные соединения, образующиеся при превращении растительных остатков в почвах под влиянием микроорганизмов, способны, видимо, в наибольшей степени связывать ионы тяжелых металлов в прочные комплексы. Так, константы устойчивости соответствующих гуматов (комплексов ионов тяжелых металлов с гуминовыми кислотами) имеют значения в пределах 10 5 –10 12 в зависимости от природы металла. Устойчивость гуматов зависит от кислотности водной среды.
Химико-аналитический аспект проблемы определения форм существования металлов в природных водах хотя и был сформулирован около 20 лет назад, однако лишь с появлением новейших методов анализа эта задача стала доступной для решения. Раньше определяли лишь валовое содержание тяжелого металла в воде и устанавливали распределение между взвешенной и растворенной формами. О качестве вод, загрязненных металлами, судили на основе сопоставления данных по их валовому содержанию с величинами ПДК. Сейчас такая оценка считается неполной и необоснованной, так как биологическое действие металла определяется его состоянием в водах, а это, как правило, комплексы с различными компонентами (рис. 2). Как уже отмечалось выше, в отдельных случаях, например при комплексообразовании с органическими соединениями естественного происхождения, эти комплексы не только малотоксичны, но нередко оказывают стимулирующее действие на развитие гидробионтов, поскольку при этом они становятся биологически доступны организмам.
При разработке существующих ПДК процессы комплексообразования не учитывали и оценку влияния неорганических солей тяжелых металлов на живые организмы проводили в чистых водных растворах при отсутствии растворенных органических веществ естественного происхождения. Строго говоря, провести такую оценку сложно, а порой и невозможно.
Итак, токсичность вод при загрязнении их тяжелыми металлами в основном определяется концентрацией либо акваионов металлов, либо простейших комплексов с неорганическими ионами. Присутствие других комплексообразующих веществ, и прежде всего органических, понижает токсичность. Отмеченное выше явление накопления токсикантов в донных отложениях может явиться причиной вторичной токсичности вод. Действительно, даже если источник загрязнения устранен и, как говорят, “вода пошла нормальная”, в дальнейшем становится возможна обратная миграция металла из донных отложений в воды. Прогнозирование состояния водных систем должно опираться поэтому на данные анализа всех их составляющих, проводимого через определенные промежутки времени.
Любопытным оказался случай обнаружения залежей киновари (сульфида ртути) в одном из районов Карпат. Для геологов эта находка стала неожиданностью. Оказалось, что в средние века в селениях, расположенных в горах выше по течению реки, систематически применяли препарат ртути для лечения некоторых заболеваний. Шли годы, река собирала этот металл, переносила его вниз по течению и аккумулировала в одной из природных ловушек в виде донных отложений. Дальнейшая его трансформация дала в итоге киноварь. Этот пример показывает, что в природе происходят непрерывное перемещение, миграция и накопление токсикантов антропогенного происхождения, при этом они, кроме того, подвергаются химическому превращению в более устойчивые формы.
Из перечня приоритетных металлов-загрязнителей рассмотрим ртуть, свинец и кадмий как представляющие наибольшую опасность для здоровья человека и животных.
Ртуть.
В окружающей среде соединения ртути с различной степенью окисления металла, то есть Hg(0), Hg(I), Hg(II), могут реагировать между собой. Наибольшую опасность представляют собой органические, прежде всего алкильные, соединения.
Формы существования металлов в поверхностных водах

Понижение токсичности (до 97%) – поверхностные воды океанов. Около половины всей ртути в природную среду попадает по техногенным причинам.
Кислотность среды и ее окислительный потенциал влияют на нахождение в водной среде той или иной формы ртути. Так, в хорошо аэрированных водоемах преобладают соединения Hg(II). Ионы ртути легко связываются в прочные комплексы с различными органическими веществами, находящимися в водах и выступающими в качестве лигандов. Особенно прочные комплексы образуются с серосодержащими соединениями. Ртуть легко адсорбируется на взвешенных частицах вод. При этом так называемый фактор концентрирования достигает порой 10 5, то есть на этих частицах сконцентрировано ртути в сто тысяч раз больше, чем находится в равновесии в водной среде. Отсюда следует, что судьба металла будет определяться сорбцией взвешенными частицами с последующей седиментацией, то есть по существу будет происходить удаление ртути из водной системы, как это уже было описано на примере образования залежей киновари в регионе Карпат. Следует отметить, что десорбция ртути из донных отложений происходит медленно, поэтому повторное загрязнение поверхностных вод после того, как источник загрязнения установлен и ликвидирован, также имеет заторможенную кинетику. В водных средах ртуть образует металлорганические соединения типа R–Hg–X и R–Hg–R, где R – метилили этил-радикал. Из антропогенных источников в водные системы ртуть попадает в виде преимущественно металлической ртути, ионов Hg(II) и ацетата фенилртути. Преобладающей формой ртути, обнаруживаемой в рыбе, является метилртуть, образующаяся биологическим путем с участием ферментов микроорганизмов. В не загрязненных поверхностных водах содержание ртути колеблется в пределах 0,2–0,1 мкг/л, в морских – в три раза меньше. Водные растения поглощают ртуть. Органические соединения R–Hg–R’ в пресноводном планктоне содержатся в большей концентрации, чем в морском. Из организма органические соединения ртути выводятся медленнее, чем неорганические. Существующий стандарт на предельное содержание этого токсиканта (0,5 мкг/кг) используют при контроле качества пищевых продуктов. При этом предполагают, что ртуть присутствует в виде метилированных соединений. При попадании в организм человека последних может проявиться болезнь Минимата.
Свинец.
Половина от общего количества этого токсиканта поступает в окружающую среду в результате сжигания этилированного бензина. В водных системах свинец в основном связан адсорбционно со взвешенными частицами или находится в виде растворимых комплексов с гуминовыми кислотами. При биометилировании, как и в случае со ртутью, свинец в итоге образует тетраметил свинец. В незагрязненных поверхностных водах суши содержание свинца обычно не превышает 3 мкг/л. В реках промышленных регионов отмечается более высокое содержание свинца. Снег способен в значительной степени аккумулировать этот токсикант: в окрестностях крупных городов его содержание может достигать почти 1 млн мкг/л, а на некотором удалении от них ∼ 1–100 мкг/л.
Водные растения хорошо аккумулируют свинец, но по-разному. Иногда фитопланктон удерживает его с коэффициентом концентрирования до 10 5, как и ртуть. В рыбе свинец накапливается незначительно, поэтому для человека в этом звене трофической цепи он относительно мало опасен. Метилированные соединения в рыбе в обычных условиях содержания водоемов обнаруживаются относительно редко. В регионах с промышленными выбросами накопление тетраметилсвинца в тканях рыб протекает эффективно и быстро – острое и хроническое воздействие свинца наступает при уровне загрязненности 0,1–0,5 мкг/л. В организме человека свинец может накапливаться в скелете, замещая кальций.
Кадмий.
По химическим свойствам этот металл подобен цинку. Он может замещать последний в активных центрах металлсодержащих ферментов, приводя к резкому нарушению в функционировании ферментативных процессов. В рудных месторождениях кадмий, как правило, присутствует вместе с цинком. В водных системах кадмий связывается с растворенными органическими веществами, особенно если в их структуре присутствует сульфгидрильные группы SH. Кадмий образует также комплексы с аминокислотами, полисахаридами, гуминовыми кислотами. Считают, однако, что само по себе присутствие высоких концентраций этих лигандов, способных связывать кадмий, еще недостаточно для понижения концентрации свободных акваионов кадмия до уровня, безопасного для живых организмов. Адсорбция ионов кадмия донными осадками сильно зависит от кислотности среды. В нейтральных водных средах свободный ион кадмия практически нацело сорбируется частицами донных отложений.
Источников поступления кадмия в окружающую среду еще несколько лет назад было достаточно много. После того как была доказана его высокая токсичность, их число резко сократилось (по крайней мере в промышленно развитых странах). Сейчас основной источник загрязнения окружающей среды этим токсикантом – места захоронения никель-кадмиевых аккумуляторов. Как уже отмечалось, кадмий обнаружен в продуктах извержения вулкана Этна. В дождевой воде концентрация кадмия может превышать 50 мкг/л.
В пресноводных водоемах и реках содержание кадмия колеблется в пределах 20–400 нг/л. Наименьшее его содержание в океане зарегистрировано в акватории Тихого океана, к востоку от Японских островов ( ∼ 0,8–9,6 нг/л на глубине 8–5500 м). Этот металл накапливается водными растениями и в тканях внутренних органов рыб (но не в скелетной мускулатуре).
Кадмий обычно проявляет меньшую токсичность по отношению к растениям в сравнении с метилртутью и сопоставим по токсичности со свинцом. При содержании кадмия ∼ 0,2–1 мг/л замедляются фотосинтез и рост растений. Интересен следующий зафиксированный эффект: токсичность кадмия заметно снижается в присутствии некоторых количеств цинка, что еще раз подтверждает предположение о возможности конкуренции ионов этих металлов в организме за участие в ферментативном процессе.
Порог острой токсичности кадмия варьирует в пределах от 0,09 до 105 мкг/л для пресноводных рыб. Увеличение жесткости воды повышает степень защиты организма от отравления кадмием. Известны случаи сильного отравления людей кадмием, попавшим в организм по трофическим цепям (болезнь итай-итай). Из организма кадмий выводится в течение длительного периода (около 30 лет).
Биосферу можно рассматривать как обобщенный объект анализа. На практике специалист той или иной области науки имеет дело с какой-либо одной составной его частью. Однако каждый конкретный объект находится в постоянной динамике, во взаимной связи с другими объектами и поэтому меняет не только свой состав, но и свойства. Порой эти изменения невелики, чтобы их можно было заметить, нужен некоторый период времени, в течение которого эти изменения произойдут. Однако используемые методы наблюдения, то есть биомониторинг, должны быть и чувствительными, и точными. Сложность окружающей среды как объекта анализа, ее изменчивость заставляют периодически проводить ревизию данных, совершенствовать и методы определения, и отдельные этапы анализа. Недавно такую ревизию провели в отношение данных по распространенности ртути и меди в окружающей среде. Оказалось, что ранее этапы проб, отбора и пробоподготовки были недостаточно совершенны и включали в себя систематическую ошибку. Ее учет в итоге привел к тому, что данные по содержанию ртути в отдельных объектах окружающей среды были завышены порой на порядок. Хотя прогноз по содержанию ртути в атмосферных выбросах на период до 2025 года предполагает удвоение количеств этого токсиканта, уже сейчас установлено, что в действительности ее концентрация меньше почти на порядок. Подобный же критический анализ данных ожидается и по оценке содержания меди. Сведения о распространении металлов как загрязнителей получают прежде всего экологи-аналитики, которые получают первичную информацию, хотя в решении проблемы охраны окружающей среды участвуют специалисты из смежных областей наук. Одним из направлений современного реформирования высшей школы является подготовка высококвалифицированных специалистов-естество
испытателей с широкой эрудицией в смежных областях химии, биологии, физики, экологии, способных решать сложнейшие и жизненно важные проблемы, часть которых затронута в этой статье.
1. Миркин Б.М., Наумова Л.Г. Экология России. М.: 1995. 232 с.
2. Никаноров А.М., Жулидов А.В. Биомониторинг металлов в пресноводных экосистемах. СПб.: Гидрометеоиздат, 1991. 312 с.
3. Мур Дж., Рамамурти С. Тяжелые металлы в природных водах. М.: Мир, 1987. 286 с.
4. Уильямс Д. Металлы жизни. М.: Мир, 1975. 236 с.
5. Материалы конференций по анализу природных и сточных вод в СССР (России) за последние 5–10 лет.
6. Шустов С.Б., Шустова Л.В. Химические основы экологии. М.: Просвещение, 1995. 240 с.
7. Майстренко В.Н., Хамитов Р.З., Будников Г.К . Экологический мониторинг суперэкотоксикантов. М.: Химия, 1996. 320 с.
Герман Константинович Будников, доктор химических наук, профессор кафедры аналитической химии Казанского государственного университета, член-корреспондент Академии естественных наук РФ и Российской экологической академии, академик Международной академии наук высшей школы.
Область научных интересов: электроаналитическая химия, химически модифицированные электроды, биосенсоры для эколого-аналитического контроля. Автор более 550 публикаций, из которых 12 книг по проблемам электроаналитики и аналитической химии.
Тяжелая вода: что это такое и где она применяется, как получить такую жидкость в домашних условиях – физические свойства воды и химическая формула

Вы наверняка о ней слышали, но уделяли ли ей достаточно внимания? Чтобы ответить, рассмотрим, что собой представляет тяжелая вода: что это такое, где применяется, чем отличается от обычной, что будет, если регулярно употреблять ее в быту и так далее.
Сразу отметим: сегодня она используется все активнее, особенно в химической промышленности и в экспериментальной медицине. Ученые подбирают различные ее дозировки для проведения глобальных исследований, призванных улучшить приплод и увеличить вес домашних животных, а также побороть раковые опухоли. Успехи переменные, но они есть (плюс многие изыскания рассчитаны на длительную перспективу, и их результаты пока не оценить), поэтому работы в этих направлениях продолжаются, чему только способствует общее развитие технологий.
Что значит термин «тяжелая вода»

Она представляет собой оксид — либо водорода 2H (вместо легкого 1H в обычных условиях), либо дейтерия D, то есть изотопа, содержащего на один нейтрон больше, чем в стандартном случае. Такая замена оборачивается повышением удельной массы на 10%.
Немного справочной информации:
- в реакциях записывается как 2H2O (2H2O) или, соответственно, D2O;
- t кипения = 101,43 .С;
- t плавления = 3,813 .С;
- плотность = 3,98 .С (1,104 г/см3).
В природных источниках соотношение D к H сегодня измеряется как 1 к 6900; ее немного и это хорошо, так как в целом она действует на организмы угнетающе (подробнее рассмотрим этот вопрос ниже).
История открытия
Впервые ее молекулы в обычной среде обнаружил американский физиохимик Гарольд Юри: было это в 1932-м году, а в 1934-м ему присудили Нобелевскую премию за это открытие. В 1933-м уже другой ученый из США, Гилберт Льюис, путем электролиза получил чистую тяжеловодородную воду: он многократно пропускал ток через остаток H2O, постепенно насыщая его молекулами HDO и D2O – до тех пор, пока концентрация последних не достигла 99%.
Когда в 1938-м открыли деление ядер, сразу же стало ясно, насколько перспективны цепные реакции этого процесса. Но для их проведения понадобился эффективный замедлитель нейтронов. В роли последнего стали использовать D2O — наиболее удобное с технической точки зрения соединение дейтерия, помимо прочего, еще и отводящее тепло из рабочей зоны.
В СССР химическая формула тяжелой воды и те преимущества, которые она дает, получала все больше внимания по мере развития атомной энергетики. В частности, предшественница ИТЭФ, Лаборатория №3 АН СССР, начала производить 2H2O в промышленных масштабах – для обеспечения нужд реакторов (современная классификация которых – тип PHWR) и различных установок.
Со временем об оксиде узнавали повсеместно, попутно развеивая мифы. Например, в 1968 году еще появлялись околонаучные публикации, утверждавшие, что его концентрация увеличивается в результате многократного кипячения. Сегодня он продолжает активно использоваться, стоимость его получения значительно удешевилась. Средняя цена продажи составляет 1 евро за грамм против 19 долларов в 1935-м, и не забудьте об инфляции — тогда это была более внушительная сумма, за $19 можно было купить гораздо больше, чем сейчас.
Физические свойства тяжелой воды

Одни из них такие же, что и у обычной, другие — кардинально отличаются, но общая их совокупность определяет условия применения и употребления D2O (2H2O), а значит заслуживает внимания. Рассмотрим каждый из важных параметров отдельно.
Запах
Отсутствует — по этому показателю отличить ее от «легкой» не представляется возможным. Какие-то оттенки неприятного аромата — допустим, серной тухлости, хлористой резкости или гниловатой сладости — говорят только о наличии вполне конкретных проблем в самом источнике, вызванных не превышением концентрации оксида дейтерия. Причина может быть в разложении водорослей, сливе промышленных отходов и других подобных факторах.

Во всех вариациях своих изотопов тяжелая вода в природе так же прозрачна, как обычная. Поэтому вполне можно спутать ее визуально и случайно выпить, если она, например, будет налита в стакан или графин (на вкус она может показаться чуть сладковатой).
Обратите внимание: помутнение, затемнение или осветление, появление буроватого или зеленоватого оттенка свидетельствует лишь о присутствии примесей в отдельно взятом заборе, но никак не о повышенном содержании D2O, его так просто не определить. Другой вопрос, чем обусловлено наличие посторонних веществ (чаще всего это соли жесткости, ржавчина, нитраты, марганец и другие опасные элементы).
Температура кипения
Это первое свойство, по которому тяжелая вода будет отличаться от легкой, пусть и незначительно. Потому что при сравнении мы увидим следующие градусы:
1,5 м3/ч Для технической воды

1,5 м3/ч Для технической воды

MBFT-75 Мембрана на 75GPD
- H2O – 100 0C (всем известный показатель);
- D2O – 101,7 0C.
Нагрев является своеобразным маркером «веса», но в условиях бытовой практики он малоприменим, а наука и промышленность располагают более совершенными и точными способами определения разницы.
Отдельно отметим, что выделяют еще и такой показатель, как температура плавления (кристаллизации), и он составляет:
- 0 0С – для H2O;
- 3,82 0С – для D2O.
Проще говоря, это отметка, при которой начинает образовываться лед, и это даже более явный признак «тяжести», который может пригодиться в быту.
Вязкость
Имеется в виду динамическая, являющаяся частью системы единиц СГС и измеряемая в сантипуазах (сокращенно сП). При этом 1 П = 0,1 Н х с/м2.
У обычной она 1,0016 сП, в то время как у оксида дейтерия уже 1,2467 сП (все сравнения производятся при температуре в 20 градусов Цельсия). Разница в 24% существенным образом влияет на эксплуатационные характеристики и является одним из тех факторов, которые способствуют замедлению химических реакций (в частности, поглощения нейтронов).
Молекулярная масса

Составляет 20,034 г/моль, по сравнению с 18,01528 г/моль «легкой» H2O, и это еще одна из причин, почему воду называют тяжелой, ведь она буквально весит больше. Данная особенность также провоцирует снижение скоростей обменных процессов, что особенно важно для управления термоядерным синтезом.
Растворимость
Она достаточно быстро и равномерно смешивается с этанолом, но в случае с диэтиловым эфиром такого результата уже не наблюдается. В свою очередь, растворить в ней соли уже значительно труднее, чем в обычной H2O, ориентированной на бытовые нужды, и это даже удобно. Во-первых, это явный показатель повышенного «веса», во-вторых, определенная защита от загрязнений, что просто необходимо технологической среде, актуальной на самых ответственных объектах.
Плотность
Измеряется при температуре в 25 градусов Цельсия и составляет 1,1042 г/см3, по сравнению с 0,997 г/см3 «легкой». И это еще одна характеристика, снижающая общий уровень поглощения нейтронов и способствующая замедлению реакций.
Есть и другие параметры, в числе которых:
- стандартная энтропия;
- энтальпия (кипения, плавления, образования);
- энергия Гиббса;
Но они не столь важны конкретно в нашем случае, то есть в вопросах подготовки забора из артезианской скважины к бытовому употреблению, и поэтому на каждом из них мы не будем подробно останавливаться.
Где и для чего используется тяжелая вода
Поначалу сам Гарольд Юри отнесся к своей находке как к интересному научному факту. И, несмотря на Нобелевскую премию, на первых порах он и его коллеги не видели сфер, в которых может пригодиться оксид дейтерия. Ситуация изменилась уже через 5 лет: в связи с открытием деления ядер, стал очевиден тот промышленный потенциал, которым обладает D2O. В результате сегодня можно выделить сразу несколько сфер ее актуальности.
В ядерных технологиях


SF-mix Clack до 0,8 м3/ч

SF-mix Runxin до 0,8 м3/ч

SF-mix ручной до 0,8 м3/ч
Современные физики рассматривают ее в качестве топлива будущего, а некоторые даже заявляют, что она станет источником бесконечной энергии. И это уже не просто мечты, ведь с ее помощью уже можно управлять термоядерным синтезом (пусть пока и с ограничениями), и ожидается, что с ее помощью удастся провести сверхвыгодные реакции вроде:
D + T → 4He + η + 17,6 МэВ
Перспективность считается настолько высокой, что ее коммерческий оборот в ряде стран находится под жестким государственным надзором. Это как раз та ситуация, в которой запреты и ограничения оправданы, так как позволяют защититься от создания неконтролируемых, а значит и опасных установок, работающих на природном уране.
Важную роль играет и возможность обнаружения нейтрино именно с помощью D2O. Около 1000 ее тонн содержится в SNO, то есть в крупнейшем детекторе мира, комплексе оборудования, расположенном в Канаде.
В ядерных реакторах

В этом случае применение тяжелой воды актуально в одном из двух качеств:
- Замедлитель нейтронов, помогающий обеспечить должную скорость синтеза; благодаря этому отпадает необходимость в установке графитовых стержней, опасных на этапе вывода из эксплуатации своей наведенной радиоактивностью и угрозой взрыва пыли.
- Практичный носитель, эффективно отводящий тепло из зоны цепной реакции, сравнительно доступный по стоимости и, что важно, инертный. Он также хорош тем, что не забирает часть энергии, выделяющейся в процессе синтеза.
В роли изотопного индикатора в химии
А также в области гидрологии, биологии и других сферах, для которых только может быть актуальным использование оксида дейтерия.
Например, в небольших концентрациях он препятствует размножению и распространению бактерий, грибков и других вредных микроорганизмов, и эту особенность взяла на вооружение экспериментальная медицина.
Рассуждая о том, что такое тяжелая вода и где применяется, нужно отметить, что ученые в течение десятилетий проводили глобальные и комплексные исследования. И установили несколько любопытных закономерностей, возникающих при определенном проценте содержания D2O в употребляемой в пищу жидкости:
- уменьшение на 20-25% — крупный рогатый скот начинает активнее набирать вес, а куры — лучше нестись;
- увеличение до 50% — организм приобретает антимутагенные свойства, что способствует росту биологической массы и ускоренному половому созреванию;
- накопление свыше 70% — могут отступить раковые болезни, но это также сопровождается резким преждевременным старением, ухудшением обменных процессов, отказом органов, а впоследствии и смертью.
Естественно, все медицинские опыты (тем более что они показывают столь неоднозначные результаты) пока проводились на животных, но не на людях.
Отличия между легкой и тяжелой водой

На основании свойств D2O понятно, чем опасно такое соединение для человека: постепенно накапливаясь в организме, оно нарушает метаболизм, убыстряет появление необратимых возрастных изменений, провоцирует возникновение болезней и злокачественных новообразований.
С другой стороны, H2O, с нормальной или восстановленной структурой:
- питает клетки энергией за счет проведения отрицательных окислительных реакций;
- дает антиоксидантную защиту, помогая предотвратить многие случаи отравления;
- оставляет pH-уровень слабощелочным, стабилизируя состояние крови и лимфы;
- способствует улучшению обмена веществ, параллельно снижая поверхностное натяжение.
Напомним также, что обе этих жидкости прозрачны и обладают нейтральным вкусом и запахом, поэтому их вполне реально перепутать.
Какая польза от тяжелой воды


АМЕТИСТ — 02 М до 2 куб.м./сут.

Аэрационная установка AS-1054 VO-90

Диспенсер магистральный настольный AquaPro 919H/RO (горячая и холодная вода)
Естественно, она не была столь востребованной, если бы несла только вред. То же замедление нейтронов обеспечивает нормальное протекание ядерных реакций, а значит оксид дейтерия все-таки стоит на страже нашей безопасности, пусть и опосредованно.
Ну а добавление в качестве индикатора дает удобную возможность контролировать изменения состава смесей и своевременно вносить необходимые корректировки.
Также нужно учитывать те потенциальные преимущества, которые в будущем принесут медицинские исследования. Специалисты из самых разных областей все уверенней говорят о скором прорыве.
Что случится, если выпить тяжелую воду
В небольших количествах она никак не скажется на состоянии организма. За раз можно употребить даже литр D2O — ничего страшного не случится: за две недели она полностью выйдет из тела, а сам дейтерий не радиоактивен. Так что не опасайтесь, что случайно возьмете не тем наполненный стакан. Максимум, что можно почувствовать — это небольшой дискомфорт из-за изменения давления.
Другое дело — регулярное употребление. В этом случае оксид будет:
- постепенно нарушать целостность ДНК;
- замедлять обменные процессы;
Это обернется уже описанными проблемами со здоровьем (отказом органов, появлением опухолей). Если же концентрация D2O достигнет 20% от общего объема жидкости, то это спровоцирует летальный исход.
Тяжелая вода в жизни человека
За тот комплексный угнетающий эффект, который она может подарить, ее зачастую называют мертвой. Да, несмотря на то что размножение вредных микроорганизмов она тоже замедляет или даже полностью останавливает.
Нюанс в том, что оксид дейтерия в малых количествах, но содержится во всех естественных источниках. Небольшой его процент есть в озерах, прудах, реках, морях, глубоких скважинах и даже в осадках. Причем в дожде его обычно в несколько раз больше, чем в снеге, что объясняется частой электризацией облаков.
В любом случае выходит, что мы, пусть и неосознанно, но потребляем D2O, и получение тяжелой воды в домашних условиях происходит независимо от нашего желания, просто не в таких количествах, которые могли бы нам навредить.
Поэтому важно не повышать риск накопления оксида дейтерия в организме и не употреблять для питья и приготовления пищи морскую H2O, опресненную методом обратного осмоса. Данный способ как раз даст жидкость со сравнительно более высоким уровнем концентрации изотопа.
Мы поможем подобрать оборудование, которое будет контролировать количество примесей в каждом заборе и отфильтровывать вредные частицы – обращайтесь в компанию «Вода Отечества».
Но механическая очистка в этом конкретном случае может не сработать, так как фильтры смогут удалить лишь нерастворимые частицы, но окажутся бессильными на уровне молекул и атомов. Хотя один способ, применимый в быту, все-таки есть, предлагаем его рассмотреть.
Как получить тяжелую воду в домашних условиях
Выделить D2O, чтобы потом слить его, можно с помощью процесса таяния. Для этого необходимо:
- взять нужный объем жидкости и провести его очистку от хлора, марганца, железа, солей или других посторонних частиц;
- нагреть до «белого ключа», то есть до выделения пара соответствующего света, а после остудить;
- набрать ее в металлическую или стеклянную емкость и отправить в холодильник;
- дождаться первичного замерзания, снять появившийся тонкий слой льда сверху, перелить в другой сосуд и снова отправить в камеру с низкой температурой.
Образовавшаяся корочка – это и есть оксид дейтерия (который кристаллизируется еще при 3,82 0С. Останется лишь избавиться от него, так как в быту его пока не используют.
Заключение
Теперь вы знаете, что означает понятие «тяжелая вода», где она может применяться и какую опасность несет, и еще больше понимаете, насколько важно получать во всех смыслах чистую жидкость.
Источник https://sila-vody.ru/vidy-vody/chem-deyterievaya-voda-otlichaetsya-ot-obychnoy.html
Источник https://www.o8ode.ru/article/planetwa/heavy_water.htm
Источник https://ovteh.ru/blog/vidy-vody/tyazhelaya-voda-chto-eto-takoe-i-gde-ona-primenyaetsya-kak-poluchit-takuu-zhidkost