Содержание
Как выглядит марганцовка. Марганцовка: применение и меры предосторожности. Марганец — химический элемент. Степень окисления
О полезных свойствах марганцовки известно очень давно. Еще наши бабушки запасались заветными пузырьками с порошком темно-фиолетового цвета, которые у многих сохранились в аптечках и по сей день. Перманганат калия, а простыми словами марганцовка, широко применяется в быту и медицине.
Привычный для нас антисептик не только активно борется с различными микробами и возбудителями инфекций, но и оказывает благотворное действие при отравлениях и многих других симптомах.
Сфера применения марганцовки
 Благодаря своим удивительным лечебным свойствам, перманганат калия так активно практикуется в области традиционной и нетрадиционной медицины, косметологии и даже гинекологии. Марганцовокислый калий также применяется в садоводстве, как эффективное средство борьбы с мелкими вредителями и заболеваниями растений.
Благодаря своим удивительным лечебным свойствам, перманганат калия так активно практикуется в области традиционной и нетрадиционной медицины, косметологии и даже гинекологии. Марганцовокислый калий также применяется в садоводстве, как эффективное средство борьбы с мелкими вредителями и заболеваниями растений.
Путешествующие берут марганцовку с собой для обеззараживания полученных ран или питьевой воды, в этом случае нужно добавить к ней несколько кристалликов. Концентрированный раствор является сильным окислителем и воздействует на пластмассу, дерево и металл. Используя марганцовку в домашних условиях, следует знать, что это вещество способно изрядно подпортить металлическую раковину или ванну. Пятна, оставленные после раствора, практически не отмываются.
Образуется марганцовка после электролиза едкого калия и марганцевого анода. В процессе своего распада анод растворяется и образует фиолетовый раствор, который содержит ионы перманганата. На катоде выделяется водород, а затем уже в виде осадка проявляется тот самый марганец.
Этот препарат входит в число лидеров по части обладания противомикробными свойствами. В виде порошка он продается в аптеках, но в последние годы некоторые фармацевтические компании продают его только по рецепту. Срок годности марганцовки неограничен, однако нужно подчеркнуть, что только самый свежий раствор способен уничтожать любые возбудители, обладая активной стерилизацией любой поверхности. Существует она в виде кристаллов, которые, в случае необходимости растворяют в воде для получения раствора. Отличается он по цвету: бледно-розовый оттенок говорит о слабой концентрации, ярко-малиновый – наоборот. Готовят лечебный раствор в основном из расчета 10 кристалликов на 1 литр воды, в дальнейшем корректируя его крепость по цвету. Всегда очень важно полностью размешивать порошок марганцовки, поскольку не растворившиеся частички при соприкосновении с кожей могут вызвать ожоги.
Использование марганцовокислого калия в медицине обусловлено его обеззараживающими свойствами. Приготовленный раствор применяют для обработки порезов, промывки ран и мозолей. При воспалениях горла и глотки назначают полоскания не концентрированным раствором марганца. Этим средством промывают больное место 4 раза в сутки. Очень часто используют раствор перманганата калия в качестве препарата для орошения ротовой полости, а именно, при болезнях десен.
Лечение марганцовкой
- Марганцовка при . Популярна марганцовка при пищевых отравлениях и поносе. Ощутив первые признаки, больной должен выпить слабый раствор, который способен стимулировать процесс очищения кишечника.
- Для приема внутрь при устранении интоксикации организма на 200 мл воды понадобится буквально 2 кристаллика порошка. Хорошо размешав препарат, нужно выпить эту воду за один раз. Этот хороший антисептик поможет нейтрализовать инфекцию в желудке.
- При гипергидрозе или повышенной потливости. Если сильно потеют ноги, то хорошим способом устранения этой проблемы станут ванночки со слабым раствором марганцовки. Эта процедура, как правило, не должна занимать более 15 минут, а температура воды – не более 40 градусов. После пропаривания ступней их нужно насухо вытереть и промазать формалиновым раствором (1%).
- Как уже было отмечено, перманганат калия – это замечательный антисептик, который необычайно полезен при обработке разных повреждений. Нужно знать о том, как правильно использовать марганцовку по назначению. Непосредственно рану марганцевой водой не промывают, а обрабатывают лишь края. Дезинфицирующее средство для серьезной раны готовится из расчета: небольшое количество порошка на кончике ножа на 1 л. воды. При незначительном повреждении кожи достаточно развести слабый раствор, промыть этот участок, после чего смазать йодом.
- При пирсинге. Сейчас очень многие девушки и парни стараются выглядеть как можно более креативно и неординарно, в том числе, прокалывают себе уши, пупки, ноздри и брови. Но к сведению молодых людей, подобные эксперименты чреваты неприятными последствиями, если за ними не будет должного ухода. Чтобы избежать заражения тканей после прокалывания иглой, необходима тщательная обработка ран антисептическими средствами. Слабый раствор марганца в этом случае будет очень кстати. Место пирсинга нужно дезинфицировать как минимум 2 раза в день и только чистыми руками.
- Если вас беспокоят надоедливые или мозоли, то марганцовка и здесь пригодится. Концентрированный раствор перманганата калия отлично прижигает все ненужные наросты на коже, для этого достаточно смазывать их марганцовкой ежедневно.
- При грибковых заболеваниях женских и мужских наружных половых органов доктора очень часто прописывают своим пациентам безболезненное и безвредное средство – марганцевый раствор для промываний. Для лечения молочницы назначают ежедневные спринцевания бледно-розовым раствором, важно лишь следить за тем, чтобы все кристаллики полностью растворялись в воде. В противном случае это может вызвать повреждение слизистых оболочек и раздражение.
Марганцовка при уходе за ребенком
 Вероятно, вы могли слышать о том, что некоторые мамочки используют марганцовку для ухода за новорожденным малышом. Во время купания ребенка в воду добавляют немного этого порошка для того, чтобы вода обрела обеззараживающие свойства. Врачи, в свою очередь, к этому методу относятся скептически, считая, что малейшее превышение допустимой дозировки марганца способно нанести ожоги малышу. То же самое касается и не до конца растворившихся кристалликов.
Вероятно, вы могли слышать о том, что некоторые мамочки используют марганцовку для ухода за новорожденным малышом. Во время купания ребенка в воду добавляют немного этого порошка для того, чтобы вода обрела обеззараживающие свойства. Врачи, в свою очередь, к этому методу относятся скептически, считая, что малейшее превышение допустимой дозировки марганца способно нанести ожоги малышу. То же самое касается и не до конца растворившихся кристалликов.
Если вопреки всем опасениям, вы решили использовать марганцовку, считая ее самым эффективным и неалергенным антисептиком, то должны знать правила приготовления раствора для купания ребенка. Готовить его лучше всего последовательно. Сначала разведите марганцовку в стакане воды, затем получившийся насыщенный раствор процедите через марлю, сложенную в несколько слоев. Только после этого раствор можно вливать в ванную до тех пор, пока вода не получит бледно-розовый оттенок, но насыпать кристаллики марганца сразу в ванну категорически запрещено. Чтобы обработать пупок новорожденного, используйте более насыщенную смесь.
Марганцовка в домашней аптечке:
- Марганцовокислый калий быстро снимет боль от мозолей. Для этого в раствор марганцовки нужно добавить немного поваренной соли, растворить все и пропарить ноги в этой жидкости около 20 минут. После этого ступни нужно вытереть и через некоторое время боль прекратится.
- Неприятный , проявляющийся высыпаниями и появлением пузырей на коже, также лечится марганцовкой. Необходимо ежедневно смазывать пораженные участки 10%-м раствором марганца в течение недели.
- Народные целители рекомендуют использовать марганцовку при запущенном геморрое. Целебный раствор готовится так: на 3 л воды нужно добавить несколько кристалликов марганца, 1 ч.л. соды, 1 ст.л. растительного масла и 200 г кипяченого молока. Раствор подогреть, перемешать и влить в ванну.
- Ежедневно на ночь рекомендуется принимать такую ванну в течение 20 минут, и через 7 дней вы избавитесь от неприятного геморроя.
- Лечат марганцовкой даже признаки дизентерии. Состав лечебного средства включает в себя несколько кристалликов марганца, разведенных в 500 г воды. Концентрацию раствора можно увеличивать в зависимости от возраста больного. Например, грудным детям дают бедно-розовый раствор, а взрослым – малиновый. Принимать лекарство нужно внутрь, параллельно с проведением очищающих клизм.
За счет своего окисляющего воздействия марганцовокислый калий просто не совместим с одновременным применением активированного угля и других легко окисляемых веществ. Хранить бутылочку с порошком нужно вдали от детей и легко окисляющихся препаратов, которые при соприкосновении с кристаллами марганца могут привести к возгоранию.
Популярность этого старинного средства с годами не угасает и практика применения марганцовки растет. МедБлок рекомендует запомнить самое главное, что только при соблюдении всех правил обращения с марганцовкой она будет абсолютно безопасной для человека и окажет свое настоящее благотворное воздействие.
Первое, к чему прибегают при заболеваниях горла, расстройствах кишечника, отравлениях — это марганцовка
(перманганат калия, марганцовокислый калий).
В годы Великой Отечественной войны, как патроны у солдата, она находилась в сумках санитаров, фельдшеров и широко использовалась при лечении ран в госпиталях.
В основе действия перманганата калия — его способность окислять органические вещества, выделяя при этом кислород. Этим обусловлено антимикробное и антисептическое действие марганцовки.
Водный раствор перманганата калия обладает противовоспалительными свойствами.
В различных концентрациях этот раствор применяют для промывания ран, полоскания рта и горла, для смазывания язвенных и ожоговых поверхностей, спринцеваний. Диапазон применения перманганата калия достаточно широк. Даже при наличии многих новых синтетических средств он и сейчас незаменим «в» гинекологической, урологической, дерматологической практике.
В таблице противоядий при отравлениях перманганат калия является одним из важнейших средств оказания первой помощи.
Однако при всех достоинствах марганцовокислого калия обращаться с ним надо осторожно . В больших концентрациях он прижигает и вызывает отек слизистых оболочек рта, глотки, пищевода, желудка, кишок, рвоту и понос. Поэтому применять раствор следует с осторожностью.
Еще наши бабушки знали полезные в быту свойства марганцовки: ей промывали раны, лечили отравление, обеззараживали, купали младенцев и даже использовали в борьбе с вредителями в огороде. Такое широкое применение марганцовки объясняет главное ее свойство — это противогрибковый, противомикробный препара т. За счет активных процессов окисления марганцовка убивает вредные микробы — возбудителей различных инфекций как на поверхности кожи, так и внутри организма.
Целебные свойства марганцовки (перманганата калия)
Марганцовка — эффективное дезинфицирующее средство. Раствор перманганата калия (марганцовки) обладает антисептическими свойствами, способен нейтрализовать токсическое действие на организм таких отравляющих соединений, как аконитин, морфин, другие алкалоиды, фосфор (при приеме их внутрь).
Перманганат калия — один из видов перманганатов (от лат. manganum — «марганец») — марганцовокислых солей. Это химическое вещество широко используют как для домашних нужд, так и для медицины. Перманганат калия — кристаллы темно-фиолетового цвета, хорошо растворимые в воде (в зависимости от концентрации цвет может быть от светло-розового до красно-фиолетового), метиловом спирте, уксусной кислоте и ацетоне. В быту марганцовокислый калий, растворенный в воде, называют марганцовкой.
Лечение марганцовкой в медицине
Нейтрализация синильной кислоты (ядовитого вещества) марганцовкой происходит лишь в щелочной среде. Калия перманганат — сильный окислитель. Водный раствор марганцовки оказывает сильное дезинфицирующее и подсушивающее действие, его широко используют в дерматологической и хирургической практике.
При появлении первых признаков гастрита и гастроэнтероколита в первую очередь надо промыть желудок, используя для этого слабый (слегка розовый) раствор марганцовки. Для промывания желудка у взрослых и даже детей зондом пользоваться необязательно, достаточно просто дать выпить больному приготовленный раствор в количестве 0,5 — 2 л, после чего рефлекторно вызвать рвоту.
При отравлениях, когда нужно как можно быстрее вызвать рвоту, пострадавшему дают выпить розовый раствор марганцовки, который является также лекарственным, дезинфицирующим желудочно-кишечный тракт средством.
Раствор зачастую готовят «на глаз», но основные рекомендации — это 10 кристаллов на 1 литр воды, дальнейшую крепость раствора можно корректировать по его цвету. Очень важно, чтобы перед применением все кристаллы растворились в воде, иначе в процессе соприкосновения с кожей или внутренними органами не растворенные кристаллы могут вызвать ожог.
Наиболее популярен раствор марганцовки при отравлении. При первых признаках, в том числе при диарее больному предлагают раствор марганцовки, который стимулирует очищение кишечника.
Марганцовка для применения внутрь при отравлении готовится в соотношении 2 кристалла на чашку воды, такой раствор выпивается. Благодаря своим антисептическим свойствам подобное лекарство останавливает очаг инфекции в желудке.
Марганцовка — применение в урологии, гинекологии
За счет своих антисептических, противомикробных способностей раствор марганцовки применяют при лечении грибковых, бактериальных заболевания в урологии и гинекологии. Марганцовка имеет применение при молочнице, когда слабый раствор назначают для ежедневных спринцеваний. При урологических проблемах у мужчин, связанных с наружными воспалительными процессами, назначают промывания раствором марганцовки.
При применении в урологии и гинекологии важно соблюдать правила приготовления раствора, следить за тем, чтобы кристаллы марганцовки полностью растворились. В противном случае при попадании на слизистую кристаллы могут вызвать еще большее раздражение.
Марганцовка — противопоказания
Не рекомендуется применять раствор марганцовки при индивидуальной непереносимости. Это сразу можно понять по наличию побочных эффектов — отек, изменение цвета слизистых, резкая боль при применении внутрь, судороги и др. При наличии подобных или других неприятных симптомов прием марганцовки следует прекратить.
Марганцовка за счет своих окислительных свойств абсолютно несовместима с применением угля, сахара и другими веществами, которые легко окисляются. Важно хранить кристаллы перманганата калия вдали от легко окисляющихся веществ, иначе их соприкосновение может привести к взрыву и даже пожару.
Лечение марганцовкой (перманганатом калия) в народной медицине
Лечение марганцовкой в народной медицине для устранения болей, вызванных мозолями. Для этого в раствор марганцовки розового цвета добавляют поваренную соль и, налив раствор в тазик, опускают в него ноги на 20 мин, после процедуры ноги не нужно вытирать. Через некоторое время боль в области мозолей пройдет. Ни в коем случае для лечения марганцовкой нельзя пользоваться сильно концентрированным раствором (фиолетового цвета), так как это может повлечь за собой вред здоровью, получение ожогов кожи и слизистых, отравление.
Хороший лечебный эффект при опрелостях, в том числе и у грудных детей, оказывают гигиенические ванны с марганцовкой: вода должна быть розового цвета и теплой.
При повышенной потливости нижних конечностей, неприятных запахах, гнойных мозолях поможет теплая ножная ванна с солью и марганцовкой, после процедур ноги следует хорошо вытереть и посыпать тальком.
Лечение перманганатом калия активно используется для промывания открытых ран, в том числе и гноящихся. При дерматитах, характеризующихся появлением пузырей, кожу следует обмыть розовым раствором перманганата калия.
Если при постановке банок их слишком долго держать, на коже могут образоваться багровые пятна и даже пузырьки, наполненные сукровичной жидкостью. В подобных случаях пораженные места полезно смазать 5 — 10%-ным раствором марганцовокислого калия.
Лечение перманганатом калия на практике: лучшие рецепты
В запущенных случаях геморроя можно приготовить целебный раствор.
Требуется : 1 ч. л. пищевой соды, 1 ст. л. любого растительного масла, марганцовка, 3 л воды.
Приготовление . В горячую воду всыпать столько марганцовки, чтобы получить розовый цвет, добавить соду, масло, раствор влить в ванну.
Применение . Принимать ванну в течение 20 мин на ночь. Процедуру проводить ежедневно в течение недели.
В народной медицине есть рецепт для лечения марганцовкой от дизентерии.
В состав этого средства входят несколько кристаллов марганцовки на 0,5 л воды. Советуют увеличивать концентрацию раствора в зависимости от возраста (грудничкам — бледно-розовый, а взрослым людям — малиновый раствор).
Надо иметь в виду, что перманганат калия при взаимодействии с различными органическими веществами становится взрывоопасным. Поэтому его кристаллы надо хранить в чистой стеклянной посуде с притертыми пробками, а раствор — в склянках из темного стекла, так как под действием солнечных лучей и дневного света он легко разлагается.
При пользовании раствором часто остаются трудно смываемые пятна на коже и белье. Чтобы устранить их, кожу можно обмыть раствором сернистого аммония в концентрации 1:5, а затем горячей водой. С белья пятна выводят раствором щавелевой кислоты (1:9), 2-процентным раствором соляной кислоты, уксусом или лимонным соком..
Оказывается, перманганат калия не так-то просто приобрести. В одной аптеке мне сказали, что марганцовку приравняли (соответствующими приказами) к взрывчатым веществам и для её продажи нужна соответствующая лицензия, в другой аптеке сказали, что перманганат калия отнесли к наркотическим веществам и, опять-таки, нужна соответствующая лицензия.
В то же время все указывали на одну аптеку в городе, где изготавливают лекарства на заказ («может там можно приобрести»). Третьи говорят, что обычному человеку продадут марганцовку только в растворе, а в виде кристаллов можно купить только по «красному» рецепту и что все эти запреты на продажу, якобы, из-за наркоманов, которые массово скупали марганцовку для очистки своего варева.
Если аптеки не продают марганцовку, то её можно найти в ветеринарных и в хозяйственных магазинах. Там, где семена и удобрения.
Истинная, эмпирическая, или брутто-формула: Mn
Молекулярная масса: 54,938
Марганец — элемент побочной подгруппы седьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 25. Обозначается символом Mn (лат. Manganum, ма́нганум, в составе формул по-русски читается как марганец, например, KMnO 4 — калий марганец о четыре). Простое вещество марганец (CAS-номер: 7439-96-5) — металл серебристо-белого цвета. Наряду с железом и его сплавами относится к чёрным металлам. Известны пять аллотропных модификаций марганца — четыре с кубической и одна с тетрагональной кристаллической решёткой.
История открытия
Один из основных минералов марганца — пиролюзит — был известен в древности как чёрная магнезия и использовался при варке стекла для его осветления. Его считали разновидностью магнитного железняка, а тот факт, что он не притягивается магнитом, Плиний Старший объяснил женским полом чёрной магнезии, к которому магнит «равнодушен». В 1774 г. шведский химик К. Шееле показал, что в руде содержится неизвестный металл. Он послал образцы руды своему другу химику Ю. Гану, который, нагревая в печке пиролюзит с углем, получил металлический марганец. В начале XIX века для него было принято название «манганум» (от немецкого Manganerz — марганцевая руда).
Распространённость в природе
Марганец — 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся в земной коре (0,03 % от общего числа атомов земной коры). Весовое количество марганца увеличивается от кислых (600 г/т) к основным породам (2,2 кг/т). Сопутствует железу во многих его рудах, однако встречаются и самостоятельные месторождения марганца. В чиатурском месторождении (район Кутаиси) сосредоточено до 40 % марганцевых руд. Марганец, рассеянный в горных породах, вымывается водой и уносится в Мировой океан. При этом его содержание в морской воде незначительно (10−7-10−6%), а в глубоких местах океана его концентрация возрастает до 0,3 % вследствие окисления растворённым в воде кислородом с образованием нерастворимого в воде оксида марганца, который в гидратированной форме (MnO2·xH2O) и опускается в нижние слои океана, формируя так называемые железо-марганцевые конкреции на дне, в которых количество марганца может достигать 45 % (также в них имеются примеси меди, никеля, кобальта). Такие конкреции могут стать в будущем источником марганца для промышленности.
В России является остродефицитным сырьём, известны месторождения: «Усинское» в Кемеровской области, «Полуночное» в Свердловской, «Порожинское» в Красноярском крае, «Южно-Хинганское» в Еврейской автономной области, «Рогачёво-Тайнинская» площадь и «Северо-Тайнинское» поле на Новой Земле.
Минералы марганца
- пиролюзит MnO 2 ·xH 2 O, самый распространённый минерал (содержит 63,2 % марганца);
- манганит (бурая марганцевая руда) MnO(OH) (62,5 % марганца);
- браунит 3Mn 2 O 3 ·MnSiO3 (69,5 % марганца);
- гаусманит (MnIIMn2III)O 4 ;
- родохрозит (марганцевый шпат, малиновый шпат) MnCO 3 (47,8 % марганца);
- псиломелан mMnO MnO 2 nH 2 O (45-60 % марганца);
- пурпурит Mn 3 +, (36,65 % марганца).
- Алюминотермическим методом, восстанавливая оксид Mn 2 O 3 , образующийся при прокаливании пиролюзита.
- Восстановлением железосодержащих оксидных руд марганца коксом. Этим способом в металлургии обычно получают ферромарганец (
Физические свойства
Некоторые свойства приведены в таблице. Другие свойства марганца:
- Работа выхода электрона: 4,1 эВ
- Коэффициент линейного температурного расширения: 0,000022 см/см/°C (при 0 °C)
- Электропроводность: 0,00695·106 Ом -1 ·см -1
- Теплопроводность: 0,0782 Вт/см·K
- Энтальпия атомизации: 280,3 кДж/моль при 25 °C
- Энтальпия плавления: 14,64 кДж/моль
- Энтальпия испарения: 219,7 кДж/моль
- Твёрдость
- по шкале Бринелля: Мн/м²
- по шкале Мооса: 4
Химические свойства
Характерные степени окисления марганца: 0, +2, +3, +4, +6, +7 (степени окисления +1, +5 малохарактерны). При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде.
Марганец при нагревании разлагает воду , вытесняя водород. При этом слой образующегося гидроксида марганца замедляет реакцию. Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды.
Углерод реагирует с расплавленным марганцем, образуя карбиды Mn 3 C и другие. Образует также силициды, бориды, фосфиды. В щелочном растворе марганец устойчив.
Марганец образует следующие оксиды: MnO, Mn 2 O 3 , MnO 2 , MnO 3 (не выделен в свободном состоянии) и марганцевый ангидрид Mn 2 O 7 .
Mn 2 O 7 в обычных условиях жидкое маслянистое вещество тёмно-зелёного цвета, очень неустойчивое; в смеси с концентрированной серной кислотой воспламеняет органические вещества. При 90 °C Mn2O7 разлагается со взрывом. Наиболее устойчивы оксиды Mn 2 O 3 и MnO 2 , а также комбинированный оксид Mn 3 O 4 (2MnO·MnO 2 , или соль Mn 2 MnO 4). При сплавлении оксида марганца (IV) (пиролюзит) со щелочами в присутствии кислорода образуются манганаты. Раствор манганата имеет тёмно-зелёный цвет. Раствор окрашивается в малиновый цвет из-за появления аниона MnO 4 − , и из него выпадает коричневый осадок оксида-гидроксида марганца (IV).
Марганцевая кислота очень сильная, но неустойчивая, её невозможно сконцентрировать более, чем до 20 %. Сама кислота и её соли (перманганаты) — сильные окислители. Например, перманганат калия в зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца (II), в нейтральной — до соединений марганца (IV), в сильно щелочной — до соединений марганца (VI).
При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Под действием сильных окислителей ион Mn 2+ переходит в ион MnO 4 — . Эта реакция используется для качественного определения Mn 2+ (см. в разделе «Определение методами химического анализа»).
При подщелачивании растворов солей Mn (II) из них выпадает осадок гидроксида марганца (II), быстро буреющий на воздухе в результате окисления. Подробное описание реакции см. в разделе «Определение методами химического анализа».
Соли MnCl 3 , Mn 2 (SO 4) 3 неустойчивы. Гидроксиды Mn(OH) 2 и Mn(OH) 3 имеют основный характер, MnO(OH) 2 — амфотерный. Хлорид марганца (IV) MnCl 4 очень неустойчив, разлагается при нагревании, чем пользуются для получения хлора. Нулевая степень окисления у марганца проявляется в соединениях с σ-донорными и π-акцепторными лигандами. Так, для марганца и известен карбонил состава Mn 2 (CO) 10 .
Известны и другие соединения марганца с σ-донорными и π-акцепторными лигандами (PF 3 , NO, N 2 , P(C 5 H 5) 3).Применение в промышленности
Применение в металлургии
Марганец в виде ферромарганца применяется для «раскисления» стали при её плавке, то есть для удаления из неё кислорода. Кроме того, он связывает серу, что также улучшает свойства сталей. Введение до 12-13 % Mn в сталь (так называемая Сталь Гадфильда), иногда в сочетании с другими легирующими металлами, сильно упрочняет сталь, делает её твёрдой и сопротивляющейся износу и ударам (эта сталь резко упрочняется и становится твёрже при ударах). Такая сталь используется для изготовления шаровых мельниц, землеройных и камнедробильных машин, броневых элементов и т. д. В «зеркальный чугун» вводится до 20 % Mn. В 1920-х-40х годах применение Марганца позволяло выплавлять броневую сталь. В начале 1950-х годов в журнале Сталь возникла дискуссия по вопросу о возможности снижения содержания марганца в чугуне, и тем самым отказа от поддержки определенного содержания марганца в процессе мартеновской плавки, в которой вместе с В.И. Явойским и В. И. Баптизманским принял участие Е. И. Зарвин, который на основе производственных экспериментов показал нецелесообразность существовавшей технологии. Позже он показал возможность ведения мартеновского процесса на маломарганцовистом чугуне. С пуском ЗСМК началась разработка передела низкомарганцовистых чугунов в конвертерах. Сплав 83 % Cu, 13 % Mn и 4 % Ni (манганин) обладает высоким электросопротивлением, мало изменяющимся с изменением температуры. Поэтому его применяют для изготовления реостатов и пр. Марганец вводят в бронзы и латуни.
Применение в химии
Значительное количество диоксида марганца потребляется при производстве марганцево-цинковых гальванических элементов, MnO 2 используется в таких элементах в качестве окислителя-деполяризатора. Соединения марганца также широко используются как в тонком органическом синтезе (MnO 2 и KMnO 4 в качестве окислителей), так и промышленном органическом синтезе (компоненты катализаторов окисления углеводородов, например, в производстве терефталевой кислоты окислением p-ксилола, окисление парафинов в высшие жирные кислоты). Арсенид марганца обладает гигантским магнитокалорическим эффектом, усиливающимся под давлением. Теллурид марганца перспективный термоэлектрический материал (термо-э. д. с 500 мкВ/К).
Биологическая роль и содержание в живых организмах
Марганец содержится в организмах всех растений и животных, хотя его содержание обычно очень мало, порядка тысячных долей процента, он оказывает значительное влияние на жизнедеятельность, то есть является микроэлементом. Марганец оказывает влияние на рост, образование крови и функции половых желёз. Особо богаты марганцем листья свёклы — до 0,03 %, а также большие его количества содержатся в организмах рыжих муравьёв — до 0,05 %. Некоторые бактерии содержат до нескольких процентов марганца. Избыточное накопление марганца в организме сказывается, в первую очередь, на функционировании центральной нервной системы. Это проявляется в утомляемости, сонливости, ухудшении функций памяти. Марганец является политропным ядом, поражающим также лёгкие, сердечно-сосудистую и гепатобиллиарную системы, вызывает аллергический и мутагенный эффект
Токсичность
Токсическая доза для человека составляет 40 мг марганца в день. Летальная доза для человека не определена. При пероральном поступлении марганец относится к наименее ядовитым микроэлементам. Главными признаками отравления марганцем у животных являются угнетение роста, понижение аппетита, нарушение метаболизма железа и изменение функции мозга. Сообщений о случаях отравления марганцем у людей, вызванных приёмом пищи с высоким содержанием марганца, нет. В основном отравление людей наблюдается в случаях хронической ингаляции больших количеств марганца на производстве. Оно проявляется в виде тяжёлых нарушений психики, включая гиперраздражительность, гипермоторику и галлюцинации — «марганцевое безумие». В дальнейшем развиваются изменения в экстрапирамидной системе, подобные болезни Паркинсона. Чтобы развилась клиническая картина хронического отравления марганцем, обычно требуется несколько лет. Она характеризуется достаточно медленным нарастанием патологических изменений в организме, вызываемых повышенным содержанием марганца в окружающей среде (в частности, распространение эндемического зоба, не связанного с дефицитом йода).
Месторождение
Усинское месторождение марганца
Марганец содержится во всех видах стали и чугуна. Способность марганца давать сплавы с большинством известных металлов используется для получения не только различных сортов марганцевой стали, но и большого числа нежелезных сплавов (манганинов). Из них особенно замечательными являются сплавы марганца с медью (марганцевая бронза). Она, подобно стали, может закаляться и в то же время намагничиваться, хотя ни марганец, ни медь не обнаруживают заметных магнитных свойств.
Марганец в виде ферромарганца применяется для «раскисления» стали при её плавке, то есть для удаления из неё кислорода. Кроме того, он связывает серу, что также улучшает свойства сталей. Введение до 12-13 % Mn в сталь (так называемая Сталь Гадфильда), иногда в сочетании с другими легирующими металлами, сильно упрочняет сталь, делает её твердой и сопротивляющейся износу и ударам (эта сталь резко упрочняется и становится тверже при ударах). Такая сталь используется для изготовления шаровых мельниц, землеройных и камнедробильных машин, броневых элементов и т. д. В «зеркальный чугун» вводится до 20 % Mn.
Сплав 83 % Cu, 13 % Mn и 4 % Ni (манганин) обладает высоким электросопротивлением, мало изменяющимся с изменением температуры. Поэтому его применяют для изготовления реостатов и пр.
По принятым в нашей стране стандартам все элементы, легирующие сталь, имеют «собственную» букву. Так, в марку стали, содержащей кремний, обязательно входит буква С, хром обозначается буквой X, никель – буквой Н, ванадий – буксой Ф, вольфрам – буквой В, алюминий – буквой Ю, молибден – буквой М. Марганцу присвоена буква Г. Лишь углерод буквы не имеет, и у большинства сталей цифры в начале марки означают его содержание, выраженное в сотых долях процента. Если за буквой нет никаких цифр, то, значит, элемент, обозначенный этой буквой, содержится в стали в количестве около 1%. Расшифруем для примера состав конструкционной стали 30ХГС: индексы показывают, что в ней 0,30% углерода, 1% хрома, 1% марганца и 1% кремния.
Марганец обычно вводят в сталь вместо с другими элементами – хромом, кремнием, вольфрамом. Однако есть сталь, в состав которой, кроме железа, марганца и углерода, ничего не входит. Это так называемая сталь Гадфилда. Она содержит 1. 1,5% углерода и 11. 15% марганца. Сталь этой марки обладает огромной износостойкостью и твердостью. Ее применяют для изготовления дробилок, которые перемалывают самые твердые породы, деталей экскаваторов и бульдозеров. Твердость этой стали такова, что она не поддается механической обработке, детали из нее можно только отливать.
Применение марганца для очистки металла от серы
Сера – элемент, безусловно, полезный. Но не для металлургов. Попадая в чугун и сталь, она становится чуть ли не самой вредной примесью. Сера активно реагирует с железом, и сульфид FeS снижает температуру плавления металла. Из-за этого во время прокатки на раскаленном металле появляются разрывы и трещины.
В металлургическом производстве удаление серы возложено на доменщиков. «Связать», превратить в легкоплавкое соединение и удалить серу из металла легче всего в восстановительной атмосфере. Именно такая атмосфера создается в доменной печи. Но сера и вносится в металл при доменной плавке вместе с коксом, который обычно содержит 0,7. 2% серы. Чугун, выпускаемый в пашей стране, должен содержать не более 0,05% серы, а на передовых заводах этот предел снижен до 0,035% и даже меньше.
Марганец вводят в доменную шахту именно для того, чтобы удалить серу из чугуна. Сродство к сере у марганца больше, чем у железа. Элемент №25 образует с ней прочный легкоплавкий сульфид MnS. Сера, связанная марганцем, переходит в шлак. Этот способ очистки чугуна от серы прост и надежен.
Способность марганца связывать серу, а также ее аналог – кислород широко используется и в производстве стали. Еще в прошлом веке металлурги научились плавить «зеркальный» чугун из марганцовистых железных руд. Этот чугун, содержащий 5. 20% марганца и 3,5. 5,5% углерода, обладает замечательным свойством: если его добавить к жидкой стали, то из металла удаляются кислород и сера. Изобретатель первого конвертора Г. Бессемер использовал зеркальный чугун для раскисления и науглероживания стали.
В 1863 г. на заводе «Фонике» в Глазго было организовано производство ферромарганца – сплава марганца с железом. Содержание элемента №25 в таком сплаве 25. 35%. Ферромарганец оказался лучшим раскислителем, чем зеркальный чугун. Сталь, расклсленная ферромарганцем, становится гибкой, упругой.
Сейчас получают ферромарганец, содержащий 75. 80% Мn. Этот сплав, выплавляют в доменных и электросталеплавильных дуговых печах и широко применяют для производства марганцовистых сталей, речь о которых еще впереди.
Марганец вводят в бронзы и латуни.
Значительное количество диоксида марганца потребляется при производстве марганцево-цинковых гальванических элементов, MnO 2 используется в таких элементах в качестве окислителя-деполяризатора.
Соединения марганца также широко используются как в тонком органическом синтезе (MnO 2 и KMnO 4 в качестве окислителей), так и промышленном органическом синтезе (компоненты катализаторов окисления углеводородов, например, в производстве терефталевой кислоты окислением p-ксилола, окисление парафинов в высшие жирные кислоты).
Арсенид марганца обладает гигантским магнитокалорическим эффектом (усиливающимся под давлением). Теллурид марганца перспективный термоэлектрический материал(термо-э.д.с 500 мкВ/К).
Интересными свойствами обладает сплав, называемый нормальным манганином, содержащий 11- 13% марганца, 2,5-3,5% никеля и 86% меди. Отличаясь высоким электросопротивлением и малой термоэлектродвижущей силой в паре с медью, этот сплав особенно пригоден для изготовления катушек сопротивления. Способность манганина изменять сопротивление в зависимости от давления, под которым находится сплав, используется при изготовлении электрических манометров. В самом деле, чем измерить давление, например, в 15-25-30 тыс. атмосфер? Никакой обычный манометр не может выдержать такого давления. Жидкость или газ вырываются сквозь стенки трубки, как бы прочны они ни были, с силою взрыва. Иногда даже не удается найти микроотверстий, через которые прорывается содержимое манометрической трубки. В этих случаях манганин является незаменимым. Измеряя электрическое сопротивление манганина, находящегося под определяемым давлением, можно по заранее вычерченному графику зависимости сопротивления от давления вычислить последнее с любой степенью точности.
Из соединений марганца, нашедших применение в практической деятельности человека, следует указать на двуокись марганца и марганцевокислый калий (перманганат калия), наиболее известный, особенно у медиков, под названием «марганцовки». Двуокись марганца находит применение в гальванических элементах типа Лекланше, получении хлора, приготовлении каталитических смесей (гопкалит в противогазах). Марганцевокислый калий широко применяется в медицине как антисептическое средство для промывания ран, смазывания ожогов и т. д., для промывания желудка при отравлении фосфором, алкалоидами, солями синильной кислоты. Также широко применяется перманганат калия в химии при аналитических исследованиях, получении хлора, кислорода и др.
Впрочем, марганцем улучшают свойства не только железа. Так, сплавы марганца с медью обладают высокой прочностью и коррозионной стойкостью. Из этих сплавов делают лопатки турбин, а из марганцовистых бронз – винты самолетов и другие авиадетали.
Применение диоксида марганца и перманганата калия
Диоксид марганца используют в качестве катализатора в процессах окисления аммиака, органических реакциях и реакциях разложения неорганических солей. В керамической промышленности MnO 2 используют для окрашивания эмалей и глазурей в черный и тёмно-коричневый цвет. Высокодисперсный MnO 2 обладает хорошей адсорбирующей способностью и применяется для очистки воздуха от вредных примесей.
Перманганат калия применяют для отбеливания льна и шерсти, обесцвечивания технологических растворов, как окислитель органических веществ.
В медицине применяют некоторые соли марганца. Например, перманганат калия применяют как антисептическое средство в виде водного раствора, для промывания ран, полоскания горла, смазывания язв и ожогов. Раствор KMnO 4 применяют и внутрь при некоторых случаях отравления алкалоидами и цианидами. Марганец является одним из активнейших микроэлементов и встречается почти во всех растительных и живых организмах. Он улучшает процессы кроветворения в организмах.
Марганцевыми удобрениями служат марганцевые шлаки, содержащие до 15% марганца, а также сернокислый марганец. Но наибольшее распространение получил марганизированный суперфосфат, содержащий около 2-3% марганца.
Микроудобрения применяют также в виде некорневых подкормок, опрыскивая растения соответствующим раствором или замачивая в нем семена перед посевом.
Цены на металлический марганец в слитках чистотой 95 % в 2006 году составили в среднем 2,5$ за кг. В 2010 году килограмм металла стоил уже 4-4,5$
Еще наши бабушки знали полезные в быту свойства марганцовки: ей промывали раны, лечили отравление, обеззараживали, купали младенцев и даже использовали в борьбе с вредителями в огороде. Такое широкое применение марганцовки объясняет главное ее свойство – это противомикробный препарат. За счет активных процессов окисления марганцовка убивает вредные микробы – возбудителей различных инфекций как на поверхности кожи, так и внутри организма.
Марганцовка – инструкция по применению
Марганцовка, или перманганат калия, существует в виде кристаллов и в такой форме никогда не применяется. Марганцовка, ее любое применение – это необходимость растворять в воде кристаллы для получения раствора. Раствор марганцовки отличается по цвету: бледно-розовый означает слабый по концентрации раствор, ярко-малиновый – крепкий.
Раствор зачастую готовят «на глаз», но основные рекомендации — это 10 кристаллов на 1 литр воды, дальнейшую крепость раствора можно корректировать по его цвету. Очень важно, чтобы перед применением все кристаллы растворились в воде, иначе в процессе соприкосновения с кожей или внутренними органами нерастворенные кристаллы могут вызвать ожог.
Применение марганцовки в медицине основано на ее обеззараживающих свойствах. Раствором марганцовки промывают гнойные раны, мозоли, обрабатывают порезы. В таком случае используется только свежеприготовленная смесь.
При воспалительных заболеваниях горла и глотки назначают полоскания слабым бледно-розовым раствором марганцовки. Таким средством можно полоскать горло до 3-4 раз в сутки. Кроме того, при и других болезнях полости рта можно использовать раствор перманганата калия для орошений воспаленных мест.
Марганцовка – применение при отравлении
Наиболее популярен раствор марганцовки при отравлении. При первых признаках, в том числе при диарее больному предлагают раствор марганцовки, который стимулирует .
Марганцовка для применения внутрь при отравлении готовится в соотношении 2 кристалла на чашку воды, такой раствор выпивается. Благодаря своим антисептическим свойствам подобное лекарство останавливает очаг инфекции в желудке.
Марганцовка – применение в урологии, гинекологии
За счет своих антисептических, противомикробных способностей раствор марганцовки применяют при лечении грибковых, бактериальных заболевания в урологии и гинекологии. Марганцовка имеет применение при молочнице, когда слабый раствор назначают для ежедневных спринцеваний. При урологических проблемах у мужчин, связанных с наружными воспалительными процессами, назначают промывания раствором марганцовки.
При применении в урологии и гинекологии важно соблюдать правила приготовления раствора, следить за тем, чтобы кристаллы марганцовки полностью растворились. В противном случае при попадании на слизистую кристаллы могут вызвать еще большее раздражение.

Не рекомендуется применять раствор марганцовки при индивидуальной непереносимости. Это сразу можно понять по наличию побочных эффектов – отек, изменение цвета слизистых, резкая боль при применении внутрь, судороги и др. При наличии подобных или других неприятных симптомов прием марганцовки следует прекратить и получить консультацию врача.
Марганцовка за счет своих окислительных свойств абсолютно несовместима с применением угля, сахара и другими веществами, которые легко окисляются. Важно хранить кристаллы перманганата калия вдали от легкоокисляющихся веществ, иначе их соприкосновение может привести к взрыву и даже пожару.
Добыча марганцевой руды. Месторождения марганца в мире
В мире нет недостатка в марганцевой руде: обеспеченность подтвержденными запасами марганцевых руд составляет 130-150 лет. Однако размещение их месторождений отличается крайней неравномерностью. Главными продуцентами товарных марганцевых руд в мире являются лишь семь стран, обладающих наибольшими запасами: КНР, ЮАР, Украина, Бразилия, Габон, Индия, Австралия. Ими было произведено около 89 % всего объема товарных марганцевых руд. Эти же страны, а также страны с развитой экономикой — Япония, Франция, Норвегия и др. — являются ведущими потребителями товарных марганцевых руд.
По разведанным запасам (3133 млн. т) и добыче в конце 80-х — начале 90-х годов Советский Союз занимал первое место в мире. Более 75 % запасов и свыше 86 % добычи было сосредоточено на Украине, соответственно 7 и 11,2 % — в Грузии и 13 и 2,7% — в Казахстане.
Марганцевые руды в России относятся сейчас к группе особо дефицитных видов полезных ископаемых. На территории страны к настоящему времени не выявлено крупных богатых месторождений марганца. Государственным балансом запасов по состоянию па 01.01.2000 г. учитываются 14 небольших и средних по запасам месторождений, расположенных на Урале, в Западной Сибири, Прибайкалье, Республике Коми. Самым крупным из них является Усинское месторождение в Кемеровской области с запасами 98,5 млн. т бедных, труднообогатимых карбонатных руд. Кроме того, в России имеются месторождения марганцевых руд, которые из-за недостаточной их изученности пока не учитываются Государственным балансом. Среди них наибольший интерес представляет Порожинское месторождение в Красноярском крае.
Разведанные запасы марганцевых руд в 1991-1999 гг. оставались практически неизменными, составив на 01.01.2000 г. 148,1 млн. т. Среди них преобладают (около 90 %) труднообогатимые карбонатные руды. Среднее содержание марганца в разведанных запасах России составляет 20 %, тогда как в месторождениях основных зарубежных продуцентов товарных марганцевых руд оно достигает 41-50 %. На начало 2000 г. пролицензировано 15,9 % фонда разведанных запасов марганцевых руд. Добыча марганцевых руд в опытно-производственном режиме периодически проводилась на ряде небольших месторождений с селективной выемкой оксидных руд более высокого качества. Объемы добычи в разные годы варьировали от 186 (1996 г.) до 48 тыс. т (1999 г.). Потребность России в марганцевых рудах (3,8-4,8 млн. т сырой руды в год) по-прежнему удовлетворялась за счет импорта ферромарганца и товарной марганцевой руды в основном из Украины, а также из Казахстана и Грузии.
Наиболее крупное из известных месторождений — Усинское в Кемеровской области — отнесено к группе резервных, остальные месторождения не намечаются к освоению. Преобладающим типом руд является трудно-обогатимый карбонатный, на долю которого приходится около 91 % балансовых запасов, остальная часть — легкообогатимые окисные и окисленные руды.
Вторым наиболее крупным объектом является Порожинское месторождение в Красноярском крае, в пределах которого в 2000 г. была завершена детальная разведка и выполнен подсчет запасов оксидных марганцевых руд по кат. С 1 + С 2 . в сумме 78 млн. т и карбонатных руд — 75 млн. т. В 2001 г. намечается утвердить их в ГКЗ МПР России. Кроме того, на этом месторождении подсчитаны прогнозные ресурсы марганцевых руд по кат. Р 2 — 108,3 млн. т, в том числе оксидных руд — 45,4 млн. т.
В результате геологоразведочных работ, проведенных на этом крупном объекте, прирост запасов марганцевых руд в стране составит в начале XXI в.153 млн. т (100 %), что позволит России подняться с девятого па четвертое место в мире. В то же время доля России в разведанных запасах и потреблении марганцевого сырья среди стран СНГ достигнет соответственно 10 и 22 %, и она сможет занять третье место после Казахстана.
При определении максимальной потребности России в марганцевой руде следует учитывать также то обстоятельство, что потребность черной металлургии и прочих потребителей (машиностроение, химия, электротехника и др.) в марганцевых сплавах удовлетворяется за счет собственного производства менее чем на 30 %. По данным Гипростали, дефицит оценивается в 570 тыс. т в год (в пересчете на 100 % марганца), в том числе 517 тыс. т в марганцевых сплавах, в основном в виде силикомарганца, и 53 тыс. т в форме металлического марганца и среднеуглеродистого ферромарганца.
Проблема разведки и освоения малых месторождений марганца приобретает особо большую значимость для России. В настоящее время МПР России выдано более 20 лицензий на доизучение мелких месторождений с последующей их отработкой. В соответствии с ними все рудники должны выйти в 2000-2005 гг. на проектную производительность по марганцевым рудам — 900 тыс. т в год. На данном этапе осваиваются только три месторождения: Тыньинское (Северный Урал), Николаевское (Иркутская область) и Громовское (Читинская область), а на других мелких месторождениях Урала, а также на Дурновском (Кемеровская область) добываются марганцевые руды в небольшом количестве (до 10 тыс. т). Разработка этих месторождений производится неэффективно из-за низкой технической оснащенности мелких добывающих компаний и акционерных обществ.
В результате проведения геологоразведочных работ на ряде мелких месторождений потребность российской экономики в марганцевых рудах для существующих мощностей, составляющая 3,8 млн. т или 1,45 млн. т марганцевых концентратов, может быть удовлетворена только на 25 %. При этом реальная обеспеченность промышленными запасами марганцевых руд мелких месторождений составляет 5-7 лет.
При условии ввода в эксплуатацию Усинского и Положненского месторождений в 2005 г. добыча марганцевых руд может составить 3,1 млн. т и производство концентратов — 1,37 млн. т, а вместе с добычей на мелких месторождениях может достигнуть 4 млн. т сырой руды или 1,8 млн. т марганцевого концентрата.
Строительство рудников и горно-обогатительных комбинатов на крупных месторождениях позволит практически полностью удовлетворить потребности металлургических предприятий Российской Федерации в марганцевом сырье в течение многих десятилетий XXI века.
Таким образом, решение проблемы российского марганца позволит снизить зависимость от других стран к 2010г. как минимум на 80 %, а в дальнейшем полностью перейти на отечественное сырье.
В настоящее время Россия импортирует товарные марганцевые руды с содержанием 32-36 % Мn и ферросплавы на сумму более 200 млн. долл. ежегодно.
Альтернативным источником марганца континентальных месторождений могут стать океанические залежи железомарганцевых конкреций (ЖМК) и корок. До недавнего времени они изучались в основном с позиций их кобальто- и никеленосности. Плотность конкреций на океаническом дне может достигать первых десятков кг/м 2 , а содержание марганца — многих десятков % (при попутных никеле, кобальте и других концентраций более 1 %). Доказана практическая возможность добычи ЖМК и извлечения из них всех ценных компонентов. По данным ВИЭМСа, себестоимость добычи океанического и континентального марганца будет соизмерима. В условиях острого дефицита марганца в РФ следует усилить работы по закреплению за нашей страной площади Тихого океана, где сосредоточены многомиллионные запасы ЖМК.
MnO 2 ·H 2 O (44-52% Mn), браунит Mn 2 O 3 (69,5% Mn), гаусманит Mn 3 O 4 (72% Mn), родохрозит MnCO 3 (47,8% Mn), олигонит (Mn, Fe)CO 3 (23-32% Mn), манганокальцит (Ca, Mn)CO 3 (до 20-25% Mn), родонит (Mn, Ca)(Si 3 O 9) (32-41% Mn), бустамит (Ca, Mn)(Si 3 O 9) (12-20% Mn).
Классификация
Виды марганцевой руды
- Оксидные
- Карбонатные
- Оксидно-карбонатные
Основные промышленные руды — оксидные руды. Они представлены пиролюзитом, псиломеланом, криптомеланом, мангантом, гаусманитом, браунитом, голондитом, коронадитом, биксбитиитом, нсутитом, бернеситом, тодорокитом и т. д.
Виды месторождений руды по генезису
A) осадочные б) вулканогенно-осадочные
4) Месторождения коры выветривания
Происхождение (Генезис)
Метаморфические месторождения образуются за счёт изменения осадочных месторождений в недрах Земли под действием высоких температур и давлений (Усинское в Западной Сибири , месторождения Атасуйского района в Центральном Казахстане); обычно представлены плотными разновидностями руд, в составе которых принимают участие безводные окислы (браунит , гаусманит) и силикаты марганца (родонит и другие); среди них развиты железо-марганцевые руды с содержанием Mn около 10%, включающие промышленные концентрации минералов (магнетита , гематита и других).
Месторождения выветривания представлены мощными древними и современными корами выветривания с вторичной концентрацией в них марганца (месторождения Индии , Бразилии , Ганы , ЮАР); это рыхлые окисленные руды так называемых марганцевых шляп, сложенные пиролюзитом , псиломеланом и другими гидроокислами марганца и железа. что не является правильным.
Железомарганцевые конкреции На дне современных океанов находятся скопления железо-марганцевых конкреций, составляющие крупные ресурсы марганцевых руд. В минеральном составе конкреций доминируют гидроксиды марганца (тодорокит , бернессит , бузерит, асболан) и железа (вернадит , гематит), с ними связаны все представляющие экономический интерес металлы. Химический состав океанских конкреций крайне разнообразен: в тех или иных количествах присутствуют практически все элементы периодической системы Менделеева.
Начальные сведения о рудных образованиях на дне океана были получены в ходе проведения первой в истории мировой науки комплексной океанологической экспедиции на английском судне «Челленджер», продолжавшейся почти четыре года (1872-1876). 18 февраля 1873 г. при проведении драгировки в 160 милях к юго-западу от Канарских островов со дна были подняты черные округлые желваки — железомарганцевые конкреции, содержащие, как показали уже первые анализы, значительное количество марганца, никеля , меди и кобальта . Правда, несколько ранее, в 1868 г., во время экспедиции Н. Норденшельда на шведском судне «София», похожие конкреции были подняты со дна Карского моря , но эта находка осталась практически незамеченной.
Распространение
Данные по добыче на 2005 г.
Дислокация Основной вид месторождений Промзапасы, % Добыча, тыс. т Содержания Mn Габон Кора выветривания 4,7 2 460 30-50% ЮАР Вулканогенно-осадочный 19,9 2 200 38-50% Австралия Кора выветривания 3,5 1 340 30-50% Бразилия Кора выветривания 1 300 10-20% Китай 2,8 900 Украина Осадочный 42,2 720 8-34% Индия Метаморфизированный 640 10-20% Гана 559 Казахстан Вулканогенно-осадочный 7,3 183 Мексика 136 Мировые запасы марганцевых руд представлены на 90% оксидными (38%) и оксидно-карбонатными (52%) рудами.
В ЮАР около 95% запасов сосредоточено в уникальной марганцево-железорудной зоне Куруман , Наиболее крупные месторождения Маматван (среднее содержание марганца 38%), Весселс (47%) Миддельплаатц (36%)
В Китае , запасы марганца представлены мелкими, но многочисленными залежами оксидных руд. Среднее содержание в рудах 20-40%. В стране постоянно проводятся поиски и разведка новых месторождений марганца с целью ослабить зависимость страны от импорта высококачественных руд.
В Казахстане более 90% находится в Центрально-Казахстанском районе, в месторождениях Каражал и Ушкатын. Запасы около 85 млн.т (среднее содержание марганца 22%).
Месторождения Украины находятся в Южно-Украинском марганцеворудном бассейне. Это месторождения Никопольской группы и Большетокмакское, содержащие 33 и 67% подтвержденных запасов Украины. Украина обладает также и одним из самых мощных в Европе комплексов по переработке руды и производству марганцевых ферросплавов, включающим Никопольский, Запорожский и Стахановский заводы.
В Грузии основной сырьевой базой является Чиатурское месторождение. Оксидные руды составляют 28% (среднее содержание марганца 26%) подтвержденных запасов, карбонатные (среднее содержание марганца 18%-72%).
В России марганец является остродефицитным сырьем, имеющим стратегическое значение. Кроме указанных Усинского и Полуночного месторождений также известны Южно-Хинганские Малого Хингана в Еврейской области , Порожинское на Енисейском Кряже, Рогачево-Тайнинская площадь (260 млн т. карбонатных руд, с содержанием 8-15%) и недоизученное Северо-Тайнинское рудное поле (5 млн т. окисных руд, с содержанием 16-24%) на
Марганец — металл серого цвета со стальным отблеском, имеющий высокий показатель твёрдости. Добыча марганцевой руды имеет большое значение, ведь она применяется практически во всех отраслях промышленности.
История появления
Марганец невозможно найти в природе в чистом виде. Основной минерал, в котором он содержится, называется пиролюзит. В древности его использовали в качестве осветлителя стекла при варке, а также для окрашивания тканей.
В конце XVIII века шведские химики К. Шееле и Ю. Ган обнаружили, что в руде содержится металл, по внешнему виду напоминающий железо. Он получил название «манганум», которое позже преобразовалось в «марганец».
Где ещё содержится?
Марганец — элемент, который содержится в растениях и во всех живых организмах, в т. ч. в человеческом.
Его дефицит негативно сказывается на работе всех органов и систем человека.
Трудно переоценить важность марганца, ведь он:
- укрепляет нервную и сердечно-сосудистую системы;
- нормализует деятельность щитовидной железы;
- положительно влияет на репродуктивную функцию;
- регулирует уровень сахара в крови;
- ускоряет обмен веществ;
- поддерживает необходимый уровень холестерина в крови;
- укрепляет иммунную систему.
Свойства металла
Марганец является одним из самых распространённых элементов в природе. Чаще всего встречается в пиролюзите и железных рудах (его показатели твёрдости намного выше, чем у железа). В зависимости от количественного преобладания металла, залежи имеют название «железно-марганцевая руда» или «марганцево-железная».
Электронная формула марганца: 3d5 4s2.
Формула марганца в пиролюзите: MnO2xH2O.
Широкое применение марганца обусловлено его высокой химической активностью — он способен вступать в реакцию с большим количеством элементов, образуя сплавы. Он также хорошо взаимодействует с кислородом, углеродом, азотом и прочими неметаллами.
Находясь в вакууме, металл при нагревании способен испариться из любого сплава, он растворяется в кислотах, вступает в реакцию с водой.

Применение марганца в металлургической промышленности
Данный металл содержится практически во всех сплавах, значительно улучшая их физические свойства. Полученные сплавы отличаются долговечностью, прочностью и устойчивостью к коррозии. Марганец добавляется в них в сочетании с железом (ферросплав).
При изготовлении стального металлопроката марганец незаменим — он выступает легирующим элементом, удаляет из сплава серу и кислород.
Улучшенные свойства металлопроката позволяют его использовать в производстве стойкой к износу техники и различных механизмов в военной, строительной, авиационной промышленности.
Применение в медицине
В медицинской отрасли марганец применяется в виде перманганата калия. Его водный раствор (до 5 % содержания марганца) обладает антисептическим, кровоостанавливающим, адсорбирующими свойствами.
Раствор не имеет противопоказаний, он разрешён даже для ухода за пупочной раной младенцев. Но важно помнить, что сильно концентрированный раствор может вызвать тяжёлые ожоги.

Методы добычи марганцевой руды
Ежегодно в мире добывается порядка 25 млн тонн марганцевой руды. Работы ведутся в основном открытым способом, реже — подземным.
Карьерные разработки используются, если месторождения марганцевых руд неглубоко залегают под землёй. В зависимости от площади месторождения, роются котлованы различных размеров.
Разработка карьера осуществляется следующим образом:
- при помощи спецтехники (чаще всего бульдозеров) вскрывается и убирается верхний слой земли, покрывающий залежи ископаемого;
- марганцевая руда подвергается дроблению;
- руда грузится на самосвалы и отправляется на завод для переработки.
- после завершения работ карьер снова покрывается пластом земли, проводится рекультивация.
При подземном способе добычи главной задачей является подъём руды на поверхность.
Процесс заключается в следующем:
- на территории месторождения роются горизонтальные (штольни) или вертикальные проходы (шахты);
- под землёй осуществляется дробление руды при помощи оборудования;
- руда грузится на конвейер и доставляется на поверхность.
Подземный способ добычи марганцевой руды более затратный в финансовом отношении, нежели открытый. Он требует большего количества современной спецтехники и рабочих. Но руда, добываемая под землёй, считается более качественной, вложения окупаются при её реализации.
Вместе с тем при открытом способе добычи не требуется большая численность рабочих, техника более простая и экономичная в использовании.
Главными достоинствами открытой разработки являются:
- высокий показатель производительности труда;
- относительная безопасность процесса (вероятность возникновения несчастных случаев намного меньше, чем при подземных работах).
Данные преимущества компенсируют отрицательное воздействие погодных условий и необходимость обработки большого участка земли.

Категории месторождений марганцевой руды
В зависимости от сложности геологического строения, формы и размера руды, все месторождения подразделяют на 3 вида (установленных соответствующим приказом «О классификации запасов марганцевых руд» от 11.12.2006 г.):
- 1-я группа сложности — залежи с несложным геологическим строением; руда представлена крупными пластами, в которых марганец распределён равномерно;
- 2-я группа сложности — залежи со сложным геологическим строением; руда представлена крупными пластами, в которых марганец распределён неравномерно;
- 3-я группа сложности — залежи со сложным геологическим строением; руда представлена мелкими пластами, в которых марганец распределён неравномерно, а его количество крайне мало.

Способы извлечения марганца из руды
Чаще всего чистый марганец получают из руды методом выщелачивания. В процессе могут быть использованы различные химические вещества, например сернистая кислота, железистый сульфат, аммония сульфат и пр. Их разнообразие обусловлено тем, что марганец имеет множество соединений и модификаций, каждый из которых по-разному вступает в химические реакции.
Несмотря на то что не существует определённой классификации методов извлечения металла из марганцевой руды, все они имеют схожий процесс:
- руда измельчается до степени, обеспечивающей максимальную скорость реакции при взаимодействии с различными веществами;
- запускается процесс выщелачивания, в результате которого марганец принимает вид раствора;
- полученный раствор очищается от примесей;
- при воздействии на него реагентом или при его выпаривании марганец выпадает в осадок в чистом виде.
С помощью химических реагентов можно извлечь марганец из шламов, бедных руд, отходов промышленного производства.
Где добывают марганцевые руды? Страны — лидеры
На сегодняшний день лидером по добыче марганцевых руд является Россия, она занимает ведущее место уже несколько десятилетий. В других государствах нет разведанных крупных и богатых месторождений, их поиск ведётся постоянно. Широкое применение марганца в металлургической промышленности обеспечило ему экономическую привлекательность.
Небольшие месторождения имеются в следующих странах: Болгария, Румыния, Китай, Украина, Казахстан, Чехия, Германия, ЮАР, Бразилия, Индия, Австралия, Япония, Индонезия, Мексика. В большинстве из них сконцентрированы залежи руды, не отличающейся высоким качеством. Потребности этих стран удовлетворяются за счёт импортируемой руды.

Страны с высоким уровнем развития металлургической промышленности (США, Франция, Бельгия и пр.) активно ведут поиски крупных месторождений в целях сокращения объёмов импорта. Это позволит им удовлетворять внутренние потребности государства за счёт собственных ресурсов.
Повышенный интерес США направлен на извлечение и дальнейшее использование в промышленности железно-марганцевой руды, сосредоточенной на дне Мирового океана.
Добыча марганцевой руды в России
Несмотря на лидирующую позицию, Россия испытывает значительные проблемы в области добычи марганца. Распад Советского Союза ознаменовался началом крайней степени дефицита металла высокого качества. Основная часть работ по его добыче велась на месторождениях, которые отныне территориально принадлежат другим государствам.
Такое положение вынудило Россию приобретать марганец высокого качества в зарубежных странах по ценам импорта, чтобы покрыть потребности металлургической промышленности. Данная ситуация сохраняется по сей день.
В настоящее время добыча марганцевой руды в России осуществляется на следующих месторождениях:
- Парнокское (Республика Коми);
- Дурновское (Кемеровская область);
- Громовское (Читинская область).
Они являются крупнейшими, всего же в России имеется 16 месторождений.
На сегодняшний день основная деятельность направлена на снижение объёмов импорта, для этого активно ведётся поиск и разработка новых месторождений. Одним из самых перспективных районов считается Улу-Теляк.
Это небольшое село в Башкирии, со времён СССР известное значительными запасами марганцовистого известняка. Главная особенность этого соединения заключается в том, что он сочетает в себе все свойства обоих элементов, выполняя в металлургической промышленности также 2 роли.
В марганцовистом известняке Улу-Теляка марганца немного — до 9 %, но его использование в данном сочетании привлекательно для чёрной металлургии. Основная сложность заключается в отсутствии чётких технологий производства с использованием нового ископаемого.
С появлением отлаженного процесса появится возможность значительно экономить финансовые средства за счёт сокращения использования ферросплава, новый материал имеет все шансы стать ему достойной заменой.

Перспективы отрасли
Металлургическая промышленность, стремительно набирающая обороты развития во всём мире, вынуждает страны заниматься активным поиском месторождений марганцевых руд. С каждым годом совершенствуются технологии, ведутся разработки перспективных территорий. Главной целью любого государства является снижение объёма импорта, чтобы удовлетворение внутренних потребностей происходило, в основном за счёт собственных ресурсов.
Ма́рганец — элемент побочной подгруппы седьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 25. Обозначается символом Mn (лат. Manganum , ма́нганум , в составе формул по-русски читается как марганец , например, KMnO4 — калий марганец о четыре ; но нередко читают и как манган ). Простое вещество марганец (CAS-номер: 7439-96-5) — металл серебристо-белого цвета. Известны пять аллотропных модификаций марганца — четыре с кубической и одна с тетрагональной кристаллической решёткой.
Один из основных материалов марганца — пиролюзит — был известен в древности как черная магнезия и использовался при варке стекла для его осветления. Его считали разновидностью магнитного железняка, а тот факт, что он не притягивается магнитом, Плиний Старший объяснил женским полом черной магнезии, к которому магнит «равнодушен». В 1774 г. шведский химик К. Шееле показал, что в руде содержится неизвестный металл. Он послал образцы руды своему другу химику Ю. Гану, который, нагревая в печке пиролюзит с углем, получил металлический марганец. В начале XIX века для него было принято название «манганум» (от немецкого Manganerz — марганцевая руда).
Марганец твердый хрупкий металл. Известны четыре кубические модификации металлического марганца. При температурах от комнатной и до 710°C устойчив a-Mn, параметр решетки а = 0,89125 нм, плотность 7,44 кг/дм3. В интервале температур 710-1090°C существует b-Mn, параметр решетки а = 0,6300 нм; при температурах 1090-1137°C — g-Mn, параметр решетки а = 0,38550 нм. Наконец, при температуре от 1137°C и до температуры плавления (1244°C) устойчив d-Mn с параметром решетки а = 0,30750 нм. Модификации a, b, и d хрупкие, g-Mn пластичен. Температура кипения марганца около 2080°C.
На воздухе марганец окисляется, в результате чего его поверхность покрывается плотной оксидной пленкой, которая предохраняет металл от дальнейшего окисления. При прокаливании на воздухе выше 800°C марганец покрывается окалиной, состоящей из внешнего слоя Mn3O4 и внутреннего слоя состава MnO.
Марганец образует несколько оксидов: MnO, Mn3O4, Mn2O3, MnO2 и Mn2O7. Все они, кроме Mn2O7, представляющего собой при комнатной температуре маслянистую зеленую жидкость с температурой плавления 5,9°C, твердые кристаллические вещества.
Монооксид марганца MnO образуется при разложении солей двухвалентного марганца (карбоната и других) при температуре около 300°C в инертной атмосфере:
MnCO3 = MnO + CO2
Этот оксид обладает полупроводниковыми свойствами. При разложении MnOОН можно получить Mn2O3. Этот же оксид марганца образуется при нагревании MnO2 на воздухе при температуре примерно 600°C:
4MnO2 = 2Mn2O3 + O2
Оксид Mn2O3 восстанавливается водородом до MnO, а под действием разбавленных серной и азотной кислот переходит в диоксид марганца MnO2.
Если MnO2 прокаливать при температуре около 950°C, то наблюдается отщепление кислорода и образование оксида марганца состава Mn3O4:
3MnO2 = Mn3O4 + O2
Этот оксид можно представить как MnO·Mn2О3, и по свойствам Mn3О4 соответствует смеси этих оксидов.
Диоксид марганца MnO2 — наиболее распространенное природное соединение марганца в природе, существующее в нескольких полиморфных формах. Так называемая b-модификация MnO2 — это уже упоминавшийся минерал пиролюзит. Ромбическая модификация диоксида марганца, g-MnO2 также встречается в природе. Это — минерал рамсделит (другое название — полианит).
Диоксид марганца нестехиометричен, в его решетке всегда наблюдается дефицит кислорода. Если оксиды марганца, отвечающие его более низким степеням окисления, чем +4, — основные, то диоксид марганца обладает амфотерными свойствами. При 170°C MnO2 можно восстановить водородом до MnO.
Если к перманганату калия KMnO4 добавить концентрированную серную кислоту, то образуется кислотный оксид Mn2O7, обладающий сильными окислительными свойствами:
2KMnO4 + 2H3SO4 = 2KHSO4 + Mn2O7 + H3O.
Mn2O7 — кислотный оксид, ему отвечает сильная, не существующая в свободном состоянии марганцовая кислота НMnO4.
При взаимодействии марганца с галогенами образуются дигалогениды MnHal2. В случае фтора возможно также образование фторидов состава MnF3 и MnF4, а в случае хлора — также трихлорида MnCl3. Реакции марганца с серой приводят к образованию сульфидов составов MnS (существует в трех полиморфных формах) и MnS2. Известна целая группа нитридов марганца: MnN6, Mn5N2, Mn4N, MnN, Mn6N5, Mn3N2.
С фосфором марганец образует фосфиды составов MnР, MnP3, Mn2P, Mn3P, Mn3P2 и Mn4P. Известно несколько карбидов и силицидов марганца.
С холодной водой марганец реагирует очень медленно, но при нагревании скорость реакции значительно возрастает, образуется Mn(OH)2 и выделяется водород. При взаимодействии марганца с кислотами образуются соли марганца (II):
Mn + 2HCl = MnCl2 + H3.
Из растворов солей Mn2+ можно осадить плохо растворимое в воде основание средней силы Mn(OH)2:
Mn(NO3)2 + 2NaOH = Mn(OH)2 + 2NaNO3
Марганцу отвечает несколько кислот, из которых наиболее важны сильные неустойчивые марганцоватая кислота H3MnO4 и марганцовая кислота HMnO4, соли которых — соответственно, манганаты (например, манганат натрия Na2MnO4) и перманганаты (например, перманганат калия KMnO4).
Манганаты (известны манганаты только щелочных металлов и бария) могут проявлять свойства как окислителей (чаще)
2NaI + Na 2MnO 4 + 2H 2O = MnO 2 + I 2 + 4NaOH ,
так и восстановителей
2K2MnO4 + Cl2 = 2KMnO4 + 2KCl.
В водных растворах манганаты диспропорционируют на соединения марганца (+4) и марганца (+7):
3K2MnO4 + 3Н2О = 2KMnO4 + MnO2·Н2О + 4КОН.
При этом окраска раствора из зеленой переходит в синюю, затем в фиолетовую и малиновую. За способность изменять окраску своих растворов К. Шееле назвал манганат калия минеральным хамелеоном.
Перманганаты — сильные окислители. Например, перманганат калия KMnO4 в кислой среде окисляет сернистый газ SO2 до сульфата:
2KMnO4 + 5SO2 +2H3O = K2SO4 + 2MnSO4 + 2H3SO4.
При давлении около 10 МПа безводный MnCl2 в присутствии металлоорганических соединений реагирует с оксидом углерода (II) CO с образованием биядерного карбонила Mn2(CO)10.
Промышленное получение марганца начинается с добычи и обогащения руд. Если используют карбонатную руду марганца, то ее предварительно подвергают обжигу. В некоторых случаях руду далее подвергают сернокислотному выщелачиванию. Затем обычно марганец в полученном концентрате восстанавливают с помощью кокса (карботермическое восстановление). Иногда в качестве восстановителя используют алюминий или кремний. Для практических целей чаще всего используют ферромарганец, полученный в доменном процессе при восстановлении руд железа и марганца коксом. В ферромарганце содержание углерода составляет 6-8 % по массе.
Чистый марганец получают электролизом водных растворов сульфата марганца MnSO4, который проводят в присутствии сульфата аммония (NH4)2SO4. более 90% производимого марганца идет в черную металлургию. Марганец используют как добавку к сталям для их раскисления, десульфурации (при этом происходит удаление из стали нежелательных примесей — кислорода, серы и других), а также для легирования сталей, т. е. улучшения их механических и коррозионных свойств. Марганец применяется также в медных, алюминиевых и магниевых сплавах. Покрытия из марганца на металлических поверхностях обеспечивают их антикоррозионную защиту. Для нанесения тонких покрытий из марганца используют легко летучий и термически нестабильный биядерный декакарбонил Mn2(CO)10.
Соединения марганца (карбонат, оксиды и другие) используют при производстве ферритных материалов, они служат катализаторами многих химических реакций, входят в состав микроудобрений. Перманганат калия применяют для отбеливания льна и шерсти, обесцвечивания технологических растворов, как окислитель органических веществ. В медицине применяют некоторые соли марганца. Например, перманганат калия используют как антисептическое средство в виде водного раствора, в некоторых случаях раствор применяют при отравлении алкалоидами и цианидами.
3. Марганец — 14-й элемент по распространенности на земле, а после железа второй тяжелый металл, содержащийся в земной коре (около 0.1% по массе или 0.03% от общего числа атомов земной коры). Весовое количество марганца увеличивается от кислых (600 г/т) к основным породам (2,2 кг/т). Сопутствует железу во многих его РУДАХ, однако встречаются и самостоятельные месторождения марганца. Общее число марганцевых минералов, встречающихся в природе, превышает 150. Однако широко распространенных и содержащих повышенное количество Мп минералов немного.
Наиболее распространенные минералы марганца:
пиролюзит MnO2 ·x H3O, самый распространённый минерал (содержит 63,2 % марганца);
манганит (бурая манганцевая руда) MnO(OH) (62,5 % марганца);
браунит 3Mn2O3·MnSi O3 (69,5 % марганца);
родохрозит (марганцевый шпат, малиновый шпат) MnCO3 (47,8 % марганца);
псиломелан m MnO MnO2 n H3O (45-60 % марганца);
пурпурит (Mn3+), 36,65 % марганца.
4. Ресурсы марганцевых руд выявлены в 56 странах мира и составляют 21,27 млрд. г, в том числе в Африке — 14,33 млрд. т (67,4 % мировых) и Европе — 3,44 млрд. т (16,2 %). Запасы марганцевых руд известны также в 56 странах. Подтвержденные запасы марганцевых руд составляют 5,4 млрд. т. До 90 % общемировых подтвержденных запасов марганца заключено в стратиформных месторождениях, около 8 % в корах выветривания и 2 % — в месторождениях гидротермального типа. Главными держателями запасов марганца являются 11 стран, владеющих примерно 95 % мировых подтвержденных запасов (5,1 млрд. т). Это Украина, ЮАР, Казахстан, Габон, Грузия, Австралия, Бразилия, Китай, Россия, Болгария, Индия. К уникальным относятся месторождения с запасами марганцевых руд более 1 миллиарда тонн, к крупным — с запасами в сотни миллионов тонн, и мелким — с запасами в десятки миллионов тонн.
Производство товарных марганцевых руд в 1996 г. составило 21,8 млн. т. В семерку главных продуцентов марганцевого сырья входят страны, являющиеся основными держателями запасов: Китай (21,6 % мирового производства), ЮАР (15 %), Украина (14 %), Бразилия (10,1 %), Австралия (9,7 %), Габон (9,2 %), Индия (7,8 %). Китай, не смотря на низкое качество природных руд, с 1993 г. удерживает лидерство по выпуску товарной руды. В производстве марганцевых сплавов используется смесь руд, добытых в Китае, с высококачественным сырьем, ввозимым из Австралии, Габона и ЮАР. В ЮАР эксплуатируются рудники Маматван, Весселс и Нчванинг. Почти вся продукция (98 %) относится к рудам металлургического сорта (40-52 % Мп). На Украине в 1992-1998 гг. наблюдалось падение производства товарных марганцевых руд. Основные причины спада — энергетические трудности и потеря традиционных рынков сбыта в странах СНГ и Восточной Европы. Разрабатываются месторождения Никопольского бассейна и месторождение Таврическое. Действует 12 рудников, три из которых подземные. Металлогения и эпохи рудообразования. В геосинклинальных условиях основная концентрация марганца происходила на ранней стадии, когда в прибрежных бассейнах накапливались осадочные руды. Средняя и поздняя стадии геосинклинального цикла для марганца не продуктивны. На платформенном этапе формировались марганцевые месторождения осадочной группы и выветривания. Фациальные условия образования осадочных марганцевых руд напоминают обстановки отложения руд железа. В распределении марганцевых руд намечается зональность: первично-оксидные руды отлагаются в прибрежной зоне среди осадков песчано-алеврито-глинистого состава; по мере удаления от берега оксидные руды постепенно сменяются карбонатными (родохрозит, манганокальцит, кальциевый родохрозит), ассоциирующими с глинами, кремнистыми глинами и опоками. Метаморфизованные месторождения возникли в результате многоэтапного регионального метаморфизма. Как известно, они широко распространены в Индии. При низкой ступени метаморфизма оксиды и, возможно карбонаты марганца были превращены в брауниты, а кремнистые породы — в кварциты. При средних ступенях метаморфизма возникали силикаты марганца, частично происходила перекристаллизация браунита. Марганцевые месторождения формировались в различные эпохи развития земной коры, от докембрийской вплоть до кайнозойской, а железо-марганцевые конкреции накапливаются на дне Мирового океана и в настоящее время. В докембрийскую металлогеническую эпоху сформировались мощные геосинклинальные образования, характеризующиеся в ряде случаев высокопродуктивными марганценосными толщами (гондиты в Индии, марганецсодержащие железистые кварциты в Бразилии и т. д.). Значительные по запасам месторождения марганца докембрийского возраста известны в Гане (месторождение Нсута-Дагвин), а крупные в ЮАР (юго-восточная часть пустыни Калахари). Для раннепалеозойской эпохи марганец мало характерен. Сравнительно небольшие промышленные месторождения марганца этого возраста известны в Китае, США и восточных районах России. В Китае наиболее крупным из них является месторождение Шаньвуту, расположенное в провинции Хунань. Марганцевые руды пластообразной формы согласно залегают среди известняков, песчаников и сланцев силурийского возраста. Мощность залежей около 1 м. Основные минералы псиломелан и пиролюзит. Наибольший интерес представляют участки вторично обогащенных руд, в которых среднее содержание марганца варьирует от 43,2 до 46,7% и кремнезема от 8,2 до 11,9%. В России месторождения марганца известны в Кузнецком Алатау, а также на Дальнем Востоке (Малый Хинган). Позднепалеозойская эпоха для марганца имеет сравнительно небольшое практическое значение. Удельный вес месторождений марганцевых руд этого возраста в мировых запасах и добыче невелик. Небольшие по масштабам месторождения известны в Западной Европе, Северной Африке, Юго-Восточной Азии, а также в СНГ. Наиболее крупные по запасам месторождения разведаны в Центральном Казахстане — Джездинское и Ушкатын-Ш. На месторождении Ушкатын-Ш выявлено 14 марганцевых и 8 железорудных тел. Запасы подсчитаны в четырех рудных телах. Среднее содержание Мп 26,5 %. Основные рудные минералы в первичных рудах — гаусманит, браунит и гематит, во вторичных — псиломелан, пироморфит и манганит. В мезозойскую эпоху сформировались рудопроявления марганца в связи с позднемеловым (Закавказье, Забайкалье) и юрским (береговые хребты Северной Америки, Новая Зеландия) вулканизмом. Месторождения марганца этого возраста имели также небольшое практическое значение. Ситуация резко изменилась в связи с открытием в конце 1960-х годов крупного месторождения Грут-Айленд в Австралии. Кайнозойская эпоха отличается уникальным накоплением марганцевых руд на южной окраине Восточно-Европейской платформы (Никопольский бассейн, Чиатурское, Мангышлакское и другие месторождения). В эту эпоху сформировалось крупное месторождение Оброчиште в Болгарии, а также Моанда в Габоне. Рудоносными на всех этих месторождениях являются песчано-глинистые отложения, в которых рудообразующие минералы присутствуют в форме конкреций, оолитов, стяжений и землистых скоплений. Сравнительно небольшие месторождения марганцевых руд третичного возраста образуют Уральский марганцеворудный бассейн, охватывающий восточный склон Уральского хребта. Он простирается в субмеридиональном направлении почти на 150 км. На этих месторождениях рудный горизонт приурочен к основанию третичной толщи и включает 1-2 пласта марганцевых руд мощностью 1-3 м. Генетические типы промышленных производств. Промышленные месторождения марганцевых руд представлены: 1) осадочными, 2) вулканогенно-осадочными, 3) выветривания и 4) метаморфогенными типами. Осадочные месторождения имеют большое экономическое значение. В них сосредоточено около 80 % всех мировых запасов марганцевых руд. Наиболее крупные месторождения сформировались в прибрежно-морских и лагунных олигоценовых бассейнах, сосредоточенных в основном в пределах Паратетиса. Это Никопольский бассейн на Украине, Чиатурское месторождение в Грузии, Мангышлакское в Казахстане, Оброчиште в Болгарии и др. Наиболее характерным представителем этого типа является Никольский марганцеворудный бассейн. Он включает Никопольское и Большетокмакское месторождения и ряд рудоносных площадей, вытянутых вдоль берегов Днепра и Ингульца в районе городов Никополя и Запорожья в виде полосы протяженностью 250 км и шириной до 5 км (рис. 8). Выдержанный рудный пласт средней мощностью 1,5-2,5 м залегает в основании терригеновой олигоценовой толщи на глубине от 10 до 100 м. Он представляет собой песчано-глинистую пачку с включением марганцевых конкреций, линз и стяжений, прослоев рудного вещества. Соотношение рудной и нерудной составляющей изменчиво по вертикали и латерали. Количество марганцевых руд, заключенных в глинисто-алевролитовой массе достигает 50 % по массе, а среднее содержание марганца 15-25 %. Марганцеворудные отложения залегают с размывом на подстилающих породах верхнего эоцена, представленных алевритами, углистыми глинами и песками, или на кристаллических породах фундамента и их корах выветривания. Надрудные отложения — плиоценовые глины, известняки-ракушечники, мергели и четвертичные суглинки общей мощностью от 15 до 80 м. В пределах этого бассейна выделяются оксидные, смешанные (оксидно-карбонатные) и карбонатные марганцевые руды. Среди разведанных запасов соотношение оксидных, смешанных и карбонатных руд равно 25:5:70. На собственно Никопольском месторождении сосредоточено 72 % общих запасов оксидных руд (пиролюзит, манганит, псиломелан, вернадит) Украины, а на Большетокмакском — доминируют карбонатные марганцевые руды (родохрозит, манганокальцит). Содержание марганца в карбонатных рудах составляет 10-30 % (среднее 21 %), СаО 3- 13 %, Si02 10-50 %. Руды труднообогатимые. В оксидных рудах среднее содержание Мп — 28,2 %, Fe — 2- 3 %, Р — 0,25 %, Si02 — около 30 %. Они легко обогащаются простыми гравитационными способами. Смешанные руды содержат в среднем около 25 % Мп. Преобладают фосфоридные руды. Малофосфористые разности, встречающиеся в зонах оксидных и смешанных руд в виде тел со сложными контурами, составляют около 4 % от общих запасов. Разработка отдельных участков в Никопольском бассейне осуществляется открытым и частично подземным способами. Железомарганцевые конкреции дна океанов. Впервые они были обнаружены на дне Тихого океана экспедицией на судне «Челенджер» 120 лет назад. Мощность железо-марганцевых корок на базальтах и туфобрекчиях изменяется от нескольких миллиметров до 10-15 см. Размеры конкреций от 1 мм до 1 м в диаметре, чаще всего встречаются конкреции 3-7 см в поперечнике. Морфологические типы «шкреций — сферические, лепешковидные, эллипсоидальные, плитчатые, желвакообразные, гроздьевидные. Япония и США, не имеющие крупных месторождений марганца, осуществляют добычу железо-марганцевых конкреций со дна Тихого и Атлантического океанов на глубинах до 5 км. В конкрециях содержится (%): Мп 25-30; Fe 10- 12; Ni 1-2; Со 0,3-1,5 и Си 1-1,5. Вулканогенно-осадочные месторождения приурочены к областям интенсивного проявления подводного вулканизма, характеризующимися накоплением лав и туфов с подчиненным количеством осадочных пород и руд. Для них характерна тесная связь с кремнистыми (яшмы, туфы), карбонатными (известняки, доломиты) и железистыми магнетит-гематитовыми) породами и рудами. Руды формировались на ранней стадии геосинклинального этапа в эвгеосинклинальных условиях. Поступление Fe, Мп, Si02, Си, Zn, Ва, РЬ и других компонентов осуществлялось поствулканическими подводными эксгаляциями и гидротермами. Вулканогенно-осадочные месторождения обычно характеризуются невысоким качеством руд и имеют небольшие масштабы. Рудные тела залегают в виде неправильных, быстро выклинивающихся пластов, линз, чечевиц. Они сложены преимущественно карбонатами марганца и железа. Месторождения этой группы отличаются браунит-гаусманитовым составом первичных руд и псиломелан-вернадитовыми рудами в корах выветривания. Мощность рудных тел обычно 1-10 м, содержание в них основных компонентов (%): Мп 40-55; Si02 менее 10; Р 0,03-0,06. К этому типу принадлежат месторождения Атасуйско-го и Джездинского районов Центрального Казахстана, а в России месторождения Примагнитогорской группы, Ир-Нилийское в Приохотье, связанные со спилиткератофир-кремнистой формацией, а также месторождения Салаирского кряжа, приуроченные к порфирово-кремнистой формации. Месторождения кор выветривания. В результате проявления процессов выветривания в зоне гипергенеза происходит интенсивное разложение марганцевых руд и марганепсодержащих пород с переходом двухвалентного марганца в четырехвалентную форму. Таким образом, формируются богатые скопления в виде марганцевых шляп. Месторождения данного генетического типа распространены в основном в Индии, Бразилии, Канаде, Венесуэле, Габоне. ЮАР, Австралии, а также России. При окислении родохрозита, манганокальцита, родонита и манганита образуются рыхлые богатые оксидные руды, состоящие из пиролюзита, псиломелана и вернадита. В Индии промышленное значение имеют богатые залежи марганцевых руд, образовавшиеся в корах выветривания (марганцевых шляпах) гондитов и кодуритов протерозойского возраста. В рудах содержание основных компонентов составляет (%): Мп 30-50; Si02 до 12; Fe до 14. Рдо 0,2, иногда до 2. Они распространены на глубинах 10-70 м. Наиболее крупные месторождения выявлены Е центральных и южных штатах Индии (Мадхья-Прадеш. Раджастан, Гуджарат, Орисса и др.). В гипергенных рудах, образовавшихся по марганецсо-держащим доломитам, концентрация Мп составляет 30-53 %, Si02 и Fe до 3 %, Р до 0,1 %. Они, в отличие от рул возникших по силикатным породам, характеризуются низким содержанием Si02 и Fe. Метаморфогенные месторождения образуются главным образом при региональном, реже при контактовом метаморфизме осадочных руд и марганецсодержащих пород. В процессе интенсивного регионального метаморфизма первичные оксиды и карбонаты марганца в дальнейшем целиком переходят в силикаты марганца — родонит, бустамит, марганцовистые гранаты в тесном срастании друг с другом. Примерами месторождений подобного типа могут служить Карсакпайская и Атасуйская группы месторожде ний Казахстана, а также некоторые месторождения Индии и Бразилии. Среди метаморфогенных месторождений по степени метаморфизма различают две формации: браунит-гаусманитовую и марганец-силикатную. Месторождения браунит-гаусманитовой формации образуются в результате относительно слабого прогрессивного метаморфизма первичных руд, сложенных гидроксидами н оксидами марганца. К этой группе относятся многочисленные месторождения Индии, приуроченные к отложениям нижнего и среднего палеозоя. Это пласты и линзы оксидных марганцевых руд, залегающих согласно со слабо метаморфизованными вмещающими породами. Нередко рудные залежи вместе с вмещающими породами дислоцированы. Протяженность рудных тел от нескольких десятков и сотен метров до 2-3 км, мощность их от 1 до 15 м и более. Главные рудные минералы: браунит, голландит, реже биксбиит и манганит. Наиболее важное значение имеют месторождения Панч-Махал, Барода, Уква, Кеопджари и Сингбхуме. Месторождения марганец-силикатной формации распространены в Индии и Бразилии. В Индии они связаны исключительно с образованиями архея — гондитами и кодуритами. Гондиты сложены спессартином, кварцем и родонитом, кондуриты состоят из калиевого полевого шпата, марганецсодержащего граната и апатита. Протяженность рудных тел 3-8 км и более, мощность от 3 до 60 м. Содержание марганца в них варьирует от 10 до 21 %, а в зоне выветривания (марганцевых шляпах) увеличивается до 30- 50 %. Наиболее крупные месторождения находятся в штатах Андхра-Прадеш (месторождения Кудур, Тарбхар), Мад-хья-Прадеш (Рамрара, Стапатар) и Махараштра (Бузург, Донгри и др.). Гондиты и кодуриты в настоящее время не отрабатываются.
Промышленные месторождения марганцевых руд на Урале относятся к двум генетическим типам: осадочному и вулканогенному гидротермально-осадочному.
Осадочные месторождения марганцевых руд располагаются на четырех стратиграфических уровнях: 1 – ордовикском, 2 – нижнекаменноугольном, 3 – верхнепермском, 4 – мел-палеогеновом (Е.С.Контарь, К.П.Савельева, 1998).
Марганцевые месторождения в ордовикских отложениях выявлены в Предуральской зоне Северного и Полярного Урала. К ним относятся Парнокское месторождение в Республике Коми и Чувальская группа месторождений в Пермской области.
Парнокское железо-марганцевое месторождение выявлено в 1987 г. Воркутинской геологической экспедицией. Оно расположено в 70 км к юго-востоку от города Инта, в предгорьях Полярного Урала, в среднем течении р.Парнока-Ю (восточного притока р.Лемвы).
Парнокское месторождение приурочено к толще ордовикских известняков, к границе между известняками и углисто-глинистыми сланцами. Пластообразные рудные тела залегают согласно с вмещающими породами, имея юго-восточное падение под углом 10–45%. Они распространены на площади 4,6х5,6 км, где выделяются несколько рудоносных участков: Магнитный 1, Магнитный 2, Пачвожский, Восточный, Дальний (М.А.Шишкин, Н.Н.Герасимов, 1995). Мощность отдельных рудных пластов изменяется от 0,5 до 5,8 м. Суммарная мощность нескольких сближенных пластов местами достигает 15 м.
На месторождении выделяются три типа руд: марганцевые карбонатные, марганцевые окисленные, магнетитовые. Марганцевые карбонатные руды бурого и кремового цвета являются первичными; они состоят в основном из родохрозита, манганокальцита, родонита. Среднее содержание марганца в них составляет 24%. На верхних горизонтах месторождения, до глубины 30–70 м, под действием процессов выветривания карбонатные руды преобразованы в черные окисленные руды, состоящие из псиломелана, гаусманита, пиролюзита. По категории С2 балансом учтены запасы окисленных руд в количестве 3885 тыс. т, а прогнозные ресурсы марганцевых руд Парнокского месторождения оцениваются в 20 млн т (Н.П.Юшкин, А.М.Пыстин, 1997). С 1993 г. на Парнокском месторождении начата опытная добыча окисленных марганцевых руд.
Верхне-Чувальские месторождения в Пермской области изучены только на верхних горизонтах в зоне окисления, где развиты черные и бурые железомарганцевые руды. Эти месторождения эксплуатировались ранее как железорудные. Предполагается, что на глубине залегают первичные карбонатные руды. Е.С.Контарь (устное сообщение) предполагает, что группа Чувальских марганцевых месторождений может иметь значительные размеры.
Осадочные марганцевые месторождения раннекаменноугольного возраста распространены в основном в Тагило-Магнитогорской зоне Восточного склона Урала. Здесь выявлены Кипчакское месторождение в Челябинской области и Аккермановское месторождение в Оренбургской области, а также ряд рудопроявлений (Клевакинское, Амамбайское, Орское и др.). Более крупное Аккермановское месторождение, расположенно в 20 км к юго-западу от г.Орска. На этом месторождении рудное тело мощностью 4–5 м залегает среди известняков и круто, под углом 70–80о, падает на запад. Оно прослежено по простиранию на 2 км. Руды состоят из пиролюзита, псиломелана, лимонита и гетита. Среднее содержание марганца в рудах составляет (в %) 16,3, железа – 6,0, кремнезема – около 50. Разведанные запасы руд оценены в 3793 тыс. т (Н.П.Варламов, Г.И.Водорезов, С.Х.Туманов, 1966). Во время Великой Отечественной войны месторождение разрабатывалось для нужд Магнитогорского металлургического комбината.
Верхнепермские осадочные марганцевые руды представлены месторождением Улу-Теляк, расположенным в 70 км к востоку от г.Уфы. На этом месторождении разведано субгоризонтально лежащее тело светло-коричневых марганцовистых из-вестняков мощностью от 1 до 18 м. Марганцовистые известняки сохранились на возвышенных местах, а на их склонах и в долинах распространены переотложенные руды, образовавшиеся в результате разрушения первичных руд — марганцовистых известняков и перемещения их в виде обломочного материала в пониженные участки рельефа. Первичные руды состоят из марганецсодержащего кальцита, а переотложенные руды сложены псиломеланом, вернадитом, опалом, халцедоном. Содержание марганца в марганцовистых известняках составляет 8-10%, в переотложенных рудах 11-17%. Разведанные запасы руды на Улутелякском месторождении составляют около 6, 5 млн т (Н. М. Благовещенская, 1966). В связи с низкими содержаниями марганца Улутелякское месторождение не эксплуатируется.
Мел-палеогеновые осадочные марганцевые месторождения расположены в Свердловской области, на Восточном склоне Северного Урала, где выделяется Северо-Уральский марганцеворудный бассейн. Он простирается на 300 км к северу от широты г. Серова вдоль западной границы мезозойско-кайнозойских отложений. В настоящее время этот бассейн обладает наибольшими запасами разведанных марганцевых руд и только здесь осуществляется промышленная добыча марганцеворудного сырья на Урале. На площади Северо-Уральского марганцеворудного бассейна выявлены более 15 промышленных месторождений, из которых 9 детально изучены: Березовское, Ново-Березовское, Южно-Березовское, Екатерининское, Марсятское, Юркинское, Лозьвинское, Ивдельское, Тыньинское; а одно месторождение -Полуночное — уже выработано.
Марганцевые руды Северо-Уральского бассейна залегают в виде пластов среди рыхлых и полусцементированных слоев глин, песков, галечников, алевролитов, песчаников. В восточной части бассейна рудные залежи имеют преимущественно субгоризонтальное залегание, а в западной его части, вблизи разломов, смяты в складки и разорваны. Пласты марганцевых руд имеют протяженность с юга на север от 1,5 до 7,5 км, при ширине 100-800 м и мощности 0,5-5,0 м. Они прослежены скважинами до глубины около 300 м. Первичные марганцевые руды имеют существенно карбонатный состав. Главными рудными минералами являются родохрозит и манганокальцит. На верхних горизонтах месторождений под воздействием процессов выветривания карбонатные руды превращены в окисленные, состоящие из пиролюзита, псиломелана, манганита и песчано-глинистого материала. Содержание марганца в первичных рудах составляет 15-20%, а в окисленных 25-30%.
Одним из более изученных объектов Северо-Уральского бассейна является Полуночное марганцевое месторождение, расположенное в 23 км к северу от г.Ивделя. Месторождение открыто в 1920 г., а в 1942 г. начата его эксплуатация, которая продолжалась до 1965 г.
Рудная залежь Полуночного месторождения залегает на размытой поверхности палеозойских порфиритов на палеогеновых кварц-глауконитовых песках. Она простирается на 1500 м с юга на север при ширине 600 м. Залежь наклонена на восток под углом 7-10°. На глубине около 100 м она выклинивается. В первичных карбонатных рудах Полуночного месторождения среднее содержание составляет (%): марганца 20,7, железа – 3,6, фосфора – 0,19. В окисленных рудах содержание марганца более высокое – в среднем 27,5%.
В настоящее время эксплуатируются Тыньинское, Ново-Березовское, Березовское и Южно-Березовское месторождения. Общие разведанные запасы марганцевых руд Северо-Уральского бассейна составляют 41,9 млн т (А.В.Сурганов и др., 1997). Объем добычи марганцевых руд пока небольшой, но, по расчетам проектных институтов, через 5 лет эксплуатации он может достичь 350 тыс. т в год.
Осадочные месторождения марганца сформировались в прибрежных зонах древних морей. При выветривании горных пород на прилегающей суше содержавшийся в них марганец растворялся в воде и выносился реками и ручьями в море. Смешение сравнительно кислых вод, принесенных с суши, с морскими щелочными водами вызывало осаждение марганца в прибрежных зонах, достигая в благоприятных условиях промышленных концентраций. Высказано также мнение об эндогенных источниках марганца. Так, для Парнокского месторождения предполагается привнос марганца с больших глубин по разломам в земной коре, т.е. гидротермально-осадочный генезис части марганцевых руд (М.А.Шишкин, Н.Н.Герасимов, 1995).
Вулканогенные гидротермально-осадочные месторождения марганцевых руд распространены в Тагило-Магнитогорской зоне, где в силурийском и девонском периодах, т.е. 354–434 млн лет назад, происходил активный вулканизм преимущественно в подводно-морских условиях. Горячие воды, выделяющиеся из вулканов и окружающих их фумаролл, содержали марганец, кремний, железо и другие химические элементы. Эти элементы в виде карбонатных, силикатных и оксидных соединений осаждались вблизи вулканов на дне морских бассейнов, образуя местами промышленные кремнисто-марганцевые месторождения.
На Южном Урале, в основном на территории Баймакского, Абзелиловского и Учалинского районов Республики Башкортостан, выявлены многочисленные кремнисто-марганцевые месторождения, приуроченные к горизонту сургучно-красных бугулыгырских яшм и другим слоям кремнистых пород. Более значительными объектами такого типа являются Файзуллинское, Янзигитовское, Алимбетовское, Ниазгуловское, Кусимовское, Кожаевское, Уразовское месторождения. Рудные тела этих месторождений имеют форму пластов и линз, переслаивающихся с яшмами и алевролитами. Руды сложены родонитом, бустамитом, браунитом, псиломеланом, пиролюзитом, кварцем. Содержание марганца в кремнисто-марганцевых рудах составляет 10–25%, кремнезема 20–50%. Добыча этих руд была начата еще в 1880 г. на Уразовском месторождении для нужд Златоустовского и Белорецкого металлургических заводов. Позднее, в связи со строительством Магнитогорского металлургического комбината, были разведаны многие близрасположенные марганцевые месторождения. Во время Великой Отечественной войны они эксплуатировались, а руды поставлялись на Магнитогорский металлургический комбинат. Разведанные запасы кремнисто-марганцевых руд Южного Урала составляют 2,8 млн т. Однако в связи с малыми размерами месторождений и низким качеством руд в настоящее время они не эксплуатируются.
На Среднем Урале вулканогенные гидротермально-осадочные марганцевые месторождения известны в Нижнетагильском рудном районе. Здесь изучались Сапальское, Липовское, Казанское месторождения. Рудные тела этих месторождений залегают обычно на границе известняков со сланцами и туфопесчаниками. Они имеют форму неправильных линз. В геологическом строении месторождений участвуют вулканические породы – трахиты и интрузивные породы – сиениты.
Сапальское месторождение, расположенное в 6 км к северу от г.Нижнего Тагила, открыто в 1867 г. Руды этого месторождения состоят из гаусманита, браунита, псиломелана, родохрозита, манганокальцита. Содержание марганца в рудах составляет 30–42%. К настоящему времени оно выработано. Липовское и Казанское месторождения обладают малыми размерами и низким качеством руд. Присутствие на марганцевых месторождениях Нижнетагильского района интрузивных пород позволяет предполагать также гидротермальный генезис руд, связанный с внедрением сиенитов.
Небольшие объемы добычи марганцевых руд на месторождениях Северо-Уральского бассейна не обеспечивают потребности Уральского экономического района. Новые промышленные осадочные месторождения марганцевых руд могут быть выявлены в ордовикских отложениях западного склона Северного и Приполярного Урала, в раннекаменноугольных осадочных породах западного и восточного склонов Южного Урала, в палеогеновых отложениях восточного склона Северного Урала. Обеспечение потребностей Урала в марганцевых рудах за счет разработки Парнокского месторождения в Республике Коми, будет возможно после проведения железной дороги в этот район.
5.Марганец – важный и, безусловно, необходимый элемент в жизни человека. Заменить его нечем. Сейчас в России ощущается нехватка добычи марганца. Поэтому сегодня наиболее актуальны и разработка новых месторождений, даже подводных, и тщательное изучение свойств этого металла и его соединений.
Марганцевые руды ; 5 – оксидно-карбонатные марганцевые руды ; 6 – карбонатные марганцевые руды . В осадочных морских месторождениях. были известны только окисные руды , а карбонатные марганцевые руды открыты сравнительно недавно. .
Разработка мероприятий по повышению конкурентоспособности предприятия на примере ОАО ТНК Казхр
Имеются крупные разведанные запасы высококачественных марганцевых руд . Производство марганцевых ферросплавов в республике станет одной. Годовая добыча марганцевых руд в республике достигает 0,5 млн. тонн. Основная добыча марганцевой руды в Казахстане.
 Завершение формирования единого российского государства
Завершение формирования единого российского государства В предложении найди существительное, обозначающее признак как предмет Разряды имен существительных
В предложении найди существительное, обозначающее признак как предмет Разряды имен существительных Фелица. Державин Г.Р. Анализ оды. Одо-сатирический мирообраз в торжественной оде «Фелица В оде фелица державин прославлял
Фелица. Державин Г.Р. Анализ оды. Одо-сатирический мирообраз в торжественной оде «Фелица В оде фелица державин прославлял Русские мужские имена, начинающиеся на буквы м, н
Русские мужские имена, начинающиеся на буквы м, н
Марганец:представляем основные характеристики, производство и применение вещества
Марганец: основные характеристики, производство и применение вещества

Минералы марганца, в частности пиролюзит, известны были еще в античные времена. Считали пиролюзит разновидностью магнитного железняка и использовали при варке стекла – для осветления. То, что минерал в отличие от настоящего магнитного железняка магнитом не притягивается, объясняли довольно занятно: полагали, что пиролюзит – минерал женского пола и к магниту равнодушен.
В 18-м веке марганец выделили в чистом виде. И сегодня мы поговрим о нем детально. Так, обсудим, вреден ли чем опасен марганец, где его можно купить, как получить марганец и подчиняется ли он ГОСТу.
Что такое марганец
Марганец относится к подобной группе 7 группы 4 периода. Элемент является распространенным – занимает 14 место.
Элемент относится к тяжелым металлам – атомная масса более 40. На воздухе пассивируется – покрывается плотной оксидной пленкой, препятствующей дальнейшей реакции с кислородом. Благодаря этой пленке в нормальных условиях малоактивен.
При нагревании марганец вступает в реакцию с множеством простых веществ, кислот и оснований, образуя соединения с самой разной степенью окисления: -1, -6, +2, +3, +4, +7. Металл относится к переходным, поэтому с равной легкостью проявляет и восстановительные, и окислительные свойства. С металлами, например, с железом, образует твердые растворы, не вступая в реакцию.
Данное видео расскажет о том, что такое марганец:
Особенности и отличия от других материалов
Марганец – серебристо-белый металл, плотный, твердый – тверже железа, с необыкновенно сложной структурой. Последняя является причиной хрупкости вещества. Известны 4 модификации марганца. Сплавы с металлом позволяют стабилизировать любую из них и получить твердые растворы с очень разными свойствами.
- Марганец относится к числу жизненно важных микроэлементов. Причем в равной степени это относится и к растениям, и к животным. Элемент участвует в фотосинтезе, в процессе дыхания, активирует ряд ферментов, является непременным участником мышечного метаболизма и так далее. Суточная доза марганца для человека составляет 2– 9 мг. Одинаково опасен как недостаток, так и избыток элемента.
- Металл тяжелее и тверже железа, однако практического применения в чистом виде не имеет из-за высокой хрупкости. Но его сплавы и соединения имеют необыкновенно большое значение в народном хозяйстве. Он используется в черной и цветной металлургии, в производстве удобрений, в электротехнике, в тонком органическом синтезе и так далее.
- От металлов своей собственной подгруппы марганец довольно сильно отличается. Технеций – радиоактивный элемент, получен искусственно. Рений относит к рассеянным и редким элементам. Борий также может быть получен только искусственным путем и в природе не встречается. Химическая активность и технеция и рения намного ниже, чем у марганца. Практическое применение, если не считать ядерного синтеза, находит только марганец.

Плюсы и минусы
Физические и химические свойства металла таковы, что на практике дело имеют не с самим марганцем, а с его многочисленными соединениями и сплавами, так что достоинства и недостатки материала стоит рассматривать с этой точки зрения.
- Марганец образует самые разнообразные сплавы практически со всеми металлами, что является несомненным плюсом.
- Железо и марганец полностью взаиморастворимы, то есть, образуют твердые растворы с любым соотношением элементом, однородные по свойствам. При этом сплав будет иметь куда более низкую температуру кипения, чем у марганца.
- Наибольшее практическое значение имеют сплавы элемента с углеродом и кремнием. Оба сплава имеют огромное значение для сталелитейной промышленности.
- Многочисленные и разнообразные соединения марганца применяют в химической, текстильной, стекольной промышленности, при производстве удобрений и так далее. Основой такого разнообразия служит химическая активность вещества.
Недостатки металла связаны с особенностями его строения, не позволяющими использовать сам металл в качестве конструкционного материала.
- Главный из них – хрупкость при высокой твердости. Mn до +707 С кристаллизируется в структуре, где ячейка включает 58 атомов.
- Довольно высокая температура кипения, работать с металлом со столь высокими показателями тяжело.
- Электропроводность марганца очень низкая, так что применение его в электротехнике тоже ограничено.
Про химические и физические свойства марганца поговорим далее.
Свойства и характеристики
Физические характеристики металла заметно зависят от температуры. Учитывая наличие целых 4 модификаций это неудивительно.
Основные характеристики вещества таковы:
- плотность – при нормальной температуре составляет 7,45 г/куб. см. Именно эта величина слабо зависит от температуры: так, при нагревании до 600 С плотность уменьшается только на 7%;
- температура плавления – 1244 С;
- температура кипения – 2095 С;
- теплопроводность при 25 С составляет 66,57 Вт/(м·К), что для металла является низким показателем;
- удельная теплоемкость – 0,478 кДж/(кг·К);
- коэффициент линейного расширения, измеренный при 20 С, равен 22,3·10 -6 град -1 — ; Теплоемкость и теплопроводность вещества увеличиваются линейно при увеличении температуры;
- удельное электрическое сопротивление – 1,5– 2,6 мком·м , лишь немногим выше, чем у свинца.
Структура и состав марганца описаны ниже.
Марганец и его соединения — тема видеоролика ниже:
Структура и состав
Описаны 4 структурные модификации вещества, каждая из которых устойчива в определенном температурном интервале. Сплавление с определенными металлами может стабилизировать любую фазу.
- До 707 С устойчивой является а-модификация. – кубическая объемно-центрированная решетка, в состав элементарной ячейки которой входит 58 атомов. Такая структура очень сложна и обуславливает высокую хрупкость вещества. Его показатели – теплоемкость, теплопроводность, плотность, приводятся как свойства вещества.
- При 700–1079 С устойчивой является b-фаза с таким же типом решетки, но с более простым строением: ячейку составляет 20 атомов. В этой фазе марганец проявляет определенную пластичность. Плотность b-модификации – 7,26 г/куб. см. Фазу легко зафиксировать – закалкой вещества при температуре выше температуры фазового перехода.
- При температурах от 1079 С до 1143 С g-фаза стабильна. Для нее характерна кубическая гранецентрированная решетка с ячейкой из 4 атомов. Модификация отличается пластичностью. Однако зафиксировать фазу полностью при охлаждении не удается. При температуре перехода плотность металла составляет 6,37 г/куб. см, при нормальной – 7, 21 г/куб. см.
- Выше температуры 1143 С и до кипения стабилизируется d-фаза с объемно-центрированной кубической решеткой, ячейка которой включает 2 атома. Плотность модификации составляет 6,28 г/куб. см. Интересно то, что d-Mn может перейти в антиферромагнитное состояние при высокой температуре – 303 С.
Фазовые переходы имеют большое значение при получении разнообразных сплавов, тем более что физические характеристики структурных модификаций отличаются.
Производство марганца описано ниже.
Производство
 В основном марганец сопровождает железо в его рудах, но встречаются и самостоятельные месторождения. Так, на территории чиатурского месторождения сконцентрировано до 40% мирового запаса марганцевых руд.
В основном марганец сопровождает железо в его рудах, но встречаются и самостоятельные месторождения. Так, на территории чиатурского месторождения сконцентрировано до 40% мирового запаса марганцевых руд.Элемент рассеян едва ли не во всех горных породах, легко вымывается. Содержание его в морской воде невелико, но на дне океанов он формирует вместе с железом конкреции, в которых содержания элемента достигает 45%. Эти залежи считают перспективными для дальнейшего разрабатывания.
Самые известные минералы: пиролюзит, магнитит, браунит, марганцевый шпат и так далее. Содержание элемента в них варьируется от 62 до 69%. Добываются карьерным или шахтным способом. Как правило, руда предварительно обогащается.
Получение марганца напрямую связано с его применением. Главный его потребитель – сталелитейная промышленность, а для ее нужд требуется не сам металл, а его соединение с железом – ферромарганец. Поэтому говоря о получении марганца, зачастую имеют в виду соединение, необходимое в черной металлургии.
Ранее ферромарганец производился в доменных печах. Но из-за дефицита кокса и необходимости использовать бедные марганцовые руды производители перешли к выплавке в электропечах.
Для плавки используются открытые и закрытые печи, футерованные углем – таким образом получают углеродистый ферромарганец. Плавку производят при напряжении в 110–160 В, двумя методами – флюсовым и бесфлюсовым. Второй метод более экономичен, так как позволяет полнее извлечь элемент, однако при большом содержании кремнезема в руде, возможен только флюсовый способ.
- Бесфлюсовый метод – непрерывный процесс. Шихта из марганцевой руды, кокса и железной стружки загружается по мере переплавления. Важно следить за достаточным количеством восстановителя. Ферромарганец и шлак выпускаются одновременно 5–6 раз за смену.
- Силикомарганец производят сходным методом в электроплавильной печи. Шихта, кроме руды включает марганцевый шлак – без фосфора, кварцит и коксик.
- Металлический марганец получают аналогично выплавке ферромарганца. Сырьем служат отходы от разливки и разделки сплава. После расплавления сплава и шихты добавляют силикомарганец, а за 30 минут до окончания плавки продувают сжатым воздухом.
- Химически чистое вещество получают электролизом.
Применение
90% мировой добычи марганца уходит на нужды сталелитейной промышленности. Причем большинство металлов требуется не для получения собственно марганцевых сплавов, а для производства чугуна и стали как таковых.
- Свойства стали сильно зависит от тех или иных примесей, но если легирующие элементы вводятся специально для улучшения свойств сплава, то примеси кислорода и серы являются нежелательными. Ферромарганец и есть то соединение, которое участвует при выплавке стали и чугуна в качестве раскислителя и десульфатора. Во время плавки марганец связывает кислород и серу, тем самым уменьшая в готовом изделии их содержание.
- Кроме того, марганец сам по себе используется в качестве легирующего элемента. Так, нержавеющая сталь помимо хрома и никеля включает 1% элемента. Более того, он может полностью заместить никель, если повысить его содержание до 4–16%. Дело в том, что марганец как и никель стабилизирует в стали фазу аустенита.
- Марганец способен заметно понизить температуру перехода аустенита в феррит, что предупреждает осаждение карбида железа. Таким образом готовый продукт приобретает большую жесткость и прочность.
- Элемент марганец применяют для получения стойких к коррозии алюминиевых сплавов – от 1 %. Такой материал применяется в пищеобрабатывающей промышленности при изготовлении самой разной тары. Сплавы металла с медью – марганцовистая бронза, используются при изготовлении морских винтов, подшипников, шестерней и других деталей, контактирующих с морской водой.
- Соединения его очень широко используются в неметаллургической промышленности – в медицине, в сельском хозяйстве, на химических производствах.
Марганец – металл, который интересен не столько сам по себе, сколько свойствами своих многочисленных соединений. Однако переоценить его значение в качестве легирующего элемента сложно.
Реакция оксида марганца с алюминием продемонстрирована в этом видео:
Марганец: сплавы, свойства, распространение

Марганец – химический элемент с атомной массой 54,9380 и атомным номером 25, серебристо-белого оттенка, с большой массой, в природе существует в виде стабильного изотопа 35 Мn. Первые упоминания о металле записал древнеримский ученый Плиний, называл его «черным камнем». В те времена марганец использовался в качестве осветлителя стекла, во время процесса варки в расплав добавлялся пиролюзит марганца МnО2.
В Грузии издавна пиролюзит марганца использовался как присадка во время получения железа, назывался черной магнезией и считался одной из разновидностей магнетита (магнитного железняка). Лишь в 1774 году шведским ученым Шееле было доказано, что это соединение неизвестного науке металла, а через несколько лет Ю. Ган во время нагревания смеси угля и пиролюзита получил первый марганец, загрязненный атомами углерода.

Природное распространение марганца
В природе химический элемент марганец малораспространен, в земной коре его содержится всего 0,1%, в вулканической лаве 0,06–0,2%, металл на поверхности в рассеянном состоянии, имеет форму Мn 2+ . На поверхности земли под воздействием кислорода быстро образуются окислы марганца, имеют распространение минералы Мn 3+ и Мn 4+ , в биосфере металл малоподвижен в окислительной среде. Марганец – химический элемент, активно мигрирует при наличии восстановительных условий, металл очень подвижен в кислых природных водоемах тундры и лесных ландшафтах, где преобладает окислительная среда. По этой причине культурные растения имеют избыточное содержание металла, в почвах образуются железомарганцевые конкреции, болотные и озерные низкопроцентные руды.
В регионах с сухим климатом преобладает щелочная окислительная среда, что ограничивает подвижность металла. В культурных растениях ощущается недостаток марганца, сельхозпроизводство не может обходиться без использования специальных комплексных микродобавок. В реках химический элемент малораспространен, но суммарный вынос может достигать больших величин. Особенно много марганца имеется в прибрежных зонах в виде естественных осадков. На дне океанов встречаются большие залежи металла, которые образовались в давние геологические периоды, когда дно было сушей.
Химические свойства марганца
Марганец относится к категории активных металлов, при повышенных температурах активно вступает в реакции с неметаллами: азотом, кислородом, серой, фосфором и другими. В результате образуются разновалентные окислы марганца. При комнатной температуре марганец химический элемент малоактивен, при растворении в кислотах образует двухвалентные соли. При нагреве в вакууме до высоких температур химический элемент способен испаряться даже из устойчивых сплавов. Соединения марганца во многом схожи с соединениями железа, кобальта и никеля, находящихся в такой же степени окисления.
Наблюдается большое сходство марганца с хромом, подгруппа металла также имеет повышенную устойчивость при высших степенях окисления при увеличении порядкового номера элемента. Перенаты являются менее сильными окислителями, чем перманганаты.
Исходя из состава соединений марганца (II) допускается образование металла с более высокими степенями окисления, такие превращения могут происходить как в растворах, так и в расплавах солей.
Стабилизация степеней окисления марганца Существование большого числа степеней окисления у марганца химического элемента объясняется тем, что в переходных элементах во время образования связей с d-орбиталями их энергетические уровни расщепляются при тетраэдрическом, октаэдрическом и квадратном размещении лигандов. Ниже приводится таблица известных в настоящее время степеней окисления некоторых металлов в первом переходном периоде.Обращают на себя внимание низкие степени окисления, которые встречаются в большом ряде комплексов. В таблице есть перечень соединений, в которых лигандами являются химически нейтральные молекулы CO, NO и другие.
За счет комплексообразования стабилизируются высокие степени окисления марганца, самыми подходящими для этого лигандами является кислород и фтор. Если принимать во внимание, что стабилизирующее координационное число равняется шести, то максимальная стабилизация равняется пяти. Если марганец химический элемент образует оксокомплексы, то могут стабилизироваться более высокие степени окисления.
Фторо- и оксокомплексы
Стабилизация марганца в низших степенях окисления
Теория мягких и жестких кислот и оснований дает возможность объяснить стабилизацию разных степеней окисления металлов за счет комплексообразования при воздействии с лигандами. Элементы мягкого типа успешно стабилизируют невысокие степени окисления металла, а жесткие положительно стабилизируют высокие степени окисления.
Теория полностью объясняет связи металл-металл, формально эти связи рассматриваются как кислотно-основное взаимное воздействие.
Сплавы марганца Активные химические свойства марганца позволяют ему образовывать сплавы со многими металлами, при этом большое количество металлов может растворяться в отдельных модификациях марганца и стабилизировать его. Медь, железо, кобальт, никель и некоторые другие металлы способны стабилизировать γ-модификацию, алюминий и серебро способны расширять β- и σ-области магния в двойных сплавах. Эти характеристики играют важную роль металлургии. Марганец химический элемент позволяет получать сплавы и высокими значениями пластичности, они поддаются штамповке, ковке и прокату.
В химических соединениях валентность марганца изменяется в пределах 2–7, увеличение степени окисления становится причиной возрастания окислительных и кислотных характеристик марганца. Все соединения Mn(+2) относятся к восстановителям. Оксид марганца имеет восстановительные свойства, серо-зеленого цвета, в воде и щелочах не растворяется, зато отлично растворяется в кислотах. Гидроксид марганца Mn(OH)3 в воде не растворяется, по цвету белое вещество. Образование Mn(+4) может быть и окислителем (а), и восстановителем (б).
Эта реакция используется при необходимости получения в лабораторных условиях хлора.
Реакция протекает при сплавлении металлов. MnO2 (оксид марганца) имеет бурый цвет, соответствующий гидроксид по цвету несколько темнее.
Физические свойства марганца Марганец – химический элемент с плотностью 7,2–7,4 г/см 3 , t° плавления +1245°С, закипает при температуре +1250°С. Металлу присущи четыре полиморфные модификации:- α-Мn. Имеет кубическую объемно-центрированную решетку, в одной элементарной ячейке располагается 58 атомов.
- β-Мn. Имеет кубическую объемно-центрированную решетку, в одной элементарной ячейке располагается 20 атомов.
- γ-Мn. Имеет тетрагональную решетку, в одной ячейке 4 атома.
- δ-Mn. Имеет кубическую объемно-центрированную решетку.
Температуры превращений марганца: α=β при t°+705°С; β=γ при t°+1090°С; γ=δ при t°+1133С. Наиболее хрупкая модификация α, в металлургии используется редко. Самыми значительными показателями пластичности отличается модификация γ, она чаще всего используется в металлургии. β-модификация частично пластична, промышленность ее применяет редко. Атомный радиус марганца химического элемента составляет 1,3 А, ионные радиусы в зависимости от валентности колеблются в пределах 0,46–0,91. Марганец парамагнитен, коэффициенты теплового расширения 22,3×10 -6 град -1 . Физические свойства могут немного корректироваться в зависимости от чистоты металла и его фактической валентности.
Способ получения марганца Современная промышленность получает марганец по методу, разработанному электрохимиком В. И. Агладзе путем электрогидролиза водных растворов металла при добавлении (NH4)2SO4, во время процесса кислотность раствора должна быть в пределах рН = 8,0–8,5. В раствор погружаются свинцовые аноды и катоды из сплава на основе титана АТ-3, допускается замена титановых катодов нержавеющими. Промышленность использует порошок марганца, который после окончания процесса снимается с катодов, металл оседает в виде чешуек. Способ получения считается энергетически затратным, это оказывает прямое влияние на увеличение себестоимости. При необходимости собранный марганец в дальнейшем переплавляется, что позволяет облегчить его применение в металлургии.Марганец – химический элемент, который можно получать и галогенным процессом за счет хлорирования руды и дальнейшим восстановлением образовавшихся галогенидов. Такая технология обеспечивает промышленность марганцем с количеством посторонних технологических примесей не более 0,1%. Более загрязненный металл получают при протекании алюмотермической реакции:
Или электротермией. Для удаления вредных выбросов в производственных цехах монтируется мощная принудительная вентиляция: воздуховоды из ПВХ, вентиляторы центробежного принципа действия. Кратность обмена воздуха регламентируется нормативными положениями и должна обеспечивать безопасное пребывание людей в рабочих зонах.
Использование марганца Главный потребитель марганца – черная металлургия. Широкое использование металл имеет и в фармацевтической промышленности. На одну тонну выплавляемой стали необходимо 8–9 килограмм, перед введением в сплав марганца химического элемента его предварительно сплавляют с железом для получения ферромарганца. В сплаве доля марганца химического элемента составляет до 80%, углерода до 7%, остальное количество занимает железо и различные технологические примеси. За счет использования добавок значительно повышаются физико-механические характеристики сталей, выплавляемых в доменных печах. Технология пригодна и для использования добавок в современных электрических сталелитейных печах. За счет добавок высокоуглеродистого ферромарганца происходит раскисление и десульфарация стали. При добавке средне- и малоуглеродистых ферромарганцев металлургия получает легированные стали.Низколегированная сталь имеет в составе 0,9–1,6% марганца, высоколегированная до 15%. Высокими показателями физической прочности и антикоррозионной устойчивости обладает сталь с содержанием 15% марганца и 14% хрома. Металл износоустойчив, может работать в жестких температурных условиях, не боится прямого контакта с агрессивными химическими соединениями. Такие высокие характеристики позволяют использовать сталь для изготовления наиболее ответственных конструкций и промышленных агрегатов, работающих в сложных условиях.
Марганец – химический элемент, применяемый и во время выплавки сплавов на безжелезной основе. Во время производства высокооборотных лопаток промышленных турбин используется сплав меди с марганцем, для пропеллеров применяются бронзы с содержанием марганца. Кроме этих сплавов, марганец как химический элемент присутствует в алюминиевых и магниевых. Он намного улучшает эксплуатационные характеристики цветных сплавов, делает их хорошо деформируемыми, не боящимися коррозионных процессов и износостойкими.
Легированные стали являются основным материалом для тяжелой промышленности, незаменимы во время производства различных типов вооружений. Широко применяются в кораблестроении и самолетостроении. Наличие стратегического запаса марганца – условие высокой обороноспособности любого государства. В связи с этим добыча металла ежегодно увеличивается. Кроме того, марганец – химический элемент, применяемый во время производства стекла, в сельском хозяйстве, полиграфии и т. д.
Марганец в флоре и фауне
В живой природе марганец – химический элемент, играющий важную роль в развитии. Он влияет на характеристики роста, состав крови, интенсивность процесса фотосинтеза. В растениях его количество составляет десятитысячные доли процента, а в животных стотысячные доли процента. Но даже такое незначительное содержание оказывает заметное влияние на большинство их функций. Он активирует воздействие ферментов, влияет на функцию инсулина, минеральный и кроветворный обмен. Недостаток марганца становится причиной появления различных болезней как острых, так и хронических.
Марганец – химический элемент, широко используемый в медицине. Недостаток марганца понижает физическую выносливость, становится причиной некоторых видов анемий, нарушает обменные процессы в костных тканях. Широко известны дезинфицирующие характеристики марганца, его растворы используются во время обработки некрозных тканей.
Недостаточное количество марганца в пище животных становится причиной снижения ежесуточного привеса. Для растений такая ситуация становится причиной пятнистости, ожогов, хлорозов и других заболеваний. При обнаружении признаков отравления назначается специальная медикаментозная терапия. Сильное отравление может становиться причиной появления синдрома марганцевого паркинсонизма – трудноизлечимой болезни, оказывающей негативное влияние на центральную нервную систему человека.
Суточная потребность марганца составляет до 8 мг, главное количество человек получает с пищей. При этом рацион должен быть сбалансированным по всем питательным веществам. При увеличенной нагрузке и недостаточном количестве солнечного света доза марганца корректируется на основании общего анализа крови. Значительное количество марганца содержится в грибах, водяных орехах, ряске, моллюсках и ракообразных. Содержание марганца в них может достигать нескольких десятых процента.
При попадании марганца в организм в чрезмерных дозах могут возникать болезни мышечных и костных тканей, поражаются дыхательные пути, страдает печень и селезенка. Для выведения марганца из организма требуется много времени, за этот период токсические характеристики увеличиваются с эффектом накапливания. Допустимая санитарными органами концентрация марганца в воздушной среде должна быть ≤ 0,3 мг/м 3 , контроль параметров выполняется в специальных лабораториях путем отбора воздуха. Алгоритм отбора регулируется государственными нормативными актами.
Марганец -общая характеристика элемента, химические свойства хрома и его соединений
Марганец — элемент 4-го периода и VII B-группы Периодической системы, порядковый номер 25. Электронная формула атома [18Аr]Зd 5 4s 2 ; характерные степени окисления + VII,+ VI, +IV, +III, +II и 0.
Шкала степеней окисления марганца:
По электроотрицательности (1,60) марганец занимает промежуточное положение между типичными металлами (Na, К, Са, Мg) и неметаллами (F, O,N, Cl). Соединения Мn ‖‖ — оксид и гидроксид — проявляют основные свойства, соединения Мn ‖‖‖ и Мn IV — амфотерные свойства, для соединений Мn VI и Мn VII характерно почти полное преобладание кислотных свойств. Марганец образует многочисленные соли и бинарные соединения.
В природе — четырнадцатый по химической распространенности элемент (восьмой среди металлов; второй, после железа, тяжелый металл).
Марганец Мn. Серебристо-белый (с серым оттенком) металл, более твердый и хрупкий по сравнению с железом. В виде мелкого порошка пирофорен. На воздухе покрывается оксидной пленкой. Пассивируется в воде, поглощает водород, но не реагирует с ним.
При нагревании сгорает в кислороде воздуха, реагирует с хлором и серой:
Mn+Cl2→MnCl2 , (200 o C) Mn+S→ MnS (до1580 o C)
В ряду напряжений марганец стоит левее водорода, из разбавленных кислот НCl и Н2SO4 вытесняет водород:
Взаимодействует с кислотами-окислителями при нагревании, также образуя соли марганца (II):
Получение марганца в промышленности — восстановление пиролюзита МnO2 или гаусманита (Мn II Mn II I )O4 коксом или алюминием:
Наиболее чистый марганец выделяют электролизом раствора из солей марганца (П), например:
Промышленно важен сплав с железом — ферромарганец (> 70 % Мn), его получают восстановлением оксидных руд марганца и железа.
Применяется марганец для изготовления специальных и тугоплавких сплавов, зеркального чугуна и марганцевых твердых сталей, в качестве катализатора в органическом синтезе.
Оксид марганца (IV) МnO2. Черный, с коричневым оттенком, при нагревании разлагается. Из раствора осаждается в виде черного гидрата МnO2 nН2O. Не проявляет амфотерных свойств в силу малой реакционной способности по отношению к воде, разбавленным кислотам НCl и Н2SO4, азотной кислоте и щелочам в растворе. Типичный окислитель в растворе и расплаве, менее характерны свойства восстановителя.
Применяется для промышленного производства марганца, как деполяризатор в «батарейках» (сухих гальванических элементах), компонент минеральных пигментов, осветлитель стекла.
Уравнения важнейших реакций:
В природе самое распространенное соединение марганца — минерал пиролюзит
Манганат калия К2MnO4. Оксосоль. Темно-зеленый, плавится под избыточным давлением О2. В растворе устойчив только в сильнощелочной среде. Зеленая окраска раствора отвечает иону МnO4 2- . Медленно разлагается при разбавлении раствора водой, быстро — при подкислении. Проявляет окислительно-восстановительные свойства.
Качественная реакция — появление фиолетовой окраски при подкислении раствора. Промежуточный продукт при синтезе КMnO4.
Уравнения важнейших реакций:
Получение: сплавление МnO2 с сильными окислителями (KNO3, КClO3).
Перманганат калия КМnO4. Оксосоль. Красно-фиолетовый (почти черный). При нагревании разлагается без плавления. Умеренно растворим в воде (интенсивно-фиолетовая окраска раствора отвечает иону МnO4), гидролиза нет. Медленно разлагается в воде, серной кислоте, щелочах. Сильный окислитель в растворе и при сплавлении; в сильнокислотной среде восстанавливается до Мn II , в нейтральной среде – до Mn IV в сильнощелочной среде — до Мn VI

Качественная реакция на ион МnO4 — исчезновение фиолетовой окраски раствора при восстановлении в кислотной среде.
Применяется как окислитель углеводородов до карбоновых кислот, реактив в фотографии, антисептик в медицине, средство для очистки газов и отбеливания тканей, твердый источник кислорода. Распространенный окислитель в лабораторной практике. Уравнения важнейших реакций:
МnO4 — + 8Н + + 5Fе 2+ = Мn 2+ + 5Fе 3+ + 4Н2O
Что такое марганец? Свойства марганца. Применение марганца
Что такое марганец?
Марганец – элемент таблицы Менделеева . Принадлежит VII группе. Расположен в четвертом периоде между хромом и железом. Имеет 25-й атомный номер. Формула марганца [Ar] 3d 5 4s 2 .

Был открыт в 1774 году. Атом марганца весит 54,938045. Содержит изотоп 55Mn, а природный марганец состоит полностью из него. Степень окисления металла колеблется от 2 до 7. Электроотрицательность Mn — 1,55. Переходный материал.
Соединения марганец 2 образуют оксид и диоксид. Проявляют основные свойства элемента. Образования марганец 3 и марганец 4 отличаются амфотерными свойствами. В комбинациях металла 6 и 7 лидируют свойства кислоты марганца. Элемент № 25 образует многочисленные виды солей и различные бинарные соединения.
Добыча марганца ведется повсеместно как в России, так и в ближнем зарубежье. На Украине существует особый Марганец – город, расположенный на многочисленных образованиях марганцевой руды.
Описание и свойства марганца
Серебристо-белый цвет с легким серым налетом выделяет марганец. Состав элемента имеет примесь углерода, которая дает ему серебристо-белый цвет. Он превосходит железо по твердости и хрупкости. В виде мелких абразивов пирофорен.

При взаимодействии с воздушной средой происходит окисление марганца. Покрывается оксидной пленкой, защищающей его от последующей окислительной реакции.
Растворяется в воде, полностью поглощает водород, не вступая в реакцию с ним. В процессе нагревания сгорает в кислороде. Активно реагирует с хлором и серой. При взаимодействии с кислотными окислителями образует соли марганца.
Плотность — 7200 кг/м3, t плавления — 1247°С, t кипения — 2150 °С. Удельная теплоемкость — 0,478 кДж. Обладает электрической проводимостью. Контактируя с хлором, бромом и йодом образует дигалогениды.

При высоких температурах вступает во взаимодействие с азотом, фосфором, кремнием и бором. Медленно взаимодействует с холодной водой. В процессе нагревания реакционная способность элемента возрастает. На выходе образуется Mn(OH)2 и водород. При соединении марганца с кислородом образуется оксид марганца. Выделяют семь его групп:
Оксид марганца (II). Монооксид. Не взаимодействует с водой. Легко окисляется, образуя хрупкую корку. При нагревании с водородом и металлами активной группы восстанавливается до марганца. Имеет зеленый и серо-зеленый цвет кристаллов. Полупроводник.
Оксид марганца (II,III). Кристаллы коричневого – черного цвета Mn3O4. Парамагнетик. В естественной среде встречается как минерал гаусманит.
Оксид марганца (II,IV). Соединение неорганического характера Mn5O8. Может рассматриваться как ортоманганит марганца. Не растворяется в H2O.

Оксид марганца (III).Кристаллы коричневого – черного цвета Mn2O3. Не вступают в реакцию с водой. Встречается в природной среде в минералах браунит, курнакит и биксбиит.
Оксид марганца (IV) или диоксид марганца MnO2. Нерастворимый в воде порошок темно-коричневого оттенка. Устойчивое образование марганца. Содержится в минерале пиролюзит. Поглощает хлор и соли тяжелых металлов.
Оксид марганца (VI) . Темно-красный аморфный элемент. Вступает в реакцию с водой. Полностью разлагается при нагревании. Щелочные реакции образуют солевые отложения.
Оксид марганца (VII). Маслянистая зеленовато-бурая жидкость Mn2O7. Сильный окислитель. При контакте с горючими смесями, мгновенно воспламеняет их. Может взорваться от толчка, резкой и яркой вспышки света, взаимодействия с органическими компонентами. При взаимодействии с Н2O образует марганцовую кислоту.

Соли марганца являются катализаторами окислительных процессов, происходящих с участием кислорода. Они применяются в сиккативах. Льняное масло с добавлением такого сиккатива именуется олифой.
Применение марганца
Mn широко используют в черной металлургии. Добавляют сплав железо марганец (ферромарганец). Доля марганца в нем равна 70-80%, углерода 0,5-7 %, остальная часть приходится на железо и посторонние примеси. Элемент №25 в сталеплавлении соединяет кислород и серу.
Используются смеси хром — марганец, вольфрам -марганец, кремний-марганец. В производстве стали марганцу альтернативной замены нет.
Химический элемент выполняет множество функций, в том числе рафинирует и раскисляет сталь. Широко используется технология цинк марганец. Растворимость Zn в магнии составляет 2 %, а прочность стали, в этом случае, возрастает до 40 %.
В доменной шахте марганец удаляет серный налет из чугуна. В технике применяются тройные сплавы манганины, куда входит марганец медь и никель. Материал характеризуется большим электро-сопротивлением на которое влияет не температура, а сила давления.

Используется для изготовления манометров. Настоящей ценностью для промышленности является сплав медь — марганец. Содержание марганца здесь 70 %, меди 30%. Его применяют для снижения вредных производственных шумов. В изготовлении взрыв-пакетов для праздничных мероприятий используют смесь, куда входят такие элементы, как магний марганец. Магний широко используется в самолетостроении.
Некоторые виды солей марганца, такие как KMnO4 нашли свое применение в медицинской отрасли. Перманганат калия относится к солям марганцовой кислоты. Имеет вид темно-фиолетовых кристаллов . Растворяется в водной среде, окрашивая её в фиолетовый цвет.
Является сильным окислителем. Антисептик, обладает противомикробными свойствами. Марганец в воде легко окисляется, образуя плохо растворимый оксид марганца коричневого цвета.
При соприкосновении с белком ткани формирует соединения с выраженными вяжущими качествами. В высоких концентрациях раствор марганца обладает раздражающим и прижигающим действием.
Калий марганец используют для лечения некоторых заболеваний и для оказания первой помощи, а пузырек с кристаллами марганцовки находится в каждой аптечки.

Марганец полезен для человеческого здоровья. Участвует в формировании и развитии клеток центрально-нервной системы. Способствует усвоению витамина В1, меди и железа. Регулирует содержание сахара в крови. Задействуется в строительстве костной ткани.
Участвует в образовании жирных кислот. Улучшает рефлекторные способности, память, убирает нервное напряжение, раздражительность. Абсорбируясь в стенках кишечника марганец, витамины В, Е, фосфор, кальций усиливают этот процесс, влияет на организм и обменные процессы в целом.
Минералы, незаменимые для человека, такие как кальций, магний, марганец, медь, калий, железо добавляют в витаминно-минеральные комплексы для устранения витаминного дефицита.
Также микроэлементы цинк, марганец и железо играют огромную роль в жизни растений. Входят в состав фосфорных и минеральных удобрений.
Цена марганца
Металлический марганец содержит до 95 % чистого марганца. Его применяют в сталелитейной металлургической промышленности. Удаляет из стали ненужные примеси и наделяет её легирующими качествами.
Ферромарганец используется для раскисления сплава во время процесса плавления, путем удаления из него кислорода. Связывает частицы серы между собой, улучшая качественные характеристики стали. Марганец упрочняет материал, делает его более износостойким.
Применяют металл при создании шаровых мельниц, землеройных и камнедробильных машин, броневых элементов. Из сплава мангадин изготавливают реостаты. Элемент № 25 добавляют в бронзу и латунь .

Большой процент диоксида марганца потребляется для создания гальванических элементов. Сплав с добавлением Mn задействуется в тонком органическом и промышленном синтезе. Соединения MnO2 и KMnO4 выступают окислителями.
Марганец – вещество незаменимое в черной металлургии. Уникален по своим физическим и химическим характеристикам. Марганец купить можно в специализированных торговых точках. Пять килограмм металла стоит порядка 150 рублей, а тонна, в зависимости вида соединения, стоит около 100-200 тысяч рублей.
Сферы применения металла и химические свойства марганца.

Химические свойства марганца определяют широкое использование его в качестве сырья для промышленного производства сплавов высокого качества. Соединения элемента применяются в медицине, сельском хозяйстве.
Физические и химические свойства металла
- Впервые химический элемент был обнаружен шведскими химиками в железной руде. Его извлекли путем нагревания смеси рудного материала с углем. В результате был извлечен металлический компонент, получивший свое название от немецкого слова, обозначающего «марганцевая руда».
- Химический элемент относится к ряду переходных и может образовывать соединения, содержащие атомы в степени окисления 0. При нагревании проявляет свойство вытеснять водород, разлагая воду.
- В природе этот хрупкий металл, отличающийся серебристым цветом, встречается только в соединениях. Его извлекают из рудного сырья, среди которого наиболее распространены такие виды:пиролюзит,манганит, псиломелан, браунит.
- Металл находится в марганцевых конкрециях, находящихся на дне океанов. Технология извлечения их со дна связана с использованием специального оборудования и не имеет промышленного характера.
- Марганец легко образует оксиды в результате окисления на воздухе. В зависимости от изменения температурного градиента при нагревании он реагирует с азотом, серой, кремнием. При поглощении водорода марганец образовывает твердые растворы.
- Его трудно растворить в воде при обычной комнатной температуре. В концентрированных кислотах он растворяется при нагревании, образовывая соли.
- Химический элемент № 25 отличается активностью в процессе реакций восстановления металлов из оксидов. Он вытесняет металлы, образовывая соединение с кислородом.
Технология извлечения химического элемента
Основными производителями и поставщиками металла на мировой рынок являются Бразилия, Австралия, ЮАР и Украина. Именно в этих странах находятся запасы руды, составляющие почти 73% мировых.
Получение черного металла в промышленных масштабах начинается с извлечения руд и их обогащения и зависит от соединений металла с другими элементами. Например, обычная карбонатная руда подвергается предварительному обжигу. В отдельных случаях ее выщелачивают с использованием серной кислоты с последующим термическим восстановлением с помощью кокса. Иногда для восстановления металла используется алюминий или кремний.

Чистый металл извлекают электролизом из водных растворов сульфата марганца.
Применение марганца в промышленном производстве
- Основная часть металла используется для нужд черной металлургии в качестве добавки, а в мировых масштабах его потребление находится на 4 месте после основного сырья: железа, алюминия и меди. Марганец является обязательным элементом, присутствующим во всех видах чугуна и стали. Уникальное свойство марганца образовывать сплавы с большинством металлов используется для изготовления:
- разных сортов марганцевой стали;
- манганитов (сплав, в котором отсутствует железо).

Другие сферы применения металла
Свойства химического элемента и его соединений используются в промышленном производстве:
- в качестве катализатора органических реакций;
- для разложения неорганических солей;
- для производства стекла;
- при покрытии металлических поверхностей;
- в керамической отрасли для окрашивания глазури и эмали
- для адсорбции вредных веществ;
- для отбеливания натуральных материалов (лен, шерсть).
Отходы, полученные в результате обработки металлического сырья с участием марганца, применяются в сельском хозяйстве для обогащения почвы под культуры ценным компонентом.
Химии этого элемента принадлежит важная роль в медицине.
Соли марганца применяют для образования антисептического водного раствора, чтобы промывать раны, обрабатывать ожоги.Химический элемент № 25 необходим для нормальной деятельности организма, регулирования уровня глюкозы в крови, профилактики заболевания сахарным диабетом, обеспечения нормальной работы поджелудочной железы.
Недостаток марганца в организме человека может спровоцировать заболевание. Суточная потребность человека в важном микроэлементе составляет почти 10 мг. Его источниками для организма являются продукты питания:

Некоторые виды насекомых и растений способны концентрировать этот химический элемент, обеспечивающий активацию ферментов, участвующих в процессе дыхания, фотосинтеза.
Марганец (Mn)
Соединения марганца:
Пиролюзит(минерал марганца) был известен людям еще с древних времен, он использовался нашими предками для осветления стекла, получаемого варкой. До 1774 г. пиролюзит считали разновидностью магнитного железняка. И только в 1774 г. швед К. Шееле догадался, что в пиролюзите присутствует неизвестный тогдашней науке металл, после чего Ю. Ган получил металлический марганец, нагревая пиролюзит в печке с углем. Свое название “марганец” получил в начале 19 века (от немецкого Manganerz — марганцевая руда).
Марганец занимает 14-е место среди всех химических элементов по распространенности в земной коре. Больше всего марганца содержится в основных породах. Самостоятельные месторождения марганца крайне редки, чаще этот металл сопутствует железу во многих его рудах. Достаточно много марганца содержится в железо-марганцевых конкрециях, расположенных в донной части Мирового океана.
Минералы, богатые марганцем:
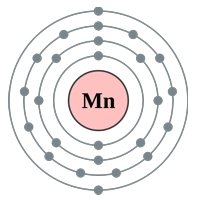
Рис. Строение атома марганца.Электронная конфигурация атома марганца – 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 (см. Электронная структура атомов). В образовании химических связей с другими элементами могут участвовать 2 электрона, находящихся на внешнем 4s-уровне + 5 электронов 3d-подуровня (всего 7 электронов), поэтому в соединениях марганец может принимать степени окисления от +7 до +1 (наиболее часто встречаются +7, +2). Марганец является химически активным металлом. Аналогично алюминию при комнатной температуре реагирует с кислордом, содержащимся в атмосферном воздухе, с образованием прочной защитной оксидной пленки, которая предотвращает дальнейшее окисление металла.
Физические свойства марганца:
- металл серебристо-белого цвета;
- твердый;
- хрупкий при н. у.
Известны 4 модификации марганца: α-форма; β-форма; γ-форма; δ-форма.
До 710°C устойчивой является α-форма, которая при дальнейшем нагревании последовательно через все модификации переходит к δ-форме (1137°C).
Химические свойства марганца
- марганец (порошок) легко реагирует с кислородом, образуя оксиды, вид которого зависит от температуры реакции:
- 450°C – MnO2;
- 600°C – Mn2O3;
- 950°C – Mn3O4;
- 1300°C – MnO.
Применение и получение марганца
- чистый марганец получают электролизом водных растворов MnSO4 с добавкой (NH4)2SO4 при pH=8-8,5: анод – свинец; катод – нержавеющая сталь (чешуйки марганца снимают с катодов);
- менее чистый марганец получают из его оксидов металлотермическими методами:
- алюмотермия:
4Al + 3MnO2 = 3Mn + 2Al2O3; - кремнийтермия:
Si + MnO2 = Mn + SiO2.
- в металлургии марганец используют для связывания серы и кислорода:
Mn + S = MnS; 2Mn + O2 = 2MnO; - в качестве лигирующей добавки при выплавке различных сплавов (марганец дает коррозоустойчивость, вязкость, твердость):
- манганин – сплав марганца с медью и никелем;
- ферромарганец – сплав марганца с железом;
- марганцевая бронза – сплав марганца с медью.
Биологическая роль марганца:
Марганец входит в десятку “металлов жизни”, необходимых для нормальной жизнедеятельности животных и растительных клеток.
В теле взрослого человека содержится порядка 12 мг марганца, который участвует в образовании белковых комплексов, а также входит в состав некоторых нуклеиновых кислот, аминокислот, ферментов (аргиназы и холинэстеразы).
Марганец наряду с магнием участвует в активации гидролиза АТФ, обеспечивая тем самым энергетическую жизнедеятельность живой клетки.
Ионы марганца участвуют в активации нуклеазы – данный фермент необходим для разложения нуклеиновых кислот до нуклеотидов.
Если вам понравился сайт, будем благодарны за его популяризацию Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Источник http://alluz.ru/the-use-of-ict/kak-vyglyadit-margancovka-margancovka-primenenie-i-mery-predostorozhnosti.html
Источник http://fashion-styl.ru/dobycha-margancevoi-rudy-mestorozhdeniya-marganca-v-mire-torgovlya-margancevoi/
Источник http://v-remonta.ru/stroitelnye-sovety/marganeczpredstavlyaem-osnovnye-hara
- алюмотермия: