Содержание
Что такое обратимая реакция
Что такое обратимая реакция? Это химический процесс, который протекает в двух взаимно обратных направлениях. Рассмотрим основные характеристики подобных превращений, а также их отличительные параметры.
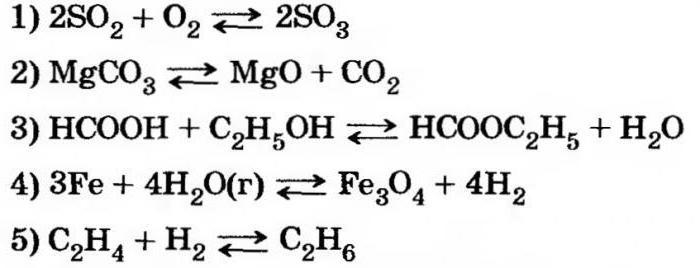
В чем суть равновесия
Обратимые химические реакции не приводят к получению определенных продуктов. Например, при окислении оксида серы (4) одновременно с получением оксида серы (6) снова образуются исходные компоненты.
Необратимые процессы предполагают полное превращение взаимодействующих веществ, сопровождается подобная реакция получением одного или нескольких продуктов реакции.
Примерами взаимодействий необратимого характера являются реакции разложения. Например, при нагревании перманганата калия образуется манганат металла, оксид марганца (4), а также выделяется газообразный кислород.
Обратимая реакция не предполагает образования осадков, выделения газов. Именно в этом и состоит ее основное отличие от необратимого взаимодействия.
Химическое равновесие является таким состоянием взаимодействующей системы, при котором возможно обратимое протекание одной или нескольких химических реакций при условии равенства скоростей процессов.
Если система находится в динамическом равновесии, не происходит изменения температуры, концентрации реагентов, иных параметров в заданный промежуток времени.

Условия смещения равновесия
Равновесие обратимой реакции можно объяснить с помощью правила Ле-Шателье. Его суть заключается в том, что при оказании на систему, изначально находящуюся в динамическом равновесии, внешнего воздействия, наблюдается изменение реакции в сторону, противоположную воздействию. Любая обратимая реакция с помощью данного принципа может быть смещена в нужном направлении в случае изменения температуры, давления, а также концентрации взаимодействующих веществ.
Принцип Ле-Шателье «работает» только для газообразных реагентов, твердые и жидкие вещества не учитываются. Между давлением и объемом существует взаимно обратная зависимость, определенная уравнением Менделеева — Клапейрона. Если объем исходных газообразных компонентов будет больше продуктов реакции, то для изменения равновесия вправо важно повысить давление смеси.
Например, при трансформации оксида углерода (2) в углекислый газ в реакцию вступает 2 моль угарного газа и 1 моль кислорода. При этом образуется 2 моля оксида углерода (4).
Если по условию задачи эта обратимая реакция должна быть смещена вправо, необходимо увеличить давление.
Существенное влияние на протекание процесса оказывает и концентрация реагирующих веществ. Согласно принципу Ле-Шателье, в случае увеличения концентрации исходных компонентов равновесие процесса смещается в сторону продукта их взаимодействия.
При этом понижение (вывод из реакционной смеси) образующегося продукта, способствует протеканию прямого процесса.
Кроме давления, концентрации существенное влияние на протекание обратной либо прямой реакции оказывает и изменение температуры. При нагревании исходной смеси наблюдается смещение равновесия в сторону эндотермического процесса.

Примеры обратимых реакций
Рассмотрим на конкретном процессе способы смещения равновесия в сторону образования продуктов реакции.
Данная реакция является гомогенным процессом, так как все вещества находятся в одном (газообразном) состоянии.
В левой части уравнения есть 3 объема компонентов, после взаимодействия этот показатель снизился, образуется 2 объема. Для протекания прямого процесса необходимо увеличить давление реакционной смеси.
Учитывая, что реакция является экзотермической, для получения углекислого газа температуру понижают.
Равновесие процесса будет смещаться в сторону образования продукта реакции при увеличении концентрации одного из исходных веществ: кислорода или угарного газа.
Заключение
Обратимые и необратимые реакции играют важную роль в жизнедеятельности человека. Обменные процессы, происходящие в нашем организме, связаны с систематическим смещением химического равновесия. В химическом производстве используют оптимальные условия, позволяющие направлять реакцию в нужное русло.
Источник http://www.syl.ru/article/292684/chto-takoe-obratimaya-reaktsiya
Источник
Источник