Содержание
Соединение mn. Биологическая роль марганца. Химические свойства марганца
Этот элемент в виде пиролюзита (диоксид марганца, MnO 2) использовался доисторическими пещерными художниками пещеры Ласко, во Франции, ещё около 30 000 лет назад. В более поздние времена в древнем Египте производители стекла использовали минералы, содержащие этот металл для удаления бледно-зеленоватого оттенка натурального стекла.
Отличные руды были найдены в регионе Магнезия, что в северной Греции, к югу от Македонии, и именно тогда началась путаница с названием. Различные руды из региона, которые включали как магний, так и марганец просто назывались магнезией. В XVII веке термин магнезия альба или белая магнезия была принята для магниевых минералов, в то время как название чёрная магнезия использовалась для более тёмных оксидов марганца.
Кстати, знаменитые магнитные минералы, обнаруженные в этом регионе, были названы камнем магнезии, который, в конце концов, стал сегодняшним магнитом. Путаница продолжалась ещё некоторое время пока в конце XVIII века группа шведских химиков пришла к выводу, что марганец является отдельным элементом. В 1774 году, член группы, представил эти выводы в Стокгольмскую академию, а в том же году Юхан Готлиб Ган, стал первым человеком, который получил чистый марганец и доказал, что это отдельный элемент .
Марганец — химический элемент, характеристики марганца
 Это тяжёлый, серебристо-белый металл, который на открытом воздухе медленно темнеет. Твёрдый, и более хрупкий, чем железо, он имеет удельный вес 7,21 и температуру плавления 1244 °C. Химический символ Mn, атомный вес 54,938, атомный номер 25. В составе формул читается как марганец, например, KMnO 4 — калий марганец о четыре. Это очень распространённый элемент в горных породах, его количество оценивается как 0,085% от массы земной коры.
Это тяжёлый, серебристо-белый металл, который на открытом воздухе медленно темнеет. Твёрдый, и более хрупкий, чем железо, он имеет удельный вес 7,21 и температуру плавления 1244 °C. Химический символ Mn, атомный вес 54,938, атомный номер 25. В составе формул читается как марганец, например, KMnO 4 — калий марганец о четыре. Это очень распространённый элемент в горных породах, его количество оценивается как 0,085% от массы земной коры.
Существует более 300 различных минералов , содержащих этот элемент. Крупные земные месторождения находятся в Австралии, Габоне, Южной Африке, Бразилии и России. Но ещё больше находиться на океанском дне в основном на глубине от 4 до 6 километров, поэтому его добыча там не является коммерчески жизнеспособной.
Минералы окисленного железа (гематит, магнетит, лимонит и сидерит) содержат 30% этого элемента. Другим потенциальным источником являются глина и красные грязевые отложения, в которых есть узелки с содержанием до 25%. Наиболее чистый марганец получают путём электролиза водных растворов.
Марганец и хлор находятся в VII группе периодической таблицы, но хлор — в главной подгруппе, а марганец — в побочной, к которой относятся ещё технеций Тс и рений Ке — полные электронные аналоги. Марганец Мп, технеций Тс и рений Ке — полные электронные аналоги с конфигурацией валентных электронов.
Этот элемент присутствует в небольших количествах и в сельскохозяйственных почвах. Во многих сплавах меди, алюминия, магния, никеля различное его процентное содержание, даёт им конкретные физические и технологические свойства:
- устойчивость к износу;
- теплоустойчивость;
- устойчивость к коррозии;
- плавкость;
- электрическое сопротивление и т. д.
Валентности марганца
Степени окисления марганца от 0 до +7. В двухвалентной степени окисления марганец имеет отчётливо металлический характер и высокую склонность к образованию сложных связей. При четырехвалентном окислении преобладает промежуточный характер между металлическими и неметаллическими свойствами, в то время как шестивалентный и семивалентный обладают неметаллическими свойствами.

Биохимия и фармакология
Марганец является элементом, широко распространённым в природе, он присутствует в большинстве тканей растений и животных. Самые высокие концентрации находятся:
- в апельсиновой корке;
- в винограде;
- в ягодах;
- в спарже;
- в ракообразных;
- в брюхоногих;
- в двустворчатых.
Одни из наиболее важных реакций в биологии, фотосинтезе , полностью зависят от этого элемента. Это звёздный игрок в реакционном центре фотосистемы II, где молекулы воды превращаются в кислород. Без него невозможен фотосинтез .
Он является важным элементом во всех известных живых организмах. Например, фермент, ответственный за превращение молекул воды в кислород во время фотосинтеза, содержит четыре атома марганца.
Средний человеческий организм содержит около 12 миллиграммов этого металла. Мы получаем около 4 миллиграммов каждый день из таких продуктов, как орехи, отруби, злаки, чай и петрушка. Этот элемент делает кости скелета более прочными. Он также важен для усвоения витамина B1.
Польза и вредные свойства
 Этот микроэлемент , имеет большое биологическое значение: он действует в качестве катализатора в биосинтезе порфиринов, а затем гемоглобина у животных и хлорофилла в зелёных растениях. Его присутствие также является необходимым условием для активности различных митохондриальных ферментных систем, некоторых ферментов метаболизма липидов и окислительных процессов фосфорилирования.
Этот микроэлемент , имеет большое биологическое значение: он действует в качестве катализатора в биосинтезе порфиринов, а затем гемоглобина у животных и хлорофилла в зелёных растениях. Его присутствие также является необходимым условием для активности различных митохондриальных ферментных систем, некоторых ферментов метаболизма липидов и окислительных процессов фосфорилирования.
Пары или питьевая вода, загрязнённая солями этого металла, приводит к ирритативным изменениям дыхательных путей, хронической интоксикации с прогрессирующей и необратимой тенденцией, характеризующейся поражением базальных ганглиев центральной нервной системы, а затем нарушению экстрапирамидного типа аналогичного болезни Паркинсона.
Такое отравление часто имеет профессиональный характер. Ему подвержены рабочих занятые на обработке этого металла и его производных, а также работники химической и металлургической промышленности. В медицине, его используют в форме перманганата калия как вяжущее, местное антисептическое средство, а также в качестве антидота ядов природы алкалоидов (морфин, кодеин, атропин и т. д.).
Некоторые почвы имеют низкий уровень этого элемента, поэтому его добавляют к удобрениям и дают в качестве пищевой добавки для пасущихся животных.
Марганец: применение
 В виде чистого металла, за исключением ограниченного использования в области электротехники, этот элемент не имеет других практических применений, в то же время широко используется для приготовления сплавов, производства стали и пр.
В виде чистого металла, за исключением ограниченного использования в области электротехники, этот элемент не имеет других практических применений, в то же время широко используется для приготовления сплавов, производства стали и пр.
Когда Генри Бессемер изобрёл процесс производства стали в 1856 году, его сталь разрушалась из-за горячей прокатки. Проблема была решена в том же году, когда было обнаружено, что добавление небольших количеств этого элемента к расплавленному железу решает эту проблему. Сегодня фактически около 90% всего марганца используется для производства стали.
Получил краску, которая и сейчас называется «зелень Шееле», арсин (AsH 3), глицерин, мочевую и синильную кислоты. Правда, ни марганец, ни молибден, ни вольфрам Шееле не выделил в чистом виде; он только указал, что в исследованных им минералах содержатся эти новые элементы.
Элемент № 25 был обнаружен в минерале пиролюзите MnO 2 -H 2 O, известном еще Плинню Старшему. Плиний считал его разновидностью магнитного железняка, хотя пиролюзит не притягивается магнитом. Этому противоречию Плиний дал объяснение. Нам оно кажется забавным, но не нужно забывать, что в I в. н.э. ученые знали о веществах много меньше, чем нынешние школьники. Но Плинию, пиролюзит — это «ляпис магнес» (магнитный железняк), только он женского пола, и именно поэтому магнит к нему «равнодушен». Тем не менее «черную магнезию» (так тогда называли пиролюзит) стали использовать при варке стекла, поскольку она обладает замечательным свойством осветлять стекло. Это происходит оттого, что при высокой температуре двуокись марганца отдает часть своего кислорода и превращается в окисел состава Mn 2 O 3 . Освободившийся кислород окисляет сернистые соединения железа , придающие стеклу темную окраску. Как «осветлитель» стекла пиролюзит применяют и сейчас.
История марганца
В рукописях знаменитого алхимика Альберта Великого (XIII в.) этот минерал называется «магнезия». В XVI в. встречается уже название «манганезе», которое, возможно, дано стеклоделами и происходит от слова «манганидзейн» — чистить.
Когда Шееле в 1774 г. занимался исследованием пиролюзита, он посылал своему другу Юхану Готлибу Гану образцы этого минерала. Ган, впоследствии профессор, выдающийся химик своего времени, скатывал из пиролюзита шарики, добавляя к руде масло, и сильно нагревал их в тигле, выложенном древесным углем. Получались металлические шарики, весившие втрое меньше, чем шарики из руды. Это и был марганец. Новый металл называли сначала «магнезия», но так как в то время уже была известна белая магнезия — окись магния , металл переименовали в «магнезнум»; это название и было принято Французской комиссией по номенклатуре в 1787 г. Но в 1808 г. Хэмфри Дэви открыл магний и тоже назвал его «магнезиум»; тогда во избежание путаницы марганец стали называть «манганум».
В России марганцем долгое время называли пиролюзит, пока в 1807 г. Л. И. Шерер не предложил именовать марганцем металл, полученный из пиролюзита, а сам минерал в те годы называли черным марганцем.
Марганцевые руды
В чистом виде марганец в природе не встречается. В рудах он присутствует в виде окислов, гидроокисей и карбонатов. Основной минерал, содержащий марганец, — это все тот же пиролюзит, относительно мягкий темно-серый камень. В нем 63,2% марганца. Есть и другие марганцевые руды: псиломелан , браунит , гаусманит , манганит . Все это окислы и силикаты элемента № 25. Валентность марганца в них равна 2, 3 и 4. Есть еще один потенциальный источник элемента № 25 — конкреции, залегающие на дне океанов и аккумулирующие марганец и другие металлы. Но о них разговор особый.
Марганцевые руды делят на химические и металлургические. Первые содержат не меньше 80% MnO 2 . Их используют в гальванических элементах (двуокись марганца — отличный деполяризатор), в производстве стекла, керамики, минеральных красителей, «марганцовки » (KMnO 4) и некоторых других продуктов химической промышленности.
И железо — соседи не только по таблице Менделеева, в марганцевых рудах всегда присутствует железо. А вот в железных рудах марганец (в достаточном количестве), к сожалению, есть не всегда. К сожалению — потому, что элемент № 25 — одна из важнейших легирующих добавок.
Месторождения марганцевых руд есть на всех континентах. На долю нашей страны приходится около 50% мировой добычи марганцевых руд. Богаты марганцем также Индия, Гана, Марокко, Бразилия, ЮжноАфриканская Республика. Большинство же промышленно развитых стран вынуждено ввозить марганцевую руду из-за рубежа, так как их собственные месторождения не удовлетворяют нужд черной металлургии ни по количеству, ни по качеству руды. Наша страна не только полностью обеспечивает свою металлургию высококачественной марганцевой рудой, но и экспортирует ее в значительных количествах.
До Великой Отечественной войны в СССР марганцевую руду добывали в двух районах — в Чиатуре (Грузия) и около Никополя (Украина). Когда во время войны Никопольский бассейн оккупировали фашисты, в неслыханно короткий срок были освоены новые месторождения марганцевых руд на Урале и в Казахстане. Советская черная металлургия получила достаточно марганца и смогла дать высококачественную сталь для танковой брони и артиллерийских орудий.
Чистый марганец
Уже упоминалось, что первый металлический марганец был получен при восстановлении пиролюзита древесным углем: MnO 2 + C → Mn + 2СО. Но это не был элементный марганец. Подобно своим соседям по таблице Менделеева — хрому и железу, марганец реагирует с углеродом и всегда содержит примесь карбида. Значит, с помощью углерода чистый марганец не получить. Сейчас для получения металлического марганца применяют три способа: силикотермический (восстановление кремнием), алюминотермический (восстановление алюминием) и электролитический.
Наиболее широкое распространение нашел алюминотермический способ, разработанный в конце XIX в. В этом случае в качестве марганцевого сырья лучше применять не пиролюзит, а закись-окись марганца Mn 3 O 4 . Пиролюзит реагирует с алюминием с выделением такого большого количества тепла, что реакция легко может стать неуправляемой. Поэтому, прежде чем восстанавливать пиролюзит, его обжигают, а уже полученную закись-окись смешивают с алюминиевым порошком и поджигают в специальном контейнере. Начинается реакция 3Mn 3 O 4 + 8Аl → 9Mn + 4Al 2 O 3 — достаточно быстрая и не требующая дополнительных затрат энергии. Полученный расплав охлаждают, скалывают хрупкий шлак, а слиток марганца дробят и отправляют на дальнейшую переработку.
Однако алюминотермический способ, как и силикотермический, не дает марганца высокой чистоты. Очистить алюминотермический марганец можно возгонкой, но этот способ малопроизводителен и дорог. Поэтому металлурги давно искали новые способы получения чистого металлического марганца и, естественно, прежде всего надеялись на электролитическое рафинирование. Но в отличие от меди , никеля и других металлов, марганец, откладывавшийся на электродах, не был чистым: его загрязняли примеси окислов. Более того, получался пористый, непрочный, неудобный для переработки металл.
Многие известные ученые пытались подобрать оптимальный режим электролиза марганцевых соединений, но безуспешно. Эту задачу разрешил в 1939 г. советский ученый Р. И. Агладзе (впоследствии действительный член Академии наук Грузинской ССР). По разработанной им технологии электролиза из хлористых и сернокислых солей получается достаточно плотный металл, содержащий до 99,98% элемента № 25. Этот метод лег в основу промышленного получения металлического марганца.
Внешне этот металл похож на железо, только тверже его. На воздухе окисляется, но, как и у алюминия, пленка окисла быстро покрывает всю поверхность металла и препятствует дальнейшему окислению. С кислотами марганец реагирует быстро, с азотом образует нитриды, с углеродом — карбиды. В общем, типичный металл.
Марганец обычно вводят в сталь вместе с другими элементами — хромом, кремнием, вольфрамом. Однако есть сталь, в состав которой, кроме железа, марганца и углерода, ничего не входит. Это так называемая сталь Гадфилда. Она содержит 1-1,5% углерода и 11-15% марганца. Сталь этой марки обладает огромной износостойкостью и твердостью. Ее применяют для изготовления дробилок, которые перемалывают самые твердые породы, деталей экскаваторов и бульдозеров. Твердость этой стали такова, что она не поддается механической обработке, детали из нее можно только отливать. А вообще сталей, содержащих марганец, довольно много. Точнее, нет ни одной стали, которая не содержала бы марганца в тех или иных количествах. Ведь марганец приходит в сталь из чугуна. Однако иногда его количества настолько малы, что букву Г в марку стали не вставляют. Впрочем, марганцем улучшают свойства не только железа. Так, сплавы марганца с медью обладают высокой прочностью и коррозионной стойкостью. Из этих сплавов делают лопатки турбин, а из марганцовистых бронз — винты самолетов и другие авиадетали.
Марганец не блестит, как золото , не льется, как , не вспыхивает на воздухе, как натрий . Но этот внешне ничем не примечательный серый металл жизненно важен: пока в технике главенствует железо, будет необходим и его верный спутник — марганец.
Марганец в организме
Еще в начале прошлого века было известно, что марганец входит в состав живых организмов. Сейчас установлено, что незначительные количества марганца есть во всех растительных и животных организмах. Нет его только в белке куриного яйца и очень мало — в молоке. В организме марганец распределяется неравномерно. Например, в 100 г сухого вещества стеблей винограда содержится 191 мг марганца, корней — 130 мг, а ягод — всего 70 мг. В крови человека и большинства животных содержание марганца составляет около 0,02 мг/л. Исключение составляют овцы, кровь которых богаче марганцем — 0,06 мг/л. Установлено, что марганец играет значительную роль в обмене веществ. В растениях он ускоряет образование хлорофилла и повышает их способность синтезировать витамин С. Поэтому внесение марганца в почву заметно повышает урожайность многих культур, в частности озимой пшеницы и хлопчатника.
Отсутствие марганца в пище животных сказывается на их росте и жизненном тонусе. Мыши, которых кормили одним молоком, содержащим очень мало марганца, теряли способность к размножению. Когда же к их пище начали добавлять хлористый марганец, эта способность восстановилась.
Элемент № 25 влияет и на процессы кроветворения. Кроме того, он ускоряет образование антител, нейтрализующих вредное действие чужеродных белков. Один из немецких ученых вводил морским свинкам смертельные дозы столбнячных и дизентерийных бактерий. Если после этого вводилась только противостолбнячная и противодизентерийная сыворотка, то животным она уже не помогала. Введение сыворотки и хлористого марганца излечивало морских свинок. Внутривенным вливанием раствора сульфата марганца удается спасать укушенных каракуртом — ядовитейшим из среднеазиатских пауков.
МАРГАНЕЦ (химический элемент)
МА́РГАНЕЦ (лат. Manganum), Mn, химический элемент с атомным номером 25, атомная масса 54,9380. Химический символ элемента Mn произносится так же, как и название самого элемента. Природный марганец состоит только из нуклида (см. НУКЛИД) 55 Mn. Конфигурация двух внешних электронных слоев атома марганца 3s 2 p 6 d 5 4s 2 . В периодической системе Д. И. Менделеева марганец входит в группу VIIВ, к которой относятся также технеций (см. ТЕХНЕЦИЙ) и рений (см. РЕНИЙ) , и располагается в 4-м периоде. Образует соединения в степенях окисления от +2 (валентность II) до +7 (валентность VII), наиболее устойчивы соединения, в которых марганец проявляет степени окисления +2 и +7. У марганца, как и у многих других переходных металлов, известны также соединения, содержащие атомы марганца в степени окисления 0.
Радиус нейтрального атома марганца 0,130 нм, радиус иона Mn 2+ — 0,080-0,104 нм, иона Mn 7+ — 0,039-0,060 нм. Энергии последовательной ионизации атома марганца 7,435, 15,64, 33,7, 51,2, 72,4 эВ. По шкале Полинга электроотрицательность марганца 1,55; марганец принадлежит к числу переходных металлов. Марганец в компактном виде — твердый серебристо-белый металл.
История открытия
Один из основных материалов марганца — пиролюзит (см. ПИРОЛЮЗИТ) — был известен в древности как черная магнезия и использовался при варке стекла для его осветления. Его считали разновидностью магнитного железняка, а тот факт, что он не притягивается магнитом, Плиний Старший объяснил женским полом черной магнезии, к которому магнит «равнодушен». В 1774 г. шведский химик К. Шееле (см. ШЕЕЛЕ Карл Вильгельм) показал, что в руде содержится неизвестный металл. Он послал образцы руды своему другу химику Ю. Гану (см. ГАН Юхан Готлиб) , который, нагревая в печке пиролюзит с углем, получил металлический марганец. В начале 19 в. для него было принято название «манганум» (от немецкого Manganerz — марганцевая руда).
Нахождение в природе
В земной коре содержание марганца составляет около 0,1 % по массе. В свободном виде марганец не встречается. Из руд наиболее распространены пиролюзит MnO 2 (содержит 63,2 % марганца), манганит (см. МАНГАНИТ) MnO 2 ·Mn(OH) 2 (62,5 % марганца), браунит (см. БРАУНИТ) Mn 2 O 3 (69,5 % марганца), родохрозит (см. РОДОХРОЗИТ) MnCo 3 (47,8 % марганца), псиломелан (см. ПСИЛОМЕЛАН) mMnO·MnO 2 ·nH 2 O (45-60% марганца). Марганец содержат жՐېՐאޭмарганцевые конкреции, которые в больших количествах (сотни миллиардов тонн) находятся на дне Тихого, Атлантического и Индийского океанов. В морской воде содержится около 1,0·10 –8 % марганца. Промышленного значения эти запасы марганца пока не имеют из-за сложности подъема конкреций на поверхность.
Получение
Промышленное получение марганца начинается с добычи и обогащения руд. Если используют карбонатную руду марганца, то ее предварительно подвергают обжигу. В некоторых случаях руду далее подвергают сернокислотному выщелачиванию. Затем обычно марганец в полученном концентрате восстанавливают с помощью кокса (карботермическое восстановление). Иногда в качестве восстановителя используют алюминий или кремний. Для практических целей чаще всего используют ферромарганец, полученный в доменном процессе (см. ст. Железо (см. ЖЕЛЕЗО) ) при восстановлении руд железа и марганца коксом (см. КОКС) . В ферромарганце содержание углерода составляет 6-8 % по массе. Чистый марганец получают электролизом водных растворов сульфата марганца MnSO 4 , который проводят в присутствии сульфата аммония (NH 4) 2 SO 4 .
Физические и химические свойства
Марганец твердый хрупкий металл. Известны четыре кубические модификации металлического марганца. При температурах от комнатной и до 710°C устойчив альфа-Mn, параметр решетки а = 0,89125 нм, плотность 7,44 кг/дм 3 . В интервале температур 710-1090°C существует бета-Mn, параметр решетки а = 0,6300 нм; при температурах 1090-1137°C — гамма-Mn, параметр решетки а = 0,38550 нм. Наконец, при температуре от 1137°C и до температуры плавления (1244°C) устойчив дельта-Mn с параметром решетки а = 0,30750 нм. Модификаци альфа, бета и дельта хрупкие, гамма-Mn пластичен. Температура кипения марганца около 2080°C.
На воздухе марганец окисляется, в результате чего его поверхность покрывается плотной оксидной пленкой, которая предохраняет металл от дальнейшего окисления. При прокаливании на воздухе выше 800°C марганец покрывается окалиной, состоящей из внешнего слоя Mn 3 O 4 и внутреннего слоя состава MnO. Марганец образует несколько оксидов: MnO, Mn 3 O 4 , Mn 2 O 3 , MnO 2 и Mn 2 O 7 . Все они, кроме Mn 2 O 7 , представляющего собой при комнатной температуре маслянистую зеленую жидкость с температурой плавления 5,9°C, твердые кристаллические вещества. Монооксид марганца MnO образуется при разложении солей двухвалентного марганца (карбоната и других) при температуре около 300°C в инертной атмосфере:
MnCO 3 = MnO + CO 2
Этот оксид обладает полупроводниковыми свойствами. При разложении MnOОН можно получить Mn 2 O 3 . Этот же оксид марганца образуется при нагревании MnO 2 на воздухе при температуре примерно 600°C:
4MnO 2 = 2Mn 2 O 3 + O 2
Оксид Mn 2 O 3 восстанавливается водородом до MnO, а под действием разбавленных серной и азотной кислот переходит в диоксид марганца MnO 2 . Если MnO 2 прокаливать при температуре около 950°C, то наблюдается отщепление кислорода и образование оксида марганца состава Mn 3 O 4:
3MnO 2 = Mn 3 O 4 + O 2
Этот оксид можно представить как MnO·Mn 2 О 3 , и по свойствам Mn 3 О 4 соответствует смеси этих оксидов. Диоксид марганца MnO 2 — наиболее распространенное природное соединение марганца в природе, существующее в нескольких полиморфных формах. Так называемая бета-модификация MnO 2 — это уже упоминавшийся минерал пиролюзит. Ромбическая модификация диоксида марганца, гамма-MnO 2 также встречается в природе. Это — минерал рамсделит (другое название — полианит).
Диоксид марганца нестехиометричен, в его решетке всегда наблюдается дефицит кислорода. Если оксиды марганца, отвечающие его более низким степеням окисления, чем +4, — основные, то диоксид марганца обладает амфотерными свойствами. При 170°C MnO 2 можно восстановить водородом до MnO. Если к перманганату калия KMnO 4 добавить концентрированную серную кислоту, то образуется кислотный оксид Mn 2 O 7 , обладающий сильными окислительными свойствами:
2KMnO 4 + 2H 2 SO 4 = 2KHSO 4 + Mn 2 O 7 + H 2 O.
Mn 2 O 7 — кислотный оксид, ему отвечает сильная, не существующая в свободном состоянии марганцовая кислота НMnO 4 . При взаимодействии марганца с галогенами образуются дигалогениды MnHal 2 . В случае фтора возможно также образование фторидов состава MnF 3 и MnF 4 , а в случае хлора — также трихлорида MnCl 3 . Реакции марганца с серой приводят к образованию сульфидов составов MnS (существует в трех полиморфных формах) и MnS 2 . Известна целая группа нитридов марганца: MnN 6 , Mn 5 N 2 , Mn 4 N, MnN, Mn 6 N 5 , Mn 3 N 2 .
С фосфором марганец образует фосфиды составов MnР, MnP 3 , Mn 2 P, Mn 3 P, Mn 3 P 2 и Mn 4 P. Известно несколько карбидов и силицидов марганца. С холодной водой марганец реагирует очень медленно, но при нагревании скорость реакции значительно возрастает, образуется Mn(OH) 2 и выделяется водород. При взаимодействии марганца с кислотами образуются соли марганца(II):
Mn + 2HCl = MnCl 2 + H 2 .
Из растворов солей Mn 2+ можно осадить плохо растворимое в воде основание средней силы Mn(OH) 2:
Mn(NO 3) 2 + 2NaOH = Mn(OH) 2 + 2NaNO 3
Марганцу отвечает несколько кислот, из которых наиболее важны сильные неустойчивые марганцоватая кислота H 2 MnO 4 и марганцовая кислота HMnO 4 , соли которых — соответственно, манганаты (например, манганат натрия Na 2 MnO 4) и перманганаты (например, перманганат калия KMnO 4). Манганаты (известны манганаты только щелочных металлов и бария) могут проявлять свойства как окислителей (чаще)
2NaI + Na 2 MnO 4 + 2H 2 O = MnO 2 + I 2 + 4NaOH,
так и восстановителей
2K 2 MnO 4 + Cl 2 = 2KMnO 4 + 2KCl.
В водных растворах манганаты диспропорционируют на соединения марганца(+4) и марганца(+7):
3K 2 MnO 4 + 3Н 2 О = 2KMnO 4 + MnO 2 ·Н 2 О + 4КОН.
При этом окраска раствора из зеленой переходит в синюю, затем в фиолетовую и малиновую. За способность изменять окраску своих растворов К. Шееле назвал манганат калия минеральным хамелеоном. Перманганаты — сильные окислители. Например, перманганат калия KMnO 4 в кислой среде окисляет сернистый газ SO 2 до сульфата:
2KMnO 4 + 5SO 2 +2H 2 O = K 2 SO 4 + 2MnSO 4 + 2H 2 SO 4 . При давлении около 10 МПа безводный MnCl 2 в присутствии металлоорганических соединений реагирует с оксидом углерода(II) CO с образованием биядерного карбонила Mn 2 (CO) 10 .
Применение
Более 90% производимого марганца идет в черную металлургию. Марганец используют как добавку к сталям для их раскисления (см. РАСКИСЛЕНИЕ) , десульфурации (см. ДЕСУЛЬФУРАЦИЯ) (при этом происходит удаление из стали нежелательных примесей — кислорода, серы), а также для легирования (см. ЛЕГИРОВАНИЕ) сталей, т. е. улучшения их механических и коррозионных свойств. Марганец применяется также в медных, алюминиевых и магниевых сплавах. Покрытия из марганца на металлических поверхностях обеспечивают их антикоррозионную защиту. Для нанесения тонких покрытий из марганца используют легко летучий и термически нестабильный биядерный декакарбонил Mn 2 (CO) 10 . Соединения марганца (карбонат, оксиды и другие) используют при производстве ферритных материалов, они служат катализаторами (см. КАТАЛИЗАТОРЫ) многих химических реакций, входят в состав микроудобрений.
Биологическая роль
Марганец — микроэлемент (см. МИКРОЭЛЕМЕНТЫ) , постоянно присутствующий в живых организмах и необходимый для их нормальной жизнедеятельности. Содержание марганца в растениях составляет 10 -4 –10 -2 %, в животных 10 -3 –10 -5 %, некоторые растения (водяной орех, ряска, диатомовые водоросли) и животные (муравьи, устрицы, ряд ракообразных) способны концентрировать марганец. В организме среднего человека (масса тела 70 кг) содержится 12 мг марганца. Марганец необходим животным и растениям для нормального роста и размножения. Он активирует ряд ферментов, участвует в процессах дыхания, фотосинтеза (см. ФОТОСИНТЕЗ) , влияет на проветривание и минеральные обмен.
Человек с пищей получает ежедневно 0,4-10 мг марганца. Недостаток марганца в организме может привести к заболеванию человека. Для обеспечения нормального развития растений в почву вносят марганцевые микроудобрения (обычно в форме разбавленного раствора перманганата калия). Однако избыток марганца для человеческого организма вреден. При отравлении соединениями марганца происходит поражение нервной системы, развивается так называемый марганцевый паркинсонизм. (см. ПАРКИНСОНИЗМ) ПДК в расчете на марганец для воздуха 0,03 мг/м 3 . Токсическая доза (для крыс) — 10-20 мг.
Энциклопедический словарь . 2009 .
Смотреть что такое «МАРГАНЕЦ (химический элемент)» в других словарях:
— (Manganè se франц. и англ.; Mangan нем.; Mn = 55,09 [Среднее из 55,16 (Dewar и Scott, 1883) и 55,02 (Marimac, 1884)]. Уже древние знали о существовании главной руды М., пиролюзита, употребляли этот минерал при приготовлении стекла (Плиний… …
Марганец (лат. Manganum), Mn, химический элемент VII группы периодической системы Менделеева; атомный номер 25, атомная масса 54,9380; тяжёлый серебристо белый металл. В природе элемент представлен одним стабильным изотопом 55Mn. Историческая… … Большая советская энциклопедия
— (фр. Chlore, нем. Chlor, англ. Chlorine) элемент из группы галоидов; знак его Cl; атомный вес 35,451 [Пo расчету Кларке данных Стаса.] при O = 16; частица Cl 2, которой хорошо отвечают найденные Бунзеном и Реньо плотности его по отношению к… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Марганец химический элемент. Кроме того, слово «марганец» может означать: Марганец город в Днепропетровской области Украины. Марганцовка бытовое название перманганата калия (KMnO4) … Википедия
— (ново лат.), marganesium, испорченное слово, произведен. от magneg магнит, по сходству с ним). Металл сероватого цвета, трудноплавкий, хрупкий встречающийся в черной марганцовой руде. Словарь иностранных слов, вошедших в состав русского языка.… … Словарь иностранных слов русского языка
— (Manganum), Mn, химический элемент VII группы периодической системы, атомный номер 25, атомная масса 54,9380; металл, tпл 1244шC. Марганец используют для легирования сталей и получения сплавов на его основе, в производстве микроудобрений. Открыт… … Современная энциклопедия
— (лат. Manganum) Mn, химический элемент VII группы периодической системы, атомный номер 25, атомная масса 54,9380. Название от немецкого Manganerz марганцевая руда. Серебристо белый металл; плотность 7,44 г/см³, tпл 1244 .С. Минералы пиролюзит … Большой Энциклопедический словарь
Марганец — (Manganum), Mn, химический элемент VII группы периодической системы, атомный номер 25, атомная масса 54,9380; металл, tпл 1244°C. Марганец используют для легирования сталей и получения сплавов на его основе, в производстве микроудобрений. Открыт… … Иллюстрированный энциклопедический словарь
МАРГАНЕЦ, нца, муж. Химический элемент, металл серебристо белого цвета. | прил. марганцевый, ая, ое и марганцовый, ая, ое. Марганцевая руда. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Химический элемент, розовато белый металл, легко окисляющийся на воздухе. Внесение солей М. в почву (в вегетационных опытах) даже в небольших количествах сопровождалось повышением урожая нек рых раст. Возможность применения М. на удобрение… … Сельскохозяйственный словарь-справочник
Истинная, эмпирическая, или брутто-формула: Mn
Молекулярная масса: 54,938
Марганец — элемент побочной подгруппы седьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 25. Обозначается символом Mn (лат. Manganum, ма́нганум, в составе формул по-русски читается как марганец, например, KMnO 4 — калий марганец о четыре). Простое вещество марганец (CAS-номер: 7439-96-5) — металл серебристо-белого цвета. Наряду с железом и его сплавами относится к чёрным металлам. Известны пять аллотропных модификаций марганца — четыре с кубической и одна с тетрагональной кристаллической решёткой.
История открытия
Один из основных минералов марганца — пиролюзит — был известен в древности как чёрная магнезия и использовался при варке стекла для его осветления. Его считали разновидностью магнитного железняка, а тот факт, что он не притягивается магнитом, Плиний Старший объяснил женским полом чёрной магнезии, к которому магнит «равнодушен». В 1774 г. шведский химик К. Шееле показал, что в руде содержится неизвестный металл. Он послал образцы руды своему другу химику Ю. Гану, который, нагревая в печке пиролюзит с углем, получил металлический марганец. В начале XIX века для него было принято название «манганум» (от немецкого Manganerz — марганцевая руда).
Распространённость в природе
Марганец — 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся в земной коре (0,03 % от общего числа атомов земной коры). Весовое количество марганца увеличивается от кислых (600 г/т) к основным породам (2,2 кг/т). Сопутствует железу во многих его рудах, однако встречаются и самостоятельные месторождения марганца. В чиатурском месторождении (район Кутаиси) сосредоточено до 40 % марганцевых руд. Марганец, рассеянный в горных породах, вымывается водой и уносится в Мировой океан. При этом его содержание в морской воде незначительно (10−7-10−6%), а в глубоких местах океана его концентрация возрастает до 0,3 % вследствие окисления растворённым в воде кислородом с образованием нерастворимого в воде оксида марганца, который в гидратированной форме (MnO2·xH2O) и опускается в нижние слои океана, формируя так называемые железо-марганцевые конкреции на дне, в которых количество марганца может достигать 45 % (также в них имеются примеси меди, никеля, кобальта). Такие конкреции могут стать в будущем источником марганца для промышленности.
В России является остродефицитным сырьём, известны месторождения: «Усинское» в Кемеровской области, «Полуночное» в Свердловской, «Порожинское» в Красноярском крае, «Южно-Хинганское» в Еврейской автономной области, «Рогачёво-Тайнинская» площадь и «Северо-Тайнинское» поле на Новой Земле.
Минералы марганца
- пиролюзит MnO 2 ·xH 2 O, самый распространённый минерал (содержит 63,2 % марганца);
- манганит (бурая марганцевая руда) MnO(OH) (62,5 % марганца);
- браунит 3Mn 2 O 3 ·MnSiO3 (69,5 % марганца);
- гаусманит (MnIIMn2III)O 4 ;
- родохрозит (марганцевый шпат, малиновый шпат) MnCO 3 (47,8 % марганца);
- псиломелан mMnO MnO 2 nH 2 O (45-60 % марганца);
- пурпурит Mn 3 +, (36,65 % марганца).
- Алюминотермическим методом, восстанавливая оксид Mn 2 O 3 , образующийся при прокаливании пиролюзита.
- Восстановлением железосодержащих оксидных руд марганца коксом. Этим способом в металлургии обычно получают ферромарганец (
Физические свойства
Некоторые свойства приведены в таблице. Другие свойства марганца:
- Работа выхода электрона: 4,1 эВ
- Коэффициент линейного температурного расширения: 0,000022 см/см/°C (при 0 °C)
- Электропроводность: 0,00695·106 Ом -1 ·см -1
- Теплопроводность: 0,0782 Вт/см·K
- Энтальпия атомизации: 280,3 кДж/моль при 25 °C
- Энтальпия плавления: 14,64 кДж/моль
- Энтальпия испарения: 219,7 кДж/моль
- Твёрдость
- по шкале Бринелля: Мн/м²
- по шкале Мооса: 4
Химические свойства
Характерные степени окисления марганца: 0, +2, +3, +4, +6, +7 (степени окисления +1, +5 малохарактерны). При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде.
Марганец при нагревании разлагает воду , вытесняя водород. При этом слой образующегося гидроксида марганца замедляет реакцию. Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды.
Углерод реагирует с расплавленным марганцем, образуя карбиды Mn 3 C и другие. Образует также силициды, бориды, фосфиды. В щелочном растворе марганец устойчив.
Марганец образует следующие оксиды: MnO, Mn 2 O 3 , MnO 2 , MnO 3 (не выделен в свободном состоянии) и марганцевый ангидрид Mn 2 O 7 .
Mn 2 O 7 в обычных условиях жидкое маслянистое вещество тёмно-зелёного цвета, очень неустойчивое; в смеси с концентрированной серной кислотой воспламеняет органические вещества. При 90 °C Mn2O7 разлагается со взрывом. Наиболее устойчивы оксиды Mn 2 O 3 и MnO 2 , а также комбинированный оксид Mn 3 O 4 (2MnO·MnO 2 , или соль Mn 2 MnO 4). При сплавлении оксида марганца (IV) (пиролюзит) со щелочами в присутствии кислорода образуются манганаты. Раствор манганата имеет тёмно-зелёный цвет. Раствор окрашивается в малиновый цвет из-за появления аниона MnO 4 − , и из него выпадает коричневый осадок оксида-гидроксида марганца (IV).
Марганцевая кислота очень сильная, но неустойчивая, её невозможно сконцентрировать более, чем до 20 %. Сама кислота и её соли (перманганаты) — сильные окислители. Например, перманганат калия в зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца (II), в нейтральной — до соединений марганца (IV), в сильно щелочной — до соединений марганца (VI).
При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Под действием сильных окислителей ион Mn 2+ переходит в ион MnO 4 — . Эта реакция используется для качественного определения Mn 2+ (см. в разделе «Определение методами химического анализа»).
При подщелачивании растворов солей Mn (II) из них выпадает осадок гидроксида марганца (II), быстро буреющий на воздухе в результате окисления. Подробное описание реакции см. в разделе «Определение методами химического анализа».
Соли MnCl 3 , Mn 2 (SO 4) 3 неустойчивы. Гидроксиды Mn(OH) 2 и Mn(OH) 3 имеют основный характер, MnO(OH) 2 — амфотерный. Хлорид марганца (IV) MnCl 4 очень неустойчив, разлагается при нагревании, чем пользуются для получения хлора. Нулевая степень окисления у марганца проявляется в соединениях с σ-донорными и π-акцепторными лигандами. Так, для марганца и известен карбонил состава Mn 2 (CO) 10 .
Известны и другие соединения марганца с σ-донорными и π-акцепторными лигандами (PF 3 , NO, N 2 , P(C 5 H 5) 3).Применение в промышленности
Применение в металлургии
Марганец в виде ферромарганца применяется для «раскисления» стали при её плавке, то есть для удаления из неё кислорода. Кроме того, он связывает серу, что также улучшает свойства сталей. Введение до 12-13 % Mn в сталь (так называемая Сталь Гадфильда), иногда в сочетании с другими легирующими металлами, сильно упрочняет сталь, делает её твёрдой и сопротивляющейся износу и ударам (эта сталь резко упрочняется и становится твёрже при ударах). Такая сталь используется для изготовления шаровых мельниц, землеройных и камнедробильных машин, броневых элементов и т. д. В «зеркальный чугун» вводится до 20 % Mn. В 1920-х-40х годах применение Марганца позволяло выплавлять броневую сталь. В начале 1950-х годов в журнале Сталь возникла дискуссия по вопросу о возможности снижения содержания марганца в чугуне, и тем самым отказа от поддержки определенного содержания марганца в процессе мартеновской плавки, в которой вместе с В.И. Явойским и В. И. Баптизманским принял участие Е. И. Зарвин, который на основе производственных экспериментов показал нецелесообразность существовавшей технологии. Позже он показал возможность ведения мартеновского процесса на маломарганцовистом чугуне. С пуском ЗСМК началась разработка передела низкомарганцовистых чугунов в конвертерах. Сплав 83 % Cu, 13 % Mn и 4 % Ni (манганин) обладает высоким электросопротивлением, мало изменяющимся с изменением температуры. Поэтому его применяют для изготовления реостатов и пр. Марганец вводят в бронзы и латуни.
Применение в химии
Значительное количество диоксида марганца потребляется при производстве марганцево-цинковых гальванических элементов, MnO 2 используется в таких элементах в качестве окислителя-деполяризатора. Соединения марганца также широко используются как в тонком органическом синтезе (MnO 2 и KMnO 4 в качестве окислителей), так и промышленном органическом синтезе (компоненты катализаторов окисления углеводородов, например, в производстве терефталевой кислоты окислением p-ксилола, окисление парафинов в высшие жирные кислоты). Арсенид марганца обладает гигантским магнитокалорическим эффектом, усиливающимся под давлением. Теллурид марганца перспективный термоэлектрический материал (термо-э. д. с 500 мкВ/К).
Биологическая роль и содержание в живых организмах
Марганец содержится в организмах всех растений и животных, хотя его содержание обычно очень мало, порядка тысячных долей процента, он оказывает значительное влияние на жизнедеятельность, то есть является микроэлементом. Марганец оказывает влияние на рост, образование крови и функции половых желёз. Особо богаты марганцем листья свёклы — до 0,03 %, а также большие его количества содержатся в организмах рыжих муравьёв — до 0,05 %. Некоторые бактерии содержат до нескольких процентов марганца. Избыточное накопление марганца в организме сказывается, в первую очередь, на функционировании центральной нервной системы. Это проявляется в утомляемости, сонливости, ухудшении функций памяти. Марганец является политропным ядом, поражающим также лёгкие, сердечно-сосудистую и гепатобиллиарную системы, вызывает аллергический и мутагенный эффект
Токсичность
Токсическая доза для человека составляет 40 мг марганца в день. Летальная доза для человека не определена. При пероральном поступлении марганец относится к наименее ядовитым микроэлементам. Главными признаками отравления марганцем у животных являются угнетение роста, понижение аппетита, нарушение метаболизма железа и изменение функции мозга. Сообщений о случаях отравления марганцем у людей, вызванных приёмом пищи с высоким содержанием марганца, нет. В основном отравление людей наблюдается в случаях хронической ингаляции больших количеств марганца на производстве. Оно проявляется в виде тяжёлых нарушений психики, включая гиперраздражительность, гипермоторику и галлюцинации — «марганцевое безумие». В дальнейшем развиваются изменения в экстрапирамидной системе, подобные болезни Паркинсона. Чтобы развилась клиническая картина хронического отравления марганцем, обычно требуется несколько лет. Она характеризуется достаточно медленным нарастанием патологических изменений в организме, вызываемых повышенным содержанием марганца в окружающей среде (в частности, распространение эндемического зоба, не связанного с дефицитом йода).
Месторождение
Усинское месторождение марганца
Принадлежит VII группе. Расположен в четвертом периоде между хромом и железом. Имеет 25-й атомный номер. Формула марганца 3d 5 4s 2 .
Был открыт в 1774 году. Атом марганца весит 54,938045. Содержит изотоп 55Mn, а природный марганец состоит полностью из него. Степень окисления металла колеблется от 2 до 7. Электроотрицательность Mn — 1,55. Переходный материал.
Соединения марганец 2 образуют оксид и диоксид. Проявляют основные свойства элемента. Образования марганец 3 и марганец 4 отличаются амфотерными свойствами. В комбинациях металла 6 и 7 лидируют свойства кислоты марганца . Элемент № 25 образует многочисленные виды солей и различные бинарные соединения.
Добыча марганца ведется повсеместно как в России, так и в ближнем зарубежье. На Украине существует особый Марганец – город , расположенный на многочисленных образованиях марганцевой руды.
Описание и свойства марганца
Серебристо-белый цвет с легким серым налетом выделяет марганец. Состав элемента имеет примесь углерода, которая дает ему серебристо-белый цвет. Он превосходит железо по твердости и хрупкости. В виде мелких абразивов пирофорен.

При взаимодействии с воздушной средой происходит окисление марганца . Покрывается оксидной пленкой, защищающей его от последующей окислительной реакции.
Растворяется в воде, полностью поглощает водород, не вступая в реакцию с ним. В процессе нагревания сгорает в кислороде. Активно реагирует с хлором и серой. При взаимодействии с кислотными окислителями образует соли марганца .
Плотность — 7200 кг/м3, t плавления — 1247°С, t кипения — 2150 °С. Удельная теплоемкость — 0,478 кДж. Обладает электрической проводимостью. Контактируя с хлором, бромом и йодом образует дигалогениды.

При высоких температурах вступает во взаимодействие с азотом, фосфором, кремнием и бором. Медленно взаимодействует с холодной водой. В процессе нагревания реакционная способность элемента возрастает. На выходе образуется Mn(OH)2 и водород. При соединении марганца с кислородом образуется оксид марганца . Выделяют семь его групп:
Оксид марганца (II). Монооксид. Не взаимодействует с водой. Легко окисляется, образуя хрупкую корку. При нагревании с водородом и металлами активной группы восстанавливается до марганца. Имеет зеленый и серо-зеленый цвет кристаллов. Полупроводник.
Оксид марганца (II,III). Кристаллы коричневого – черного цвета Mn3O4. Парамагнетик. В естественной среде встречается как минерал гаусманит.
Оксид марганца (II,IV). Соединение неорганического характера Mn5O8. Может рассматриваться как ортоманганит марганца . Не растворяется в H 2 O.

Оксид марганца (III).Кристаллы коричневого – черного цвета Mn2O3. Не вступают в реакцию с водой. Встречается в природной среде в минералах браунит, курнакит и биксбиит.
Оксид марганца (IV) или диоксид марганца MnO2. Нерастворимый в воде порошок темно-коричневого оттенка. Устойчивое образование марганца. Содержится в минерале пиролюзит. Поглощает хлор и соли тяжелых металлов.
Оксид марганца (VI) . Темно-красный аморфный элемент. Вступает в реакцию с водой. Полностью разлагается при нагревании. Щелочные реакции образуют солевые отложения.
Оксид марганца (VII). Маслянистая зеленовато-бурая жидкость Mn2O7. Сильный окислитель. При контакте с горючими смесями, мгновенно воспламеняет их. Может взорваться от толчка, резкой и яркой вспышки света, взаимодействия с органическими компонентами. При взаимодействии с Н 2 O образует марганцовую кислоту.

Соли марганца являются катализаторами окислительных процессов, происходящих с участием кислорода. Они применяются в сиккативах. Льняное масло с добавлением такого сиккатива именуется олифой.
Применение марганца
Mn широко используют в черной металлургии. Добавляют сплав железо марганец (ферромарганец). Доля марганца в нем равна 70-80%, углерода 0,5-7 %, остальная часть приходится на железо и посторонние примеси. Элемент №25 в сталеплавлении соединяет кислород и серу.
Используются смеси хром — марганец , -марганец, кремний-марганец. В производстве стали марганцу альтернативной замены нет.
Химический элемент выполняет множество функций, в том числе рафинирует и раскисляет сталь. Широко используется технология цинк марганец . Растворимость Zn в магнии составляет 2 %, а прочность стали, в этом случае, возрастает до 40 %.
В доменной шахте марганец удаляет серный налет из чугуна. В технике применяются тройные сплавы манганины, куда входит марганец медь и никель. Материал характеризуется большим электро-сопротивлением на которое влияет не температура, а сила давления.

Используется для изготовления манометров. Настоящей ценностью для промышленности является сплав медь — марганец. Содержание марганца здесь 70 %, меди 30%. Его применяют для снижения вредных производственных шумов. В изготовлении взрыв-пакетов для праздничных мероприятий используют смесь, куда входят такие элементы, как магний марганец . Магний широко используется в самолетостроении.
Некоторые виды солей марганца, такие как KMnO4 нашли свое применение в медицинской отрасли. Перманганат калия относится к солям марганцовой кислоты. Имеет вид темно-фиолетовых . Растворяется в водной среде, окрашивая её в фиолетовый цвет.
Является сильным окислителем. Антисептик, обладает противомикробными свойствами. Марганец в воде легко окисляется, образуя плохо растворимый оксид марганца коричневого цвета.
При соприкосновении с белком ткани формирует соединения с выраженными вяжущими качествами. В высоких концентрациях раствор марганца обладает раздражающим и прижигающим действием.
Калий марганец используют для лечения некоторых заболеваний и для оказания первой помощи, а пузырек с кристаллами марганцовки находится в каждой аптечки.

Марганец полезен для человеческого здоровья. Участвует в формировании и развитии клеток центрально-нервной системы. Способствует усвоению витамина В1, и железа. Регулирует содержание сахара в крови. Задействуется в строительстве костной ткани.
Участвует в образовании жирных кислот. Улучшает рефлекторные способности, память, убирает нервное напряжение, раздражительность. Абсорбируясь в стенках кишечника марганец, витамины В, Е, фосфор, кальций усиливают этот процесс, влияет на организм и обменные процессы в целом.
Минералы, незаменимые для человека, такие как кальций, магний, марганец , медь, калий, железо добавляют в витаминно-минеральные комплексы для устранения витаминного дефицита.
Также микроэлементы цинк, марганец и железо играют огромную роль в жизни растений. Входят в состав фосфорных и минеральных удобрений.
Цена марганца
Металлический марганец содержит до 95 % чистого марганца. Его применяют в сталелитейной металлургической промышленности. Удаляет из стали ненужные примеси и наделяет её легирующими качествами.
Ферромарганец используется для раскисления сплава во время процесса плавления, путем удаления из него кислорода. Связывает частицы серы между собой, улучшая качественные характеристики стали. Марганец упрочняет материал, делает его более износостойким.
Применяют металл при создании шаровых мельниц, землеройных и камнедробильных машин, броневых элементов. Из сплава мангадин изготавливают реостаты. Элемент № 25 добавляют в бронзу и .

Большой процент диоксида марганца потребляется для создания гальванических элементов. с добавлением Mn задействуется в тонком органическом и промышленном синтезе. Соединения MnO2 и KMnO4 выступают окислителями.
Марганец – вещество незаменимое в черной металлургии. Уникален по своим физическим и химическим характеристикам. Марганец купить можно в специализированных торговых точках. Пять килограмм металла стоит порядка 150 рублей, а тонна, в зависимости вида соединения, стоит около 100-200 тысяч рублей.
Применение и свойства марганца. Марганец: сплавы, свойства, распространение
Марганец (лат. – Manganum, Mn) в нашем организме содержится в небольшом количестве. Поэтому его относят к микроэлементам. Содержание этого микроэлемента в нашем организме невелико. Тем не менее, марганец наряду с другими веществами участвует в обмене жиров, углеводов, белков.
Марганец был открыт в XVIII в., что по историческим меркам не так уж и давно. Однако с соединениями марганца человек знаком еще с глубокой древности. Одно из таких соединений – диоксид марганца или пиролюзит, MnO 2 . Его использовали в стекольном и кожевенном деле. В ту пору многие минеральные соединения называли магнезиями. Вот и MnO 2 получил название черной магнезии из-за сходства с другим минералом, магнетитом.
Однако у этих минералов были различия. Магнетит – оксид железа, Fe 3 O 4 , и он притягивался магнитом. В отличие от него магнит на черную магнезию не действовал, и железо из него извлечь не удавалось. Поэтому данный минерал получил еще одно название – manganesium от древнегреческого слова обман. Этот термин перекочевал во многие европейские языки.
В немецком языке минерал получил название Mangan или Manganerz. Именно отсюда произошло русское название марганец. Однако сам марганец был получен лишь в 1778г. Тогда шведский химик Шееле сделал вывод, что пиролюзит вместо железа содержит другой, доселе неизвестный металл. В том же году Ган,
тоже шведский ученый, выделил марганец из пиролюзита.
Свойства
В периодической системе элементов Менделеева Mn расположен в VII группе IV периода, и значится под № 25. Это значит, что вокруг атомного ядра Mn вращаются 25 электронов, причем 7 из них – на внешней орбите.
При взаимодействии с различными веществами марганец способен отдавать эти электроны, или присоединять к себе другие. Соответственно, валентность его переменная, и колеблется от 1 до 7. Чаще всего она равна 2, 4, и 7. При минимальной валентности преобладают свойства марганца как восстановителя, а при максимальной – окислителя.
По многим своим чертам марганец сходен с железом, и наряду с железом его относят к черным металлам. Это серебристо-белый металл с атомной массой 55. Металл этот довольно тяжел, его плотность составляет 7,4 г/см 3 . Температуры плавления и кипения тоже высоки – 1245 0 С, и 2150 0 С. Марганец легко реагирует с кислородом с образованием оксидов.
Поскольку валентность марганца переменчива, его оксиды различаются между собой. Один из них – упомянутый выше пиролюзит. На поверхности металлического марганца образуется оксидная пленка, которая предохраняет его от дальнейшего окисления. Поскольку марганец в зависимости от валентности может быть и окислителем, и восстановителем, он реагирует и с металлами, и с неметаллами, и его соединения многообразны.
Вместе с кислородом он образует кислотный остаток марганцовистой кислоты. Этот остаток входит в состав солей этой кислоты, манганатов. Одна из таких солей – перманганат калия, KMnO 4 , всем известная марганцовка. Вообще, соединения марганца довольно распространены в природе. Особенно много их на дне океанов, где марганец сочетается с железом. На долю марганца приходится около 0,1% массы земной коры. По этому показателю среди всех элементов периодической системы Менделеева он занимает 11 место.
Физиологическое действие
Содержание марганца в организме взрослого человека невелико, 10-20 мг. Это намного меньше, чем содержание других металлов – калия, кальция, железа, натрия, меди, цинка. Поэтому Mn поначалу не относили к жизненно необходимым элементам, и полагали, что его присутствие в организме вовсе не является обязательным. Действительно, не все разновидности этого микроэлемента для нас представляют интерес. В физиологических процессах участвует двухвалентный и трехвалентный марганец, Mn (II) и Mn (III).
Физиологическая ценность марганца заключается в том, что он регулирует всасывание многих других полезных веществ (нутриентов). Среди этих нутриентов – медь, витамины группы В, в частности, вит. В 1 (Тиамин) и вит. В 4 (Холин). Кроме того, марганец позитивно влияет на всасывание вит. Е (Токоферола) и вит. С (Аскорбиновой кислоты). Эти витамины являются сильными антиоксидантами.
Соответственно, и марганец тоже оказывает антиоксидантное действие. Будучи антиоксидантом, он связывает свободные радикалы, и предупреждает повреждение ими клеток. Тем самым марганец укрепляет иммунитет и препятствует формированию злокачественных новообразований.
Кроме того, марганец входит в состав многих ферментных систем. Больше всего этого микроэлемента в митохондриях, где он участвует в накоплении энергии в виде молекул АТФ. Кроме того, марганец обеспечивает метаболизм (обмен) углеводов, белков и липидов (жиров). Он стимулирует катаболические процессы с расщеплением веществ и ускорением обменных реакций.
В ходе утилизации белков под действием марганца происходит их расщепление с бразованием конечных азотистых продуктов, мочевины и креатинина. В итоге выделяется энергия. Этот процесс имеет большое практическое значение при выполнении физической работы.
Марганец способствует синтезу жирных кислот, облегчает усваивание липидов, и участвует в их расщеплении. Липиды – энергоемкие соединения, и благодаря марганцу они расходуются полноценно с высвобождением максимального количества энергии. При этом марганец предупреждает отложение жировых масс в подкожном слое с развитием ожирения.
С расходом жиров снижается продукция низкоплотного холестерина, и он не откладывается на стенках сосудов в виде атеросклеротических бляшек. Кроме того, марганец в значительной степени предотвращает жировую инфильтрацию печени (жировой гепатоз). Благодаря Mn улучшается функция печени по связыванию и выведению вместе с желчью многих токсических соединений.
Кроме того, Mn осуществляет депонирование, накопление, гликогена в печени и в скелетных мышцах. Вообще, действие марганца на углеводный метаболизм многообразно. Марганец оказывает инсулиноподобное действие, способствует транспорту глюкозы внутрь клетки и ее последующее расщепление с образованием АТФ. Именно поэтому он сосредоточен в митохондриях.
Вместе с тем, по некоторым данным при дефиците глюкозы он способен запускать процессы гликонеогенеза, синтеза глюкозы из белковых и липидных соединений. Еще марганец способствует распространению нервных импульсов, т.к. участвует в синтезе веществ-нейромедиаторов.
Стимуляция марганцем метаболических процессов в мышечной ткани приводит к повышению мышечной силы и выносливости. Кроме того, марганец укрепляет кости. Еще он формирует хрящи, регулирует состав внутрисуставной или синовиальной жидкости. Тем самым Mn улучшает состояние и функцию суставов, препятствует развитию в них дегенеративных и воспалительных процессов.
Вместе с медью марганец участвует в кроветворении, стимулирует свертывание крови. А еще этот микроэлемент оказывает омолаживающее действие. Кожа под его влиянием становится упругой и эластичной. Замедляются естественные процессы, связанные со старением. Кроме того, марганец повышает устойчивость кожи к действию ультрафиолетовых лучей и препятствует развитию злокачественных кожных онкозаболеваний.
Влияние марганца на состояние органов и систем в немалой степени реализуется через эндокринную систему. Он усиливает действие инсулина. Именно благодаря этому усваивается глюкоза и снижается риск сахарного диабета. Еще этот микроэлемент оказывает стимулирующее действие на систему гипофиз-надпочечники. Марганец увеличивает выработку гормонов щитовидной железой.
Аналогичным образом Mn действует на мужские и женские половые гормоны. Он активирует сперматогенез у мужчин, участвует в регуляции менструального цикла у женщин, у обоих полов предупреждает бесплодие. При развившейся беременности марганец наряду с другими нутриентами формирует органы и ткани у плода. После родов марганец стимулирует лактацию.
Суточная потребность
Потребность в Mn зависит не только от возраста, но и от ряда других факторов.
При физических нагрузках, тяжело протекающих заболеваниях потребность в марганце увеличивается до 11 мг в сутки.
Причины и признаки дефицита
О дефиците марганца говорят в тех случаях, если его суточное поступление в организм взрослого человека составляет менее 1 мг. Основная причина – малое содержание в рационе натуральной пищи, содержащей марганец, преобладание рафинированных продуктов или продуктов, содержащих большое количество синтетических ингредиентов.
Кроме того, при многих заболеваниях ЖКТ (желудочно-кишечного тракта) будет ухудшаться всасывание марганца в тонком кишечнике. Этому же способствует прием препаратов, содержащих кальций и железо. Дело в том, что эти два минерала ухудшают всасывание марганца. С возрастом всасывание марганца ухудшается, и дефицит этого микроэлемента нередко наблюдается у лиц пожилого возраста.
Некоторые состояния сопровождаются усиленным расходом марганца:
- физические нагрузки (тяжелый труд, занятия спортом)
- умственные и психические нагрузки
- сахарный диабет
- хронические интоксикации на вредных производствах, проживание в экологически неблагоприятных регионах
- алкоголизм
- беременность
- период бурного роста
- «женские» заболевания с нарушением гормонпродуцирующей функцией яичников.
Сами по себе эти состояния не всегда приводят к марганцевому дефициту. Однако если они сочетаются между собой, а также с нерациональным питанием, заболеванием ЖКТ, то, скорее всего содержание марганца в организме будет снижено.
Признаки марганцевого дефицита неспецифичны, и во многом сходны с признаками дефицита других нутриентов. Отмечается общая слабость, ухудшение мыслительных функций, неустойчивость психики. Пациенты жалуются на головокружение, плохую координацию движений. Тонус мышц снижен, в отдельных случаях отмечаются мышечные судороги.
В костной ткани происходят изменения, аналогичные таковым при дефиците кальция. Снижается плотность костей, развивается остеопороз, возрастает риск переломов. В суставах формируется артроз, обусловленный дегенерацией суставного хряща. Среди других патологических состояний, связанных с дефицитом марганца: анемия, атеросклероз, снижение иммунитета.
Возрастает риск сахарного диабета, сердечно-сосудистых и онкологических заболеваний, аллергических реакций с кожной сыпью, отеками и бронхоспазмом. Рано появляются признаки старения; дряблая морщинистая кожа с пигментными пятнами, выпадение волос, замедление роста ногтей. Из-за гормонального дисбаланса нередко возникает бесплодие.
У детей недостаточность марганца чаще всего имеет пищевой характер, и часто сочетается с дефицитом других нутриентов. Такие дети отстают в психическом и физическом развитии. Они часто болеют инфекционными заболеваниями, страдают аллергиями. Иногда отмечается судорожный синдром.
Источники поступления
Марганец поступает к нам преимущественно с растительными продуктами. В животной пище его количество невелико.
Продукт Содержание, мг/100 г Ростки пшеницы 12,3 Хлеб из муки цельного помола 1,9 Фундук 4,9 Миндаль 1,92 Фисташки 3,8 Соя 1,42 Рис 1,1 Арахис 1,93 Какао-бобы 1,8 Горошек 0,3 Грецкий орех 1,9 Шпинат 0,9 Чеснок 0,81 Абрикос 0,2 Ананас 0,75 Свекла 0,66 Макаронные изделия 0,58 Капуста белокочанная 0,35 Картофель 0,35 Шиповник 0,5 Шампиньоны 0,7 Следует учитывать, что при рафинировании значительное количество марганца теряется. То же самое касается термической обработки, особенно варки. Поэтому предпочтение следует отдавать сырым продуктам, содержащим марганец.
Синтетические аналоги
Самый известный марганецсодержащий фармпрепарат – это калия перманганат, KMnO 4 , или попросту, марганцовка. Правда, марганцовку используют лишь в качестве наружного антисептического средства для лечения ран, ожогов кожи, полосканий ротоглотки при простудных заболеваниях.
Иногда перманганат калия принимают как рвотное средство в ходе промываний желудка при некоторых отравлениях. Хотя использование препарата в таком качестве весьма спорно. Во-первых, очень трудно подобрать оптимальную концентрацию. Концентрированная марганцовка может вызвать ожог слизистой полсти рта, пищевода и желудка. А во-вторых, некоторая часть марганца при приеме внутрь всасывается, и можно получить отравление марганцем.
Что касается марганецсодержащих препаратов для приема внутрь в виде капсул и таблеток, то это не фармацевтические средства, а БАДы.
Здесь соединения марганца часто сочетаются с другими минералами и витаминными. Эти препараты принимают как вспомогательные средства при иммунодефиците, остеопорозе, анемиях, психическом и физическом переутомлении, и других состояниях, связанных с повышенной потребности в марганце.
Метаболизм
Всасывание поступившего внутрь Mn (II), осуществляется на всем протяжении тонкого кишечника. Характерно, что всасываемость небольшая, около 5%. Остальная часть выводится с калом. Всосавшийся марганец по воротной вене поступает в печень, где он находится в свободной форме или в связанной с плазменными белками глобулинами.
Определенное количество Mn (II) окисляется до Mn (III), и в комплексе с белком-переносчиком транспортируется в органы и ткани. Здесь его содержание может существенно различаться. Максимум марганца в тканях органов, клетки которых содержат большое количество митохондрий. Это печень, поджелудочная железа, почки.
Миокард, мозговые структуры также содержат значительное количество марганца. Между тем, его уровень в плазме крови невелик, т.к. марганец довольно быстро транспортируется из крови в ткани. Выделяется марганец в преимущественно с калом, и в меньшей степени – с мочой. В кишечник он поступает в основном с желчью. При этом некоторая часть может обратно всасываться в кишечнике.
Кроме того, Mn из плазмы крови может секретироваться непосредственно в кишечник. При заболеваниях, сопровождающихся холестазом (застоем желчи) выделение марганца затрудняется. В этих случаях он секретируется в 12-перстную кишку с соком поджелудочной железы. Небольшое количество микроэлемента теряется с грудным молоком во время лактации.
Взаимодействие с другими веществами
Mn улучшает усваивание многих витаминов группы В, а также вит. Е и С. Он усиливает эффекты меди и цинка. Вместе с медью и железом марганец участвует в кроветворении. Однако в больших количествах он затрудняет всасывание железа. В свою очередь, железо ухудшает всасывание марганца. То же самое касается кальция, фосфора. Из пищевых продуктов на содержание Mn негативно влияют сладости, кофеин, алкоголь. Они ухудшают его всасывание или увеличивают расход.
Признаки избытка
Об избыточном поступлении марганца можно говорить, если его суточная дозировка превышает 40 мг. Добиться этого посредством одного лишь приема пищи, богатой марганцем нереально. Передозировкой марганецсодержащих средств – тоже. Ведь Mn представлен БАДами, и содержание микроэлемента в них невелико.
Правда, в редких случаях возможно острое отравление перманганатом калия. В основном же отравление марганцем носит хронический характер. Основная причина – это производственные ингаляционные отравления, когда происходит вдыхание соединений, содержащих марганец. При потреблении воды, загрязненной соединениями марганца, также можно получить отравление.
Марганцевая интоксикация проявляется общей слабостью, снижением мышечного тонуса, расстройствами координации движений. Нередко развивается анемия. Аппетит отсутствует, пищеварение нарушено, печень увеличена. Неврологические расстройства имеют такой же характер, как и при болезни Паркинсона. При тяжелых отравлениях развивается т.н. марганцевое безумие – неадекватность, раздражительность и галлюцинации с двигательным возбуждением.
Еще одна характерная черта хронической марганцевой интоксикации – это марганцевый рахит. Формируется он из-за того, что марганец, находясь в костной ткани в избыточном количестве, вытесняет оттуда кальций. Данное состояние лечится вит. D и препаратами кальция.
Мы стараемся дать максимально актуальную и полезную информацию для вас и вашего здоровья. Материалы, размещенные на данной странице, носят информационный характер и предназначены для образовательных целей. Посетители сайта не должны использовать их в качестве медицинских рекомендаций. Определение диагноза и выбор методики лечения остается исключительной прерогативой вашего лечащего врача! Мы не несёт ответственности за возможные негативные последствия, возникшие в результате использования информации, размещенной на сайте сайт
Марганец — элемент побочной подгруппы седьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 25. Обозначается символом Mn (лат. Manganum).
История открытия марганца
Известный естествоиспытатель и писатель древнего Рима Плиний Старший указывал на чудесную способность черного порошка осветлять стекло. Давно это вещество, дающее при размалывании черный порошок, называется пиролюзитом, или двуокисью марганца. О способности пиролюзита очищать стекло писал в 1540 г. и Ваноччио Бирингуччио. Пиролюзит является важнейшей рудой для получения марганца — металла, употребляемого главным образом в металлургии.
От слова «магнезия» получили свои названия марганец и магний. Происхождение наименования двух химических элементов от одного и того же слова объясняется тем, что пиролюзит долгое время противопоставлялся белой магнезии и назывался черной магнезией. После получения металла в чистом виде марганец был переименован. В основу названия было положено греческое слово «манганезе», что значило очищать (намек на его применение в древности в качестве «очистителя» стекла). Некоторые исследователи считают, что название элемента произошло от латинского слова «магнес» — магнит, так как пиролюзит, из которого добывают марганец, считался в древности разновидностью того вещества, которое теперь называется магнитным железняком.
Марганец был открыт в 1774 г. шведским химиком Карлом Вильгельмом Шееле. Правда, ни марганец, ни молибден, ни вольфрам Шееле не выделил в чистом виде; он только указал, что в исследованных им минералах содержатся эти новые элементы. Элемент №25 был обнаружен в минерале пиролюзите МnО 2 · Н 2 О, известном еще Плинию Старшему. Плиний считал его разновидностью магнитного железняка, хотя пиролюзит не притягивается магнитом. Этому противоречию Плиний дал объяснение.
В рукописях знаменитого алхимика Альберта Великого (XIII в.) этот минерал называется «магнезия». В XVI в. встречается уже название «манганезе», которое, возможно, дано стеклоделами и происходит от слова «манганидзейн» – чистить.
Когда Шееле в 1774 г. занимался исследованием пиролюзита, он посылал своему другу Юхану Готлибу Гану образцы этого минерала. Ган, впоследствии профессор, выдающийся химик своего времени, скатывал из пиролюзита шарики, добавляя к руде масло, и сильно нагревал пх в тигле, выложенном древесным углем. Получались металлические шарики, весившие втрое меньше, чем шарики из руды. Это и был марганец. Новый металл называли сначала «магнезия», но так как в то время уже была известна белая магнезия – окись магния, металл переименовали в «магнезиум»; это название и было принято Французской комиссией по номенклатуре в 1787 г. Но в 1808 г. Хэмфри Дэви открыл магнии и тоже назвал его «магнезиум»; тогда во избежание путаницы марганец стали называть «манганум. »
В России марганцем долгое время называли пиролюзит, пока в 1807 г. А.И. Шерер не предложил именовать марганцем металл, полученный из пиролюзита, а сам минерал в те годы называли черным марганцем.
Распространённость в природе марганца
Марганец — 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся в земной коре (0,03 % от общего числа атомов земной коры). В биосфере Марганец энергично мигрирует в восстановительных условиях и малоподвижен в окислительной среде. Наиболее подвижен Марганец в кислых водах тундры и лесных ландшафтов, где он находится в форме Мn 2+ . Содержание Марганца здесь часто повышено и культурные растения местами страдают от избытка Марганца. Весовое количество марганца увеличивается от кислых (600 г/т) к основным породам (2,2 кг/т). Сопутствует железу во многих его рудах, однако встречаются и самостоятельные месторождения марганца. В чиатурском месторождении (район Кутаиси) сосредоточено до 40 % марганцевых руд. Марганец, рассеянный в горных породах вымывается водой и уносится в Мировой океан. При этом его содержание в морской воде незначительно (10 −7 -10 −6 %), а в глубоких местах океана его концентрация возрастает до 0,3 % вследствие окисления растворённым в воде кислородом с образованием нерастворимого в воде оксида марганца, который в гидратированной форме (MnO 2 ·x H 2 O) и опускается в нижние слои океана, формируя так называемые железо-марганцевые конкреции на дне, в которых количество марганца может достигать 45 % (также в них имеются примеси меди, никеля, кобальта). Такие конкреции могут стать в будущем источником марганца для промышленности.
Этот металл распространен примерно так же, как сера или фосфор. Богатые залежи марганцевых руд находятся в Индии, Бразилии, Западной и Южной Африке.
В России является остродефицитным сырьём, известны месторождения: «Усинское» в Кемеровской области, «Полуночное» в Свердловской, «Порожинское» в Красноярском крае, «Южно-Хинганское» в Еврейской автономной области, «Рогачёво-Тайнинская» площадь и «Северо-Тайнинское» поле на Новой Земле.
Первый металлический марганец был получен при восстановлении пиролюзита древесным углем: МnО 2 + C → Mn + 2CO. Но это не был элементарный марганец. Подобно своим соседям по таблице Менделеева – хрому и железу, марганец реагирует с углеродом и всегда содержит примесь карбида. Значит, с помощью углерода чистый марганец не получить. Сейчас для получения металлического марганца применяют три способа: силикотермический (восстановление кремнием), алюминотермический (восстановление алюминием) и электролитический.
Наиболее широкое распространение нашел алюминотермический способ, разработанный в конце XIX в. В этом случае в качестве марганцевого сырья лучше применять не пиролюзит, а закись-окись марганца Mn 3 O 4 . Пиролюзит реагирует с алюминием с выделением такого большого количества тепла, что реакция легко может стать неуправляемой. Поэтому, прежде чем восстанавливать пиролюзит, его обжигают, а уже полученную закись-окись смешивают с алюминиевым порошком и поджигают в специальном контейнере. Начинается реакция 3Мn 3 O 4 + 8Аl → 9Мn + 4Аl 2 О 3 – достаточно быстрая и не требующая дополнительных затрат энергии. Полученный расплав охлаждают, скалывают хрупкий шлак, а слиток марганца дробят и отправляют на дальнейшую переработку.

Однако алюминотермический способ, как и силикотермический, не дает марганца высокой чистоты. Очистить алюминотермический марганец можно возгонкой, но этот способ малопроизводителен и дорог. Поэтому металлурги давно искали новые способы получения чистого металлического марганца и, естественно, прежде всего надеялись на электролитическое рафинирование. Но в отличие от меди, никеля и других металлов, марганец, откладывавшийся на электродах, не был чистым: его загрязняли примеси окислов. Более того, получался пористый, непрочный, неудобный для переработки металл.
Многие известные ученые пытались подобрать оптимальный режим электролиза марганцевых соединении, но безуспешно. Эту задачу разрешил и 1919 г. советский ученый Р.И. Агладзе (ныне действительный член Академии наук Грузинской ССР). По разработанной им технологии электролиза из хлористых и сернокислых солей получается достаточно плотный металл, содержащий до 99,98% элемента №25. Этот метод лег в основу промышленного получения металлического марганца.
Внешне этот металл похож на железо, только тверже его. На воздухе окисляется, но, как и у алюминия, пленка окисла быстро покрывает всю поверхность металла и препятствует дальнейшему окислению. С кислотами марганец реагирует быстро, с азотом образует нитриды, с углеродом – карбиды. В общем, типичный металл.
Физические свойства марганца
Плотность Марганца 7,2-7,4 г/см 3 ; t пл 1245 °С; t кип 2150 °С. Марганец имеет 4 полиморфные модификации: α-Мn (кубическая объемноцентрированная решетка с 58 атомами в элементарной ячейке), β-Мn (кубическая объемноцентрированная с 20 атомами в ячейке), γ-Мn (тетрагональная с 4 атомами в ячейке) и δ-Mn (кубическая объемноцентрированная). Температура превращений: α=β 705 °С; β=γ 1090 °С и γ=δ 1133 °С; α-модификация хрупка; γ (и отчасти β) пластична, что имеет важное значение при создании сплавов.
Атомный радиус Марганца 1,30 Å. ионные радиусы (в Å): Mn 2+ 0,91, Mn 4+ 0,52; Mn 7+ 0,46. Прочие физические свойства α-Mn: удельная теплоемкость (при 25°С) 0,478 кДж/(кг·К) [т. е. 0.114 ккал/(г·°С)]; температурный коэффициент линейного расширения (при 20°С) 22,3·10 -6 град -1 ; теплопроводность (при 25 °С) 66,57 Вт/(м·К) [т. е. 0,159 кал/(см·сек·°С)]; удельное объемное электрическое сопротивление 1,5-2,6 мком·м (т. е. 150-260 мком·см): температурный коэффициент электрического сопротивления (2-3)·10 -4 град -1 . Марганец парамагнитен.
Химические свойства марганца
Марганец достаточно активен, при нагревании энергично взаимодействует с неметаллами — кислородом (образуется смесь оксидов Марганца разной валентности), азотом, серой, углеродом, фосфором и другими. При комнатной температуре Марганец на воздухе не изменяется: очень медленно реагирует с водой. В кислотах (соляной, разбавленной серной) легко растворяется, образуя соли двухвалентного Марганца. При нагревании в вакууме Марганец легко испаряется даже из сплавов.
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде (Mn + O 2 → MnO 2). Марганец при нагревании разлагает воду, вытесняя водород (Mn + 2H 2 O →(t) Mn(OH) 2 + H 2 ), образующийся гидроксид марганца замедляет реакцию.
Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды.
Углерод реагирует с расплавленным марганцем образуя карбиды Mn 3 C и другие. Образует также силициды, бориды, фосфиды.
C соляной и серной кислотами реагирует по уравнению:
Mn + 2H + → Mn 2+ + H 2
С концентрированной серной кислотой реакция идёт по уравнению:
Mn + 2H 2 SO 4 (конц.) → MnSO 4 + SO 2 + 2H 2 O
В щелочном растворе марганец устойчив.
Марганец образует следующие оксиды: MnO, Mn 2 O 3 , MnO 2 , MnO 3 (не выделен в свободном состоянии) и марганцевый ангидрид Mn 2 O 7 .
Mn 2 O 7 в обычных условиях жидкое маслянистое вещество тёмно-зелёного, очень неустойчивое; в смеси с концентрированной серной кислотой воспламеняет органические вещества. При 90 °C Mn 2 O 7 разлагается со взрывом. Наиболее устойчивы оксиды Mn 2 O 3 и MnO 2 , а также комбинированный оксид Mn 3 O 4 (2MnO·MnO 2 , или соль Mn 2 MnO 4).
При сплавлении оксида марганца (IV) (пиролюзит) со щелочами в присутствии кислорода образуются манганаты:
2MnO 2 + 4KOH + O 2 → 2K 2 MnO 4 + 2H 2 O
Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает реакция:
3K 2 MnO 4 + 3H 2 SO 4 → 3K 2 SO 4 + 2HMnO 4 + MnO(OH) 2 ↓ + H 2 O
Раствор окрашивается в малиновый цвет из-за появления аниона MnO 4 − и из него выпадает коричневый осадок гидроксида марганца (IV).
Марганцевая кислота очень сильная, но неустойчивая, её невозможно сконцентрировать более, чем до 20 %. Сама кислота и её соли (перманганаты) — сильные окислители. Например, перманганат калия в зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца (II), в нейтральной — до соединений марганца (IV), в сильно щелочной — до соединений марганца (VI).
При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Реакция идёт по уравнению (на примере перманганата калия):
2KMnO 4 →(t) K 2 MnO 4 + MnO 2 + O 2
Под действием сильных окислителей ион Mn 2+ переходит в ион MnO 4 − :
2MnSO 4 + 5PbO 2 + 6HNO 3 → 2HMnO 4 + 2PbSO 4 + 3Pb(NO 3) 2 + 2H 2 O
Эта реакция используется для качественного определения Mn 2+
При подщелачивании растворов солей Mn (II) из них выпадает осадок гидроксида марганца (II), быстро буреющий на воздухе в результате окислления.
Применение марганца в промышленности
Марганец содержится во всех видах стали и чугуна. Способность марганца давать сплавы с большинством известных металлов используется для получения не только различных сортов марганцевой стали, но и большого числа нежелезных сплавов (манганинов). Из них особенно замечательными являются сплавы марганца с медью (марганцевая бронза). Она, подобно стали, может закаляться и в то же время намагничиваться, хотя ни марганец, ни медь не обнаруживают заметных магнитных свойств.
Биологическая роль марганца и его содержание в живых организмах
Марганец содержится в организмах всех растений и животных, хотя его содержание обычно очень мало, порядка тысячных долей процента, он оказывает значительное влияние на жизнедеятельность, то есть является микроэлементом. Марганец оказывает влияние на рост, образование крови и функции половых желёз. Особо богаты марганцем листья свёклы — до 0,03 %, а также большие его количества содержатся в организмах рыжих муравьёв — до 0,05 %. Некоторые бактерии содержат до нескольких процентов марганца.
Марганец активно влияет на обмен белков, углеводов и жиров. Важной также считается способность марганца усиливать действие инсулина и поддерживать определенный уровень холестерина в крови. В присутствии марганца организм полнее использует жиры. Сравнительно богаты этим микроэлементом крупы (в первую очередь овсяная и гречневая), фасоль, горох, говяжья печень и многие хлебобулочные изделия, которыми практически восполняется суточная потребность человека в марганце — 5,0-10,0 мг.
Не стоит забывать, что соединения марганца могут оказывать токсичное действие на организм человека. Предельно допустимая концентрация марганца в воздухе 0.3 мг/м 3 . При выраженном отравлении наблюдается поражение нервной системы с характерным синдромом марганцевого паркинсонизма.
Объёмы производства марганцевой руды в России
Марганецкий ГОК – 29%
Месторождение марганцевых руд было открыто в 1883 году. В 1985 г. на базе этого месторождения начал добычу руды Покровский рудник. По мере развития рудника и возникновения новых карьеров и шахт сформировался Марганецкий ГОК.
В составе производственной структуры комбината: два карьера для открытой добычи марганцевой руды, пять шахт для подземной добычи, три обогатительных фабрики, а также необходимые вспомогательные цеха и службы, в т.ч. ремонтно-механический, транспортный и пр.Орджоникидзевский ГОК – 71%
Основным видом выпускаемой продукции является марганцевый концентрат различных сортов с содержанием чистого марганца от 26% до 43% (в зависимости от сортности). Попутные продукты — керамзитовая глина и шламы.
Добычу марганцевой руды предприятие ведется на закрепленных за ним рудных полях. Запасов руд хватит на срок более 30 лет. Запасы марганцевой руды в Украине суммарно по Орджоникидзевскому и Марганцевому горно-обогатительным комбинатам составляет треть всех мировых запасов.
Получил краску, которая и сейчас называется «зелень Шееле», арсин (AsH 3), глицерин, мочевую и синильную кислоты. Правда, ни марганец, ни молибден, ни вольфрам Шееле не выделил в чистом виде; он только указал, что в исследованных им минералах содержатся эти новые элементы.
Элемент № 25 был обнаружен в минерале пиролюзите MnO 2 -H 2 O, известном еще Плинню Старшему. Плиний считал его разновидностью магнитного железняка, хотя пиролюзит не притягивается магнитом. Этому противоречию Плиний дал объяснение. Нам оно кажется забавным, но не нужно забывать, что в I в. н.э. ученые знали о веществах много меньше, чем нынешние школьники. Но Плинию, пиролюзит — это «ляпис магнес» (магнитный железняк), только он женского пола, и именно поэтому магнит к нему «равнодушен». Тем не менее «черную магнезию» (так тогда называли пиролюзит) стали использовать при варке стекла, поскольку она обладает замечательным свойством осветлять стекло. Это происходит оттого, что при высокой температуре двуокись марганца отдает часть своего кислорода и превращается в окисел состава Mn 2 O 3 . Освободившийся кислород окисляет сернистые соединения железа , придающие стеклу темную окраску. Как «осветлитель» стекла пиролюзит применяют и сейчас.
История марганца
В рукописях знаменитого алхимика Альберта Великого (XIII в.) этот минерал называется «магнезия». В XVI в. встречается уже название «манганезе», которое, возможно, дано стеклоделами и происходит от слова «манганидзейн» — чистить.
Когда Шееле в 1774 г. занимался исследованием пиролюзита, он посылал своему другу Юхану Готлибу Гану образцы этого минерала. Ган, впоследствии профессор, выдающийся химик своего времени, скатывал из пиролюзита шарики, добавляя к руде масло, и сильно нагревал их в тигле, выложенном древесным углем. Получались металлические шарики, весившие втрое меньше, чем шарики из руды. Это и был марганец. Новый металл называли сначала «магнезия», но так как в то время уже была известна белая магнезия — окись магния , металл переименовали в «магнезнум»; это название и было принято Французской комиссией по номенклатуре в 1787 г. Но в 1808 г. Хэмфри Дэви открыл магний и тоже назвал его «магнезиум»; тогда во избежание путаницы марганец стали называть «манганум».
В России марганцем долгое время называли пиролюзит, пока в 1807 г. Л. И. Шерер не предложил именовать марганцем металл, полученный из пиролюзита, а сам минерал в те годы называли черным марганцем.
Марганцевые руды
В чистом виде марганец в природе не встречается. В рудах он присутствует в виде окислов, гидроокисей и карбонатов. Основной минерал, содержащий марганец, — это все тот же пиролюзит, относительно мягкий темно-серый камень. В нем 63,2% марганца. Есть и другие марганцевые руды: псиломелан , браунит , гаусманит , манганит . Все это окислы и силикаты элемента № 25. Валентность марганца в них равна 2, 3 и 4. Есть еще один потенциальный источник элемента № 25 — конкреции, залегающие на дне океанов и аккумулирующие марганец и другие металлы. Но о них разговор особый.
Марганцевые руды делят на химические и металлургические. Первые содержат не меньше 80% MnO 2 . Их используют в гальванических элементах (двуокись марганца — отличный деполяризатор), в производстве стекла, керамики, минеральных красителей, «марганцовки » (KMnO 4) и некоторых других продуктов химической промышленности.
И железо — соседи не только по таблице Менделеева, в марганцевых рудах всегда присутствует железо. А вот в железных рудах марганец (в достаточном количестве), к сожалению, есть не всегда. К сожалению — потому, что элемент № 25 — одна из важнейших легирующих добавок.
Месторождения марганцевых руд есть на всех континентах. На долю нашей страны приходится около 50% мировой добычи марганцевых руд. Богаты марганцем также Индия, Гана, Марокко, Бразилия, ЮжноАфриканская Республика. Большинство же промышленно развитых стран вынуждено ввозить марганцевую руду из-за рубежа, так как их собственные месторождения не удовлетворяют нужд черной металлургии ни по количеству, ни по качеству руды. Наша страна не только полностью обеспечивает свою металлургию высококачественной марганцевой рудой, но и экспортирует ее в значительных количествах.
До Великой Отечественной войны в СССР марганцевую руду добывали в двух районах — в Чиатуре (Грузия) и около Никополя (Украина). Когда во время войны Никопольский бассейн оккупировали фашисты, в неслыханно короткий срок были освоены новые месторождения марганцевых руд на Урале и в Казахстане. Советская черная металлургия получила достаточно марганца и смогла дать высококачественную сталь для танковой брони и артиллерийских орудий.
Чистый марганец
Уже упоминалось, что первый металлический марганец был получен при восстановлении пиролюзита древесным углем: MnO 2 + C → Mn + 2СО. Но это не был элементный марганец. Подобно своим соседям по таблице Менделеева — хрому и железу, марганец реагирует с углеродом и всегда содержит примесь карбида. Значит, с помощью углерода чистый марганец не получить. Сейчас для получения металлического марганца применяют три способа: силикотермический (восстановление кремнием), алюминотермический (восстановление алюминием) и электролитический.
Наиболее широкое распространение нашел алюминотермический способ, разработанный в конце XIX в. В этом случае в качестве марганцевого сырья лучше применять не пиролюзит, а закись-окись марганца Mn 3 O 4 . Пиролюзит реагирует с алюминием с выделением такого большого количества тепла, что реакция легко может стать неуправляемой. Поэтому, прежде чем восстанавливать пиролюзит, его обжигают, а уже полученную закись-окись смешивают с алюминиевым порошком и поджигают в специальном контейнере. Начинается реакция 3Mn 3 O 4 + 8Аl → 9Mn + 4Al 2 O 3 — достаточно быстрая и не требующая дополнительных затрат энергии. Полученный расплав охлаждают, скалывают хрупкий шлак, а слиток марганца дробят и отправляют на дальнейшую переработку.
Однако алюминотермический способ, как и силикотермический, не дает марганца высокой чистоты. Очистить алюминотермический марганец можно возгонкой, но этот способ малопроизводителен и дорог. Поэтому металлурги давно искали новые способы получения чистого металлического марганца и, естественно, прежде всего надеялись на электролитическое рафинирование. Но в отличие от меди , никеля и других металлов, марганец, откладывавшийся на электродах, не был чистым: его загрязняли примеси окислов. Более того, получался пористый, непрочный, неудобный для переработки металл.
Многие известные ученые пытались подобрать оптимальный режим электролиза марганцевых соединений, но безуспешно. Эту задачу разрешил в 1939 г. советский ученый Р. И. Агладзе (впоследствии действительный член Академии наук Грузинской ССР). По разработанной им технологии электролиза из хлористых и сернокислых солей получается достаточно плотный металл, содержащий до 99,98% элемента № 25. Этот метод лег в основу промышленного получения металлического марганца.
Внешне этот металл похож на железо, только тверже его. На воздухе окисляется, но, как и у алюминия, пленка окисла быстро покрывает всю поверхность металла и препятствует дальнейшему окислению. С кислотами марганец реагирует быстро, с азотом образует нитриды, с углеродом — карбиды. В общем, типичный металл.
Марганец обычно вводят в сталь вместе с другими элементами — хромом, кремнием, вольфрамом. Однако есть сталь, в состав которой, кроме железа, марганца и углерода, ничего не входит. Это так называемая сталь Гадфилда. Она содержит 1-1,5% углерода и 11-15% марганца. Сталь этой марки обладает огромной износостойкостью и твердостью. Ее применяют для изготовления дробилок, которые перемалывают самые твердые породы, деталей экскаваторов и бульдозеров. Твердость этой стали такова, что она не поддается механической обработке, детали из нее можно только отливать. А вообще сталей, содержащих марганец, довольно много. Точнее, нет ни одной стали, которая не содержала бы марганца в тех или иных количествах. Ведь марганец приходит в сталь из чугуна. Однако иногда его количества настолько малы, что букву Г в марку стали не вставляют. Впрочем, марганцем улучшают свойства не только железа. Так, сплавы марганца с медью обладают высокой прочностью и коррозионной стойкостью. Из этих сплавов делают лопатки турбин, а из марганцовистых бронз — винты самолетов и другие авиадетали.
Марганец не блестит, как золото , не льется, как , не вспыхивает на воздухе, как натрий . Но этот внешне ничем не примечательный серый металл жизненно важен: пока в технике главенствует железо, будет необходим и его верный спутник — марганец.
Марганец в организме
Еще в начале прошлого века было известно, что марганец входит в состав живых организмов. Сейчас установлено, что незначительные количества марганца есть во всех растительных и животных организмах. Нет его только в белке куриного яйца и очень мало — в молоке. В организме марганец распределяется неравномерно. Например, в 100 г сухого вещества стеблей винограда содержится 191 мг марганца, корней — 130 мг, а ягод — всего 70 мг. В крови человека и большинства животных содержание марганца составляет около 0,02 мг/л. Исключение составляют овцы, кровь которых богаче марганцем — 0,06 мг/л. Установлено, что марганец играет значительную роль в обмене веществ. В растениях он ускоряет образование хлорофилла и повышает их способность синтезировать витамин С. Поэтому внесение марганца в почву заметно повышает урожайность многих культур, в частности озимой пшеницы и хлопчатника.
Отсутствие марганца в пище животных сказывается на их росте и жизненном тонусе. Мыши, которых кормили одним молоком, содержащим очень мало марганца, теряли способность к размножению. Когда же к их пище начали добавлять хлористый марганец, эта способность восстановилась.
Элемент № 25 влияет и на процессы кроветворения. Кроме того, он ускоряет образование антител, нейтрализующих вредное действие чужеродных белков. Один из немецких ученых вводил морским свинкам смертельные дозы столбнячных и дизентерийных бактерий. Если после этого вводилась только противостолбнячная и противодизентерийная сыворотка, то животным она уже не помогала. Введение сыворотки и хлористого марганца излечивало морских свинок. Внутривенным вливанием раствора сульфата марганца удается спасать укушенных каракуртом — ядовитейшим из среднеазиатских пауков.
Принадлежит VII группе. Расположен в четвертом периоде между хромом и железом. Имеет 25-й атомный номер. Формула марганца 3d 5 4s 2 .
Был открыт в 1774 году. Атом марганца весит 54,938045. Содержит изотоп 55Mn, а природный марганец состоит полностью из него. Степень окисления металла колеблется от 2 до 7. Электроотрицательность Mn — 1,55. Переходный материал.
Соединения марганец 2 образуют оксид и диоксид. Проявляют основные свойства элемента. Образования марганец 3 и марганец 4 отличаются амфотерными свойствами. В комбинациях металла 6 и 7 лидируют свойства кислоты марганца . Элемент № 25 образует многочисленные виды солей и различные бинарные соединения.
Добыча марганца ведется повсеместно как в России, так и в ближнем зарубежье. На Украине существует особый Марганец – город , расположенный на многочисленных образованиях марганцевой руды.
Описание и свойства марганца
Серебристо-белый цвет с легким серым налетом выделяет марганец. Состав элемента имеет примесь углерода, которая дает ему серебристо-белый цвет. Он превосходит железо по твердости и хрупкости. В виде мелких абразивов пирофорен.

При взаимодействии с воздушной средой происходит окисление марганца . Покрывается оксидной пленкой, защищающей его от последующей окислительной реакции.
Растворяется в воде, полностью поглощает водород, не вступая в реакцию с ним. В процессе нагревания сгорает в кислороде. Активно реагирует с хлором и серой. При взаимодействии с кислотными окислителями образует соли марганца .
Плотность — 7200 кг/м3, t плавления — 1247°С, t кипения — 2150 °С. Удельная теплоемкость — 0,478 кДж. Обладает электрической проводимостью. Контактируя с хлором, бромом и йодом образует дигалогениды.

При высоких температурах вступает во взаимодействие с азотом, фосфором, кремнием и бором. Медленно взаимодействует с холодной водой. В процессе нагревания реакционная способность элемента возрастает. На выходе образуется Mn(OH)2 и водород. При соединении марганца с кислородом образуется оксид марганца . Выделяют семь его групп:
Оксид марганца (II). Монооксид. Не взаимодействует с водой. Легко окисляется, образуя хрупкую корку. При нагревании с водородом и металлами активной группы восстанавливается до марганца. Имеет зеленый и серо-зеленый цвет кристаллов. Полупроводник.
Оксид марганца (II,III). Кристаллы коричневого – черного цвета Mn3O4. Парамагнетик. В естественной среде встречается как минерал гаусманит.
Оксид марганца (II,IV). Соединение неорганического характера Mn5O8. Может рассматриваться как ортоманганит марганца . Не растворяется в H 2 O.

Оксид марганца (III).Кристаллы коричневого – черного цвета Mn2O3. Не вступают в реакцию с водой. Встречается в природной среде в минералах браунит, курнакит и биксбиит.
Оксид марганца (IV) или диоксид марганца MnO2. Нерастворимый в воде порошок темно-коричневого оттенка. Устойчивое образование марганца. Содержится в минерале пиролюзит. Поглощает хлор и соли тяжелых металлов.
Оксид марганца (VI) . Темно-красный аморфный элемент. Вступает в реакцию с водой. Полностью разлагается при нагревании. Щелочные реакции образуют солевые отложения.
Оксид марганца (VII). Маслянистая зеленовато-бурая жидкость Mn2O7. Сильный окислитель. При контакте с горючими смесями, мгновенно воспламеняет их. Может взорваться от толчка, резкой и яркой вспышки света, взаимодействия с органическими компонентами. При взаимодействии с Н 2 O образует марганцовую кислоту.

Соли марганца являются катализаторами окислительных процессов, происходящих с участием кислорода. Они применяются в сиккативах. Льняное масло с добавлением такого сиккатива именуется олифой.
Применение марганца
Mn широко используют в черной металлургии. Добавляют сплав железо марганец (ферромарганец). Доля марганца в нем равна 70-80%, углерода 0,5-7 %, остальная часть приходится на железо и посторонние примеси. Элемент №25 в сталеплавлении соединяет кислород и серу.
Используются смеси хром — марганец , -марганец, кремний-марганец. В производстве стали марганцу альтернативной замены нет.
Химический элемент выполняет множество функций, в том числе рафинирует и раскисляет сталь. Широко используется технология цинк марганец . Растворимость Zn в магнии составляет 2 %, а прочность стали, в этом случае, возрастает до 40 %.
В доменной шахте марганец удаляет серный налет из чугуна. В технике применяются тройные сплавы манганины, куда входит марганец медь и никель. Материал характеризуется большим электро-сопротивлением на которое влияет не температура, а сила давления.

Используется для изготовления манометров. Настоящей ценностью для промышленности является сплав медь — марганец. Содержание марганца здесь 70 %, меди 30%. Его применяют для снижения вредных производственных шумов. В изготовлении взрыв-пакетов для праздничных мероприятий используют смесь, куда входят такие элементы, как магний марганец . Магний широко используется в самолетостроении.
Некоторые виды солей марганца, такие как KMnO4 нашли свое применение в медицинской отрасли. Перманганат калия относится к солям марганцовой кислоты. Имеет вид темно-фиолетовых . Растворяется в водной среде, окрашивая её в фиолетовый цвет.
Является сильным окислителем. Антисептик, обладает противомикробными свойствами. Марганец в воде легко окисляется, образуя плохо растворимый оксид марганца коричневого цвета.
При соприкосновении с белком ткани формирует соединения с выраженными вяжущими качествами. В высоких концентрациях раствор марганца обладает раздражающим и прижигающим действием.
Калий марганец используют для лечения некоторых заболеваний и для оказания первой помощи, а пузырек с кристаллами марганцовки находится в каждой аптечки.

Марганец полезен для человеческого здоровья. Участвует в формировании и развитии клеток центрально-нервной системы. Способствует усвоению витамина В1, и железа. Регулирует содержание сахара в крови. Задействуется в строительстве костной ткани.
Участвует в образовании жирных кислот. Улучшает рефлекторные способности, память, убирает нервное напряжение, раздражительность. Абсорбируясь в стенках кишечника марганец, витамины В, Е, фосфор, кальций усиливают этот процесс, влияет на организм и обменные процессы в целом.
Минералы, незаменимые для человека, такие как кальций, магний, марганец , медь, калий, железо добавляют в витаминно-минеральные комплексы для устранения витаминного дефицита.
Также микроэлементы цинк, марганец и железо играют огромную роль в жизни растений. Входят в состав фосфорных и минеральных удобрений.
Цена марганца
Металлический марганец содержит до 95 % чистого марганца. Его применяют в сталелитейной металлургической промышленности. Удаляет из стали ненужные примеси и наделяет её легирующими качествами.
Ферромарганец используется для раскисления сплава во время процесса плавления, путем удаления из него кислорода. Связывает частицы серы между собой, улучшая качественные характеристики стали. Марганец упрочняет материал, делает его более износостойким.
Применяют металл при создании шаровых мельниц, землеройных и камнедробильных машин, броневых элементов. Из сплава мангадин изготавливают реостаты. Элемент № 25 добавляют в бронзу и .

Большой процент диоксида марганца потребляется для создания гальванических элементов. с добавлением Mn задействуется в тонком органическом и промышленном синтезе. Соединения MnO2 и KMnO4 выступают окислителями.
Марганец – вещество незаменимое в черной металлургии. Уникален по своим физическим и химическим характеристикам. Марганец купить можно в специализированных торговых точках. Пять килограмм металла стоит порядка 150 рублей, а тонна, в зависимости вида соединения, стоит около 100-200 тысяч рублей.
Mn Марганец

МАРГАНЕЦ (лат. Manganum), Mn, химический элемент с атомным номером 25, атомная масса 54,9380. Химический символ элемента Mn произносится так же, как и название самого элемента. Природный марганец состоит только из нуклида 55 Mn. Конфигурация двух внешних электронных слоев атома марганца 3s 2 p 6 d 5 4s 2 . В периодической системе Д. И. Менделеева марганец входит в группу VIIВ, к которой относятся также технеций и рений, и располагается в 4-м периоде. Образует соединения в степенях окисления от +2 (валентность II) до +7 (валентность VII), наиболее устойчивы степени окисления +2 и +7. У марганца, как и у многих других переходных металлов, известны также соединения, содержащие атомы марганца в степени окисления 0.
Радиус нейтрального атома марганца 0,130 нм, радиус иона Mn 2+ 0,080-0,104 нм, иона Mn 7+ 0,039-0,060 нм. Энергии последовательной ионизации атома марганца 7,435, 15,64, 33,7, 51,2, 72,4 эВ. По шкале Полинга электроотрицательность марганца 1,55; марганец принадлежит к числу переходных металлов.
Марганец в компактном виде твердый серебристо-белый металл.
Физические и химические свойства: марганец твердый хрупкий металл. Известны четыре кубические модификации металлического марганца. При температурах от комнатной и до 710°C устойчив a-Mn, параметр решетки а = 0,89125 нм, плотность 7,44 кг/дм 3 . В интервале температур 710-1090°C существует b-Mn, параметр решетки а = 0,6300 нм; при температурах 1090-1137°C g-Mn, параметр решетки а = 0,38550 нм. Наконец, при температуре от 1137°C и до температуры плавления (1244°C) устойчив d-Mn с параметром решетки а = 0,30750 нм. Модификации a, b, и d хрупкие, g-Mn пластичен. Температура кипения марганца около 2080°C.
На воздухе марганец окисляется, в результате чего его поверхность покрывается плотной оксидной пленкой, которая предохраняет металл от дальнейшего окисления. При прокаливании на воздухе выше 800°C марганец покрывается окалиной, состоящей из внешнего слоя Mn 3 O 4 и внутреннего слоя состава MnO.
Марганец образует несколько оксидов: MnO, Mn 3 O 4 , Mn 2 O 3 , MnO 2 и Mn 2 O 7 . Все они, кроме Mn 2 O 7 , представляющего собой при комнатной температуре маслянистую зеленую жидкость с температурой плавления 5,9°C, твердые кристаллические вещества.
Монооксид марганца MnO образуется при разложении солей двухвалентного марганца (карбоната и других) при температуре около 300°C в инертной атмосфере:
MnCO 3 = MnO + CO 2
Этот оксид обладает полупроводниковыми свойствами. При разложении MnOОН можно получить Mn 2 O 3 . Этот же оксид марганца образуется при нагревании MnO 2 на воздухе при температуре примерно 600°C:
4MnO 2 = 2Mn 2 O 3 + O 2
Оксид Mn 2 O 3 восстанавливается водородом до MnO, а под действием разбавленных серной и азотной кислот переходит в диоксид марганца MnO 2 .
Если MnO 2 прокаливать при температуре около 950°C, то наблюдается отщепление кислорода и образование оксида марганца состава Mn 3 O 4:
3MnO 2 = Mn 3 O 4 + O 2
Этот оксид можно представить как MnO·Mn 2 О 3 , и по свойствам Mn 3 О 4 соответствует смеси этих оксидов.
Диоксид марганца MnO 2 наиболее распространенное природное соединение марганца в природе, существующее в нескольких полиморфных формах. Так называемая b-модификация MnO 2 это уже упоминавшийся минерал пиролюзит. Ромбическая модификация диоксида марганца, g-MnO 2 также встречается в природе. Это минерал рамсделит (другое название полианит).
Диоксид марганца нестехиометричен, в его решетке всегда наблюдается дефицит кислорода. Если оксиды марганца, отвечающие его более низким степеням окисления, чем +4, основные, то диоксид марганца обладает амфотерными свойствами. При 170°C MnO 2 можно восстановить водородом до MnO.
Если к перманганату калия KMnO 4 добавить концентрированную серную кислоту, то образуется кислотный оксид Mn 2 O 7 , обладающий сильными окислительными свойствами:
2KMnO 4 + 2H 2 SO 4 = 2KHSO 4 + Mn 2 O 7 + H 2 O.
Mn 2 O 7 кислотный оксид, ему отвечает сильная, не существующая в свободном состоянии марганцовая кислота НMnO 4 .
При взаимодействии марганца с галогенами образуются дигалогениды MnHal 2 . В случае фтора возможно также образование фторидов состава MnF 3 и MnF 4 , а в случае хлора также трихлорида MnCl 3 . Реакции марганца с серой приводят к образованию сульфидов составов MnS (существует в трех полиморфных формах) и MnS 2 . Известна целая группа нитридов марганца: MnN 6 , Mn 5 N 2 , Mn 4 N, MnN, Mn 6 N 5 , Mn 3 N 2 .
С фосфором марганец образует фосфиды составов MnР, MnP 3 , Mn 2 P, Mn 3 P, Mn 3 P 2 и Mn 4 P. Известно несколько карбидов и силицидов марганца.
С холодной водой марганец реагирует очень медленно, но при нагревании скорость реакции значительно возрастает, образуется Mn(OH) 2 и выделяется водород. При взаимодействии марганца с кислотами образуются соли марганца (II):
Mn + 2HCl = MnCl 2 + H 2 .
Из растворов солей Mn 2+ можно осадить плохо растворимое в воде основание средней силы Mn(OH) 2:
Mn(NO 3) 2 + 2NaOH = Mn(OH) 2 + 2NaNO 3
Марганцу отвечает несколько кислот, из которых наиболее важны сильные неустойчивые марганцоватая кислота H 2 MnO 4 и марганцовая кислота HMnO 4 , соли которых соответственно, манганаты (например, манганат натрия Na 2 MnO 4) и перманганаты (например, перманганат калия KMnO 4).
Манганаты (известны манганаты только щелочных металлов и бария) могут проявлять свойства как окислителей (чаще)
2NaI + Na 2 MnO 4 + 2H 2 O = MnO 2 + I 2 + 4NaOH,
так и восстановителей
2K 2 MnO 4 + Cl 2 = 2KMnO 4 + 2KCl.
В водных растворах манганаты диспропорционируют на соединения марганца (+4) и марганца (+7):
3K 2 MnO 4 + 3Н 2 О = 2KMnO 4 + MnO 2 ·Н 2 О + 4КОН.
При этом окраска раствора из зеленой переходит в синюю, затем в фиолетовую и малиновую. За способность изменять окраску своих растворов К. Шееле назвал манганат калия минеральным хамелеоном.
Перманганаты сильные окислители. Например, перманганат калия KMnO 4 в кислой среде окисляет сернистый газ SO 2 до сульфата:
2KMnO 4 + 5SO 2 +2H 2 O = K 2 SO 4 + 2MnSO 4 + 2H 2 SO 4 .
При давлении около 10 МПа безводный MnCl 2 в присутствии металлоорганических соединений реагирует с оксидом углерода (II) CO с образованием биядерного карбонила Mn 2 (CO) 10 .
История открытия: один из основных материалов марганца пиролюзит был известен в древности как черная магнезия и использовался при варке стекла для его осветления. Его считали разновидностью магнитного железняка, а тот факт, что он не притягивается магнитом, Плиний Старший объяснил женским полом черной магнезии, к которому магнит «равнодушен». В 1774 г. шведский химик К. Шееле показал, что в руде содержится неизвестный металл. Он послал образцы руды своему другу химику Ю. Гану, который, нагревая в печке пиролюзит с углем, получил металлический марганец. В начале 19 в. для него было принято название «манганум» (от немецкого Manganerz марганцевая руда).
Нахождение в природе: в земной коре содержание марганца составляет около 0,1 % по массе. В свободном виде марганец не встречается. Из руд наиболее распространены пиролюзит MnO 2 (содержит 63,2 % марганца), манганит MnO 2 ·Mn(OH) 2 (62,5 % марганца), браунит Mn 2 O 3 (69,5 % марганца), родохрозит MnCo 3 (47,8 % марганца), псиломелан mMnO·MnO 2 ·nH 2 O (45-60% марганца) и ряд других. Марганец содержат железо-марганцевые конкреции, которые в больших количествах (сотни миллиардов тонн) находятся на дне Тихого, Атлантического и Индийского океанов. В морской воде содержится около 1,0·10 8 % марганца. Промышленного значения эти запасы марганца пока не имеют из-за сложности подъема конкреций на поверхность.
Получение: промышленное получение марганца начинается с добычи и обогащения руд. Если используют карбонатную руду марганца, то ее предварительно подвергают обжигу. В некоторых случаях руду далее подвергают сернокислотному выщелачиванию. Затем обычно марганец в полученном концентрате восстанавливают с помощью кокса (карботермическое восстановление). Иногда в качестве восстановителя используют алюминий или кремний. Для практических целей чаще всего используют ферромарганец, полученный в доменном процессе при восстановлении руд железа и марганца коксом. В ферромарганце содержание углерода составляет 6-8 % по массе.
Чистый марганец получают электролизом водных растворов сульфата марганца MnSO 4 , который проводят в присутствии сульфата аммония (NH 4) 2 SO 4 .
Применение: более 90% производимого марганца идет в черную металлургию. Марганец используют как добавку к сталям для их раскисления, десульфурации (при этом происходит удаление из стали нежелательных примесей кислорода, серы и других), а также для легирования сталей, т. е. улучшения их механических и коррозионных свойств. Марганец применяется также в медных, алюминиевых и магниевых сплавах. Покрытия из марганца на металлических поверхностях обеспечивают их антикоррозионную защиту. Для нанесения тонких покрытий из марганца используют легко летучий и термически нестабильный биядерный декакарбонил Mn 2 (CO) 10 .
Соединения марганца (карбонат, оксиды и другие) используют при производстве ферритных материалов, они служат катализаторами многих химических реакций, входят в состав микроудобрений.
Биологическая роль: марганец микроэлемент , постоянно присутствующий в живых организмах и необходимый для их нормальной жизнедеятельности. Содержание марганца в растениях составляет 10 4 -10 2 %, в животных 10 3 -10 5 %, некоторые растения (водяной орех, ряска, диатомовые водоросли) и животные (муравьи, устрицы, ряд ракообразных) способны концентрировать марганец. В организме среднего человека (масса тела 70 кг) содержится 12 мг марганца. Марганец необходим животным и растениям для нормального роста и размножения. Он активирует ряд ферментов, участвует в процессах дыхания, фотосинтеза, влияет на проветривание и минеральный обмен.
Что необходимо загрузить в доменную печь для получения чугуна

Доменный процесс относится к типу противоточных. Навстречу поднимающемуся потоку горячих газов, образующихся при сгорании кокса у фурм, опускается столб шихтовых материалов.
Газовый поток, содержащий СO, СO2, Н2, N2 и др., образуется в результате горения углерода кокса. При этом в печи несколько выше уровня фурм развивается температура более 2000 °С. Горячие газы, поднимаясь, отдают теплоту шихтовым материалам, охлаждаются до температуры 200 – 300 °С и выходят из печи через колошник. Отсюда название газа – колошниковый.
Полезный объем доменной печи постоянно заполнен шихтовыми материалами. Опускание шихты происходит под действием ее веса, а условием ее движения является освобождение пространства в нижней части доменной печи в результате сгорания кокса и плавления рудного материала и флюса.
После загрузки в печь шихта начинает нагреваться и по мере непрерывного опускания, последовательно развиваются следующие процессы:
- испарение влаги шихты;
- восстановление оксидов железа и некоторых других элементов;
- диссоциация карбонатов.
Испарение влаги шихты
Шихта, загружаемая в доменную печь, содержит гигроскопическую, а иногда и гидратную влагу. Гигроскопическая влага легко испаряется и удаляется на колошнике, так как температура колошниковых газов выше температуры испарения влаги.
Гидратная влага удаляется при температурах выше 400 °С, и выделяющийся водяной пар, взаимодействует с оксидом углерода или углеродом, обогащая поток газа водородом.
Н2Опар + СО = СО2 + Н2,
Н2Опар + С = СО + Н2.
Восстановление оксидов железа и некоторых других элементов
В результате взаимодействия оксидов железа с оксидом углерода и твердым углеродом кокса, а также водородом происходит восстановление железа. Восстановление газами называют косвенным, а твердым углеродом – прямым. Реакции косвенного восстановления сопровождаются выделением тепла и происходят в верхних горизонтах печи. Реакции прямого восстановления сопровождаются поглощением тепла и протекают в нижней части доменной печи, где температура более высокая.
Восстановление железа из руды происходит по мере продвижения шихты вниз в несколько стадий, от высшего оксида к низшему:
Fe2O3 → Fe3O4 → FeO → Fe
До температур 700 – 900 °С восстановление осуществляется газовым восстановителем (СО) по реакциям:
3Fe2O3 + CO = 2Fe3O4 + CO2,
Fe3O4 + CO = 2FeO + CO2,
FeO + CO = Fe + CO2.
По мере опускания шихты до горизонтов с температурой 900 – 1200 °С, выделяющийся в ходе восстановления углекислый газ (СО2) начинает взаимодействовать с углеродом топлива по реакции:
Процесс восстановления существенно изменяется и идет по реакции:
Таким образом, материал, загруженный в доменную печь, начинает восстанавливаться косвенным путем. По мере опускания шихты, выделяющийся в результате восстановления СО2 начинает взаимодействовать с углеродом твердого топлива и процесс непрямого или косвенного восстановления переходит в прямое восстановление.
Часть оксидов железа руды восстанавливается водородом, образующимся в доменной печи в результате реакции разложения паров воды:
Восстановление оксидов железа водородом происходит также, как оксидом углерода (СО), по стадиям от высших к низшим
3Fe2O3 + H2 = 2Fe3O4 + H2O;
Fe3O4 + H2 = 3FeO + H2O;
FeO + H2 = Fe + H2O.
Водород, как реагент-восстановитель, характеризуется более высокой степенью использования. Вследствие меньшего размера молекулы по сравнению с молекулой СО водород проникает в мелкие поры и трещины восстанавливаемого куска рудного материала, в которые молекулы СО не могут проникнуть. Поэтому, несмотря на относительно небольшое содержание водорода в доменном газе, он производит значительную восстановительную работу.
Кроме железа, в доменной печи происходит восстановление и других элементов, входящих в состав шихты.
Марганец
Марганец содержится во всех железных рудах в больших или меньших количествах. В соответствии с принципом последовательных превращений, оксиды марганца восстанавливаются последовательно от высших к низшим:
MnO2 → Mn2O3 → Mn3O4 → MnO → Mn.
Высшие оксиды марганца в доменной печи восстанавливаются полностью до MnO непрямым путем, взаимодействуя с СО. Оксид MnO восстанавливается только прямым путем, и то, частично по реакции:
Взаимодействуя с твердым углеродом, MnO образует карбид Mn3C, который растворяется в железе, повышая содержание марганца и углерода в чугуне. Другая часть MnO переходит в шлак.
Кремний
Кремний попадает в доменную печь с шихтой в виде SiO2. Восстановление его, как и марганца, осуществляется частично при высоких температурах твердым углеродом:
Доменная печь
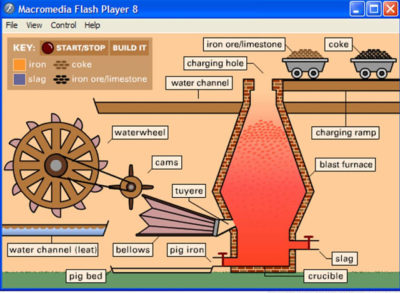
Доменная печь после многочисленных преобразований и модернизаций на современном этапе представляет собой конструкцию для получения чугуна как основного ингредиента сталелитейной промышленности.
Устройство доменной печи позволяет вести непрерывную плавку до капитального ремонта, который проводится с периодичностью один раз в 3-12 лет. Остановка процесса приводит к образованию сплошной массы из-за спекания компонентов (закозления). Для ее извлечения необходима частичная разборка агрегата.
Рабочий объем современной доменной печи достигает 5500 м3 при высоте 40 м. Она способна выдать около 6000 т чугуна за одну плавку. А специальное оборудование, обслуживающее системы, расположенные вокруг, занимает несколько десятков гектар земли.
Доменная печь используется для производства литейного чугуна, который в дальнейшем проходит плавку для получения различных марок чугунов или отправляется на восстановление для получения конструкционных сталей.
Современная доменная печьСредневековая доменная печь
Большая потребность в металле совпала по времени с этапом электрификации и механизации производства. В связи с этим успехи черной металлургии связаны с началом использования электроприводов, электрических систем автоматического управления на всех этапах производственного процесса.
Устройство доменной печи
На заре черной металлургии плавку болотной руды проводили в домнице – это мини домна, воздух в которую поступал от мехов. А обогащение железа углеродом происходило от древесного угля. Объемы выплавляемого металла таким способом были невелики и отличались периодичностью.
Конструкция доменной печи
Строение доменной печи напоминает шахту. Ее диаметр в три раза меньше высоты. Монтаж высотной конструкции осуществляется на бетонном фундаменте толщиной 4 м. Необходимость в таком массивном фундаменте возникает из-за массы домны, которая более 30 000 т.
На фундаментной плите закрепляются колонны и цельный (монолитный) цилиндр, которые изготавливаются и термостойкого бетона. Внутреннее пространство конструкции обложено огнеупорными материалами, а верхняя часть шамотом. В районе заплечников, где температура достигает 2000°С — графитированными материалами, а под ванной с чугуном — футеровка из глинозема. Также на фундаменте монтируется печной горн.
Нижняя часть доменной печи, где температура максимальна, оборудуется холодильниками с водяным охлаждением.Для удержания собранной огнеупорной конструкции, с внешней стороны доменная печь заключена в металлическую рубашку толщиной 40 мм.
Процесс восстановления железа происходит из руды в среде известнякового флюса при высокой температуре. Температура плавления достигается горением кокса. Для поддержания горения необходим воздух, поэтому в домне установлены 4 — 36 фурм или леток.
Большой внутренний объем нуждается в больших объемах воздуха, которые подают турбинные нагнетатели. Чтобы не снижать температурный, режим воздух перед подачей подогревается.
Схематически доменная печь выглядит следующим образом.
Схема расположения оборудования для доменного производства
Состав конструкции производства литья:
- шихта (руда и известняк);
- коксовый уголь;
- загрузочный подъемник;
- колошник, предотвращающий попадание газов из домны в атмосферу;
- слой загруженного кокса;
- шихтовый слой;
- воздушные нагнетатели;
- отводимый шлак;
- литьевой чугун;
- емкость для приема шлака;
- приемный ковш для расплава;
- установка типа Циклон, очищающая от пыли доменный газ;
- кауперы, регенераторы газов;
- дымоотводящая труба;
- воздухоподвод в кауперы;
- угольный порошок;
- печь для спекания кокса;
- емкость для хранения кокса;
- отведение колошникового газа высокой температуры.
Доменная печь обслуживается вспомогательными системами.
Колошник – это затвор домны. От его исправной работы зависит экологическая обстановка вокруг производства.
- воронка приемная;
- воронка маленького конуса, вращающаяся;
- конус маленький;
- межконусное пространство;
- конус большой;
- скип.
Принцип работы колошника следующий:
- Большой конус опущен, а малый поднят. Окошки во вращающейся воронке перекрыты.
- Скип осуществляет загрузку шихты.
- Поворачиваясь, воронка открывает окна, и шихта осыпается на малый конус 3. затем возвращается на место.
- Конус поднимается, тем самым препятствует выходу доменных газов.
- Конус опускается для передачи шихты в межконусное пространство, затем поднимается на исходную позицию.
- Конус опускается, а вместе с ним шихта загружается в доменную шахту.
Такая дозированная подача обеспечивает послойное распределение материалов.
Скип – черпак, при помощи которого осуществляется . Она выполняются по конвейерной технологии. Воздушные нагнетатели – летки и фурмы осуществляют подачу воздуха в доменную шахту под давлением 2-2,5 МПа.
Фурма и чугунная летка
Кауперы служат для нагревания подаваемого воздуха. В регенераторах он подогревается доменными газами, снижая тем самым энергетическую нагрузку на агрегат. Воздух нагревается до 1200°С и подается в шахту. При снижении температуры до 850°С подача прекращается, возобновляется цикл нагрева. Для бесперебойной подачи горячего воздуха устанавливается несколько регенераторов.
Принцип работы домны
Для получения чугуна необходимы следующие ингредиенты: шихта (руда, флюс, кокс), высокая температура, постоянная подача воздуха для обеспечения непрерывного горения.
Термохимические реакции
Восстановление железа из окислов путем ступенчатой химической реакции:
Fe2O3 + 3CO → 2Fe + 3CO2.
Получение необходимого количества углекислого и угарного газа обеспечивает горение кокса:
Для отделения железа от примесей используется известняковый флюс. Химические реакции, образующие шлак:
СаСО3 → СаО + СО2,
Принцип работы доменной печи таков. После загрузки доменную печь начинают разжигать газом. По мере повышения температуры подключается каупер и начинается продувка воздухом. Кокс – топливо для доменной печи – начинает интенсивнее гореть, и температура в шахте значительно увеличивается. При разложении флюса образуется большое количество углекислого газа. Угарный газ в химических реакциях выступает восстановителем.
После сгорания кокса и разложения флюса столб шихты опускается, сверху добавляется очередная порция. Снизу в самой широкой части шахты происходит полное восстановление железа при температурах 1850°С — 2000°С. Затем оно стекает в горн. Здесь происходит обогащение железа углеродом.
Температура в доменной печи изменяется в сторону увеличения по мере опускания шихты. Процесс восстановления протекает при 280 °С, а плавка происходит после 1500 °С.
Разлив расплава происходит в два этапа. На первом через летки сливается шлак. На втором через чугунные летки сливается чугун. Больше 80% выплавляемого чугуна идет на производство стали. Из остального чугуна отливают в опоках болванки.
Работает доменная печь непрерывно. От загрузки шихты до получения сплава проходит 3-20 дней — все зависит от объема печи.
Обслуживание и ремонт доменной печи
Любому оборудованию, работающему в круглосуточном режиме, требуется постоянное обслуживание. Регламенты закладываются в технический паспорт оборудования. Несоблюдение графика технического обслуживания влечет за собой сокращение срока эксплуатации.
Работы по техническому обслуживанию доменных печей делятся на периодические и капитальные ремонты. Периодические работы проводятся без остановки рабочего процесса.
Капитальный же ремонт по объему выполняемых работ делится на три разряда. Во время первого разряда производится осмотр всего оборудования, при этом из шахты извлекаются расплавы. Во время второго разряда производится ремонт футеровки, замена вышедших из строя элементов оборудования. При третьем разряде производится полная замена агрегата. Обычно такой ремонт совмещают с модернизацией или реконструкцией домны.
Устройство доменной печи, принцип работы доменной печи
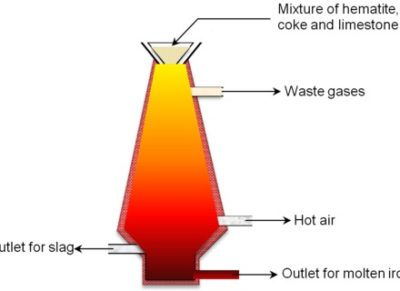
Выплавка чугуна в промышленных масштабах невозможна без габаритных, сложных и мощных печей. Доменная печь – вертикальное сооружение шахтного типа, в котором железную руду переплавляют в полезный металл. Устройство доменной печи подразумевает непрерывную работу конструкции в течение 3-12 лет, вплоть до капитального ремонта.
Рисунок 1. Доменная печь
Устройство домны
Современная печь – это огромная конструкция весом до 35000 т и высотой до 40 м. Чтобы многолетняя выплавка без простоев была возможной, печь должна быть прочной и надёжной. Снаружи устройство покрыто стальным кожухом – основа облицована толстыми листами (до 4 см).
Изнутри расположена огнестойкая футеровка. Она нуждается в постоянном охлаждении, поэтому внизу монтируют металлоёмкости, в которых циркулирует вода. Поскольку жидкости нужно очень много, иногда применяют охлаждение испарением. Суть метода – в испарении кипящей воды, активно поглощающей при этом тепловую энергию.
Рисунок 2. Устройство доменной печи
Печь представляет собой сооружение, состоящее из множества элементов. Основные представлены:
- колошником (колосником);
- распаром;
- шахтой;
- горном;
- заплечиками.
Колошник
Это верхний элемент, который служит для загрузки сырья (шихты) и отвода отработанных газов. часть колошника – засыпной агрегат. В большинстве случаев аппараты для засыпки шихты двуконусные. Между засыпками оба конуса прикрыты. После подачи сырья меньший элемент опускается, и железная руда попадает в больший. Как только набирается необходимая порция, малый конус закрывается, из большого руда попадает в печь. После этого герметизируется и крупное устройство.
Более продвинутые домны имеют улучшенную конструкцию колошника. Роль большого конуса играет вращающийся желоб с регулируемым углом наклона. Благодаря этому возможна засыпка сырья с любой стороны.
Колошник служит и газоотводом. В процессе выплавки образуется огромное количество газа. Вместе с ним удаляется и железосодержащая пыль, которую улавливают газоочистители.
Рисунок 3. Схема доменного производства
Шахта
Шахта занимает большую часть печного пространства. Конструкция, расширяющаяся книзу, представляет собой усечённый конус. Благодаря этому подача шихты происходит равномерно. Доменная печь – сооружение вертикальное и достаточно высокое. Это необходимо для обеспечения хим- и термообработки сырья нагретыми газами.
Распар
Элемент в форме цилиндра расположен в средней части рабочей доменной зоны. Для распара характерен наибольший диаметр. Назначение конструкции – увеличение печного пространства и ликвидация ненужного сырья. Здесь образуется пустая порода.
Заплечики
Укороченный конусообразный вариант распара – усечённый компонент обращён широкой частью вверх. С помощью заплечиков снижают объём выплавляемой шихты при производстве чугуна.
Основная часть, в которой и происходит выплавка металлов. Здесь горит кокс и образуется газ, накапливается шлак и чугун и происходит регулярный выпуск жидкого металла из конструкции. Состоит горн из фурменной зоны и металлоприёмника. Через фурмы, посредством воздухонагревателя и кольцевого воздуховода, в печь поступает горячий воздух. Он необходим для горения топлива. Дно металлоприёмника называется лещадь.
Внизу горна находятся шлаковые и чугунные летки – отверстия, через которые проходит расплавленный металл. После выпуска чугуна отверстие закрывают с помощью поршневого механизма огнеустойчивой массой.
Шлаковые отверстия находятся на 1,5-2 м выше чугунных леток. Их закрывают с помощью стальных штопоров с наконечниками. От чугуна шлак отделяется посредством агрегата, расположенного на печном желобе. Обе составляющие подаются в специальные ковши.
Всё это гигантское сооружение имеет огромную массу. Такой вес необходимо передавать грунту равномерно. Поэтому домну устанавливают на массивном бетонном фундаменте, толщина подошвы которого может достигать 4 м. Подошва служит опорой колоннам, на которые, в свою очередь, опираются металлоконструкции. Верхнюю фундаментную часть выполняют из жаростойкого бетона в формате монолитного цилиндра.
Давление огромной массы на грунт компенсируется устройством мощного фундамента
В таблице представлена взаимосвязь размеров некоторых современных печей.
Размеры, мм Полезный объём домны, м3 2000 3000 5000 Диаметр: колошника 7300 8200 11200 распара 10900 12900 16300 горна 9750 11700 14900 Высота: шахты 18200 20100 19500 горна 3600 3900 4500 полезная 29200 32200 32200 полная 32350 34650 36900 Дополнительные печные элементы
Функционирование печи требует работы вспомогательных устройств. Среди них:
- воздухонагреватели; крупные элементы башенного типа располагают рядом с печью; в них поступает колошниковый газ, который затем сгорает; благодаря этому образуется ещё более горячий газ, посредством сложной системы нагревающий воздух; последний – нагретый до температуры, как минимум, 1000 градусов – идёт в ход для выплавки чугуна;
- воздуходувные машины; сжатый воздух необходим для топливного горения; в печь воздух поступает благодаря устройствам, образующим давление порядка 25 МПа;
- устройства для подъёма и засыпки шихты;
- газоочистители для очистки колошниковых газов;
- прочие вспомогательные устройства – например, мостовые краны, которыми оборудованы литейные дворы.
Рисунок 4. Пример современной доменной печи
Современные печи оснащаются системами автоматики. Компьютеризация позволяет контролировать и регулировать основные параметры, связанные с функционированием домны. Под контролем уровень засыпки сырья, давление газа, температура дутья и т. п.
Современные домны даны на откуп автоматике. Компьютер контролирует основные производственные процессы
Принцип работы доменной печи основан на сложных физико-химических процессах. Выделяют такие операции:
- сгорание топлива;
- восстановление железа;
- разложение известняка на окись кальция и угольный ангидрид;
- насыщение железа углеродом;
- плавка металла;
- плавление шлака и др.
Рисунок 5. Производство чугуна с химической точки зрения
В самом общем смысле доменная плавка – это производство чугуна из железорудного сырья. Главные материалы, с помощью которых возможна выплавка чугуна:
- топливо – кокс;
- железная руда – сырьё, из которого выплавляют чугун;
- флюс – спецдобавки из песка, известняка и некоторых других материалов.
В печи шихта попадает в виде мелкопородных сплавленных кусков – окатышей или агломератов. В качестве рудного вещества могут выступать марганцевые руды или различные вариации железняка. Сырьё засыпают в колошник слоями, чередуя с пластами флюса и кокса.
Назначение флюса – отделение чугуна от примесей и пустой породы (шлака)
Шлак всплывает на поверхности раскалённого чугуна. Примеси сливают до того, как жидкий металл застынет.
Подача сырья, как и работа печи, должна быть непрерывной. Постоянство процесса обеспечивают специальные транспортёры. Попадая через описанные элементы в горн, шихта проходит через ряд технологических процессов.
Рисунок 6. Схема домны
Сгорающий кокс даёт требуемую температуру, которая не должна опускаться ниже 2000 градусов. Горение способствует соединению кислорода и каменного угля. Параллельно образуется углекислый газ. Под влиянием высокой температуры последний становится оксидом углерода. Благодаря этому восстанавливается железо.
Восстановление железа – один из важнейших производственных этапов. Без этого процесса невозможно обретение металлом необходимой прочности.
Чугун становится таковым после того, как железо пройдёт через расплавленный кокс. Чтобы результат стал возможным, железо должно насытиться углеродом. К чугунам относят сплавы, в составе которых на долю углерода приходится 2-5%.
После того, как готовый металл накопился в горне, его выпускают через летки. Через верхнее отверстие сначала выпускают шлак, а после – через нижнее – чугун. Последний сливается по каналам в ковши и отправляется на последующую обработку.
Заключение
Доменная печь – одна из самых важных составляющих чёрной металлургии. В современных реалиях домны обычно «встроены» в металлургические комбинаты. Средняя печь способна ежедневно выдавать около 12000 т чугуна, расходуя при этом приблизительно 20000 т исходного сырья.
Сегодня 16.01.2020 19:29 свежие новости час назад Прогноз на сегодня : Реферат производство чугуна заключение . Развитие событий. Актуально сегодня (16.01.2020 19:29): Реферат производство чугуна заключение Реферат: Производство чугуна и стали Xreferat Банк. Реферат: Производство железа чугуна и алюминия Xreferat. Реферат: Производство чугуна. Сущность пайки Xreferat. Реферат Десульфурация чугуна Производство. Реферат Тема: Производство чугуна. Kursak. Производство передельного чугуна реферат курсовая. Реферат: Производство стали. Скачать бесплатно и без. Реферат: Производство стали Xreferat Банк. Реферат: Производство чугуна в доменной печи BestReferat. Производство стали в дуговых электрических печах Реферат. Реферат Производство стали и чугуна и их применение. реферат: Производство чугуна и стали. Реферат на тему производство чугуна и стали Официальный сайт.Производство железа чугуна и алюминия. Получение чугуна Для производства чугуна в доменных печах необходимо иметь следующие исходные материалы: железные руды топливо и флюсы Производство железа чугуна и алюминия Получение чугуна Для производства чугуна в доменных печах необходимо иметь следующие исходные материалы: железные руды топливо и флюсы При вытеснении чугуна испарение магния постепенно ослабевает давление паров уменьшается и полость камеры снова постепенно заполняется жидким чугуном вызывая испарение магния т е. Марганец при выплавке передельного чугуна заметно переходит в металл уже в распаре однако наиболее интенсивное насыщение чугуна марганцем происходит в заплечиках и горне при. Учебная работа на тему: Производство передельного чугуна. Скачать реферат курсовую на тему Производство передельного чугуна 2016 2017 Реферат можно скачать бесплатно производств: добычу руды получение кокса обогащение руды производство чугуна в доменной печи производство стали разливку стали прокатку. ЗАКЛЮЧЕНИЕ. Производство чугуна и стали. Конверторные и мартеновские способы получения стали сущность доменной плавки. Получение стали в электрических печах. Технико экономические. Мне с моими работами постоянно помогают на fast referat можете просто зайти узнать стоимость никто вас ни к чему не обязывает там впринципе всё могут сделать вне зависимости от уровня сложности у меня просто парень. Реферат Промышленность производство массовой выплавки стали применяют дуговые электропечи питаемые переменным током и дуговые печи постоянного тока Производство железа Литое железо получают сплавляя смесь чугуна металлолома и стали с коксом. Расплавленное железо разливают в формы и охлаждают реферат: Производство чугуна и стали 1.Производство чугуна и стали. Железо имело промышленное применение уже до нашей эры. В древние времена его получали в пластичном состоянии в горнах Реферат на тему производство чугуна и стали Реферат металлургия производство реферат: производство стали санкт петербургский государственный технический университет реферат на вашу .
1. Реферат производство чугуна
2. Реферат производство чугуна и стали
3. Реферат производство чугуна скачать
4. Реферат производство чугуна кратко
5. Реферат производство чугуна и стали скачать
6. Реферат на тему производство чугуна
7. Производство чугуна и стали реферат
8. Реферат на тему производство чугуна и стали
9. Доклад производство чугуна
10. Доклад производство чугуна и стали
11. Доклад производство чугуна по химии
12. Производство чугуна доклад
13. Доклад на тему производство чугуна
14. Доменное производство чугуна реферат
Реферат производство чугуна заключение
Реферат производство чугуна заключение
Реферат производство чугуна заключение
Реферат производство чугуна заключение
Доменный процесс печи
Сталями принято считать сплавы железа с углеродом с содержанием последнего до 2,14%. Все, что имеет более высокое содержание углерода – это чугуны. Получают стали на основе двух процессов — доменного (в результате получается передельный чугун) и собственно получения стали, когда из передельного чугуна путем выжигания углерода и добавки легирующих элементов получают стали и сплавы нужной марки и нужного состава.
Сырье
Основой для получения чугуна в доменном процессе служат железные руды. Поскольку железо обладает сравнительно большим сродством к кислороду, оно в чистом виде в земной коре не обнаруживается, а находится в виде соединений с кислородом и диоксидом углерода.
Основные руды железа, которые используются в металлургическом производстве – это окись-закись железа (Fe3O4 – магнетит, магнитный железняк), окись железа (Fe2O3 — красный железняк, 2Fe2O3 * 3H2O — бурый железняк) и карбонат железа FeCO3 .
Естественно, что в чистом виде данные вещества не встречаются, а имеют примеси других элементов (чаще всего серы и фосфора) и других веществ в виде сопутствующих пород, не образующих с целевым продуктом химических соединений (обычно SiO2, Al2O3, CaO, MgO).
Кроме того, в больших количествах в виде руд имеется железный колчедан FeS2, но он очень редко применяется в металлургии, так как выплавляемое из него железо получается очень низкого качества из-за большого содержания серы.
В результате проведения специальных технологий дробления руды и флотационного процесса значительную часть пустой породы удается отделить от целевого продукта, в результате чего в ряде случаев удается повысить содержание железа в руде до 63-67%, а иногда до 69-72%.
Однако полностью удалить пустую породу не удается, эта операция осуществляется в самом доменном процессе путем перевода пустой породы в шлаки, которые отделяются от чугуна.
Процесс и схемы
Процесс доменной плавки (процесс получения передельного чугуна) осуществляется в шахтных печах (домнах). Домна, схематический разрез которой дан на рис. 5.
1, представляет из себя устройство в виде конуса в верхней части высотой в несколько десятков метров, обложенное изнутри огнеупорным кирпичом и снаружи стянутое железными обручами или окруженное сплошной железной оболочкой.
Верхняя часть домны носит название шахты и заканчивается наверху отверстием — колошником, которое закрывается подвижной воронкой – колошниковым затвором. Самая широкая часть домны называется распаром. Нижняя часть домны образует горн. В горне имеются отверстия – фурмы, через которые в печь вдувается горячий воздух.
При запуске доменную печь загружают сначала углем (коксом), а потом послойно смесью руды с флюсом и углем и чистым углем. Нижние слои угля зажигают, после чего горение и необходимая для выплавки температура поддерживаются вдуванием в горн подогретого в рекуператорах тепла воздуха. Последний поступает в кольцевую трубу, расположенную вокруг нижней части печи, а из нее по распределительным трубкам через фурмы в горн.
В горне уголь сгорает, превращаясь в углекислый газ, который, поднимаясь вверх и проходя сквозь слой раскаленного угля, превращается в оксид углерода. Этот оксид углерода восстанавливает основную часть руды, превращаясь снова в углекислый газ. Однако такая схема не полностью отражает многообразие химических реакций, протекающих в печи. Порядок превращения руды в чугун и распределение температур изображены на рис. 5.2.
Рис. 5.1. Схематическое изображение шахтной печи для получения чугуна (домны).
Рис. 5.2. Схема химических реакций, протекающих по высоте доменной печи.
В нижней части печи, как уже упоминалось, происходит горение кокса по реакции:
+ < O2 >=
Здесь угловыми скобками обозначено твердое состояние, фигурными – газообразное.
Проходя вверх далее через слой раскаленного угля, СО2 превращается в оксид углерода:
< CO2 >+ = 2
Монооксид углерода является сильным восстановителем и именно он восстанавливает железо из руд. Реакция идет постадийно, что и отображено на рисунке. В результате образуются крупинки твердого железа.
По мере сгорания угля это железо опускается вниз по печи в ее более горячую часть — распар, и здесь при температуре порядка 1200°С плавится при соприкосновении с углем, отчасти растворяя его и образуя заэвтектический чугун с содержанием углерода 4-4,5%.
В то время как чистое железо плавится при 1535°С, чугун в точке эвтектики плавится при 1150°С, поэтому капли жидкого чугуна стекают в нижнюю часть горна. Для того, чтобы сэкономить тепловую энергию отходящих газов и возвратить ее в процесс, отходящие газы из домны направляются в т.н. «кауперы», где газы отдают часть тепла.
Сначала эти газы направляются в один из кауперов, в то время как через второй продувается воздух для последующей подачи в домну, где он нагревается. Через определенные промежутки времени потоки меняются местами.
Одновременно с восстановлением железа происходят процессы отделения пустой породы от целевого продукта через образование шлака при взаимодействии примесей с флюсовыми добавками.
Конечный шлак на 85-95% состоит из SiO2, Al2O3 и СаО; остальное — MgО (2-10%), FeO (0,2-0,6%), MnО (0,3-2%) и 1,5-2,5% серы в виде CaS.
Стремятся создать наиболее легкоплавкий шлак, поэтому, в зависимости от типа примесей в используемой руде в шихту добавляют либо кислые (SiО2), либо щелочные компоненты (оксиды кальция и магния).
Для выпуска жидких продуктов плавки используют раздельно чугунные и шлаковые летки.
Поскольку шлак – многокомпонентная система, кроме того, процесс перехода из твердого в жидкое состояние осуществляется в достаточно большом интервале температур, вязкость шлака определяется не только температурой, но и составом шлака, поэтому у каждого типа шихты свои особенности.
Еще одна проблема, которая наблюдается в доменном процессе и которую решают для каждого типа шихты по-разному – это проблема серы. Сера – вредный элемент, ухудшающий качество металла. Она является причиной красноломкости стали и ухудшает качество литейных чугунов, увеличивая вероятность образования раковин в отливках.
Ограничения по сере для стали и литейного чугуна весьма серьезны – в этих материалах ее не должно быть более нескольких сотых процента. Вместе с тем, если не принимать каких-либо специальных мер, в чугуне может набраться до 0,9% серы.
Поскольку серу легче удалять из руд и чугунов, чем из стали, именно на стадии подготовки компонентов шихты и в доменном производстве эти операции и производятся.
Хотя значительное количество серы удаляется при огневой обработке руд (агломерации и обжиге окатышей), очень много серы вносится в доменную печь с коксом и железорудными материалами в виде сернистого железа (пирита FeS2), барита BaSO4 и гипса CaSO4 * H2O.
Часть серы удаляется при проведении технологических процессов естественным путем через образование газов (SO2, H2S и др.), но это лишь небольшая часть, по оценке для обычного доменного процесса порядка 15%. Поэтому основное внимание обращается на перевод соединений серы, растворяющихся в чугуне, в соединения, в нем не растворяющихся, например, по реакции:
FeS + CaO = CaS + FeO
FeO + C = Fe + COFeS +CaO + C = CaS +Fe + CO
Существуют и другие способы десульфуризации, что позволяет в целом решать эту проблему при использовании самых различных руд.
Конечными продуктами доменной плавки являются чугун (целевой продукт) и шлак и доменные газы (побочные продукты производства). Нас в данном случае интересует только чугун, на нем и остановимся.
Чугун представляет собой многокомпонентный сплав железа с углеродом, кремнием, марганцем и серой. В зависимости от назначения чугуна в нем могут содержаться и другие вещества, содержание которых регламентируется соответствующими стандартами.
Основной вид чугуна, производимый в доменном производстве, — это передельный чугун (до 90% от всего выпускаемого чугуна), который затем используют для получения различных видов сталей.
Производство чугуна имеет и самостоятельное значение, поскольку некоторые виды используют для отливок. Для получения чугунных отливок используется и небольшая часть передельного чугуна. Некоторые типы чугунных изделий можно оцинковывать, но об этом мы поговорим позже.
В зависимости от назначения чугуна последний перевозится от доменных печей чугуновозами в жидком виде либо в сталеплавильные цехи, либо на разливочные машины (при выплавке товарного чугуна).
Возможно Вас так же заинтересуют следующие статьи:
Доменная печь. Выплавка чугуна. Печь для выплавки чугуна. Схема доменной печи. Устройство доменной печи. Работа доменной печи. Параметры и конструкция доменной печи. | мтомд.инфо
Чугун выплавляют в печах шахтного типа – доменных печах. Сущность процесса получения чугуна в доменных печах заключается в восстановлении оксидов железа, входящих в состав руды оксидом углерода, водородом и твердым углеродом, выделяющимся при сгорании топлива.
При выплавке чугуна решаются задачи:
- Восстановление железа из окислов руды, науглероживание его и удаление в виде жидкого чугуна определенного химического состава.
- Оплавление пустой породы руды, образование шлака, растворение в нем золы кокса и удаление его из печи.
Устройство и работа доменной печи
Доменная печь имеет стальной кожух, выложенный огнеупорным шамотным кирпичом. Рабочее пространство печи включает колошник 6, шахту 5, распар 4, заплечики 3, горн 1, лещадь 15. В верхней части колошника находится засыпной аппарат 8, через который в печь загружают шихту.
Шихту подают в вагонетки 9 подъемника, которые передвигаются по мосту 12 к засыпному аппарату и, опрокидываясь, высыпают шихту в приемную воронку 7 распределителя шихты.
При опускании малого конуса 10 шихта попадает в чашу 11, а при опускании большого конуса 13 – в доменную печь, что предотвращает выход газов из доменной печи в атмосферу.
Схема доменной печи
При работе печи шихтовые материалы, проплавляясь, опускаются, а через загрузочное устройство подают новые порции шихты, чтобы весь полезный объем был заполнен.
Производство чугуна. Доменное производство чугуна. Технология производства чугуна. Процесс производства чугуна.
Полезный объем доменной печи – объем, занимаемый шихтой от лещади до нижней кромки большого конуса засыпного аппарата при его опускании. Полезная высота доменной печи (Н) достигает 35 м, а полезный объем – 20005000 м3.
В верхней части горна находятся фурменные устройства 14, через которые в печь поступает нагретый воздух, необходимый для горения топлива. Воздух поступает из воздухонагревателя, внутри которого имеются камера сгорания и насадка из огнеупорного кирпича, в которой имеются вертикальные каналы.
В камеру сгорания к горелке подается очищенный доменный газ, который, сгорая, образует горячие газы. Проходя через насадку, газы нагревают ее и удаляются через дымовую трубу. Через насадку пропускается воздух, он нагревается до температуры 10001200 0С и поступает к фурменному устройству, а оттуда через фурмы 2 – в рабочее пространство печи.
После охлаждения насадок нагреватели переключаются.
Горение топлива. Вблизи фурм природный газ и углерод кокса, взаимодействуя с кислородом воздуха, сгорают:
C + O2 = CO2 + Q
CH4 + 2O2 = CO2 + 2H2O(пар) + QВ результате горения выделяется большое количество теплоты, в печи выше уровня фурм развивается температура выше 2000 0С. Продукты сгорания взаимодействуют с раскаленным коксом по реакциям:
CO2 + C = 2CO — Q
H2O + C = CO + H2 — QОбразуется смесь восстановительных газов, в которой окись углерода CO является главным восстановителем железа из его оксидов.
Для увеличения производительности подаваемый в доменную печь воздух увлажняется, что приводит к увеличению содержания восстановителя. Горячие газы, поднимаясь, отдают теплоту шихтовым материалам и нагревают их, охлаждаясь до 300400 0С у колошника.
Шихта (агломерат, кокс) опускается навстречу потоку газов, и при температуре около 570 0С начинается восстановление оксидов железа.
Восстановление железа в доменной печи. Восстановление железа происходит по мере продвижения шихты вниз по шахте и повышения температуры от высшего оксида к низшему, в несколько стадий:
Fe2O3 —> Fe3O4 —> FeO —> Fe
Температура определяет характер протекания химических реакций. Восстановителями окcидов железа являются твердый углерод, оксид углерода и водород. Восстановление твердым углеродом (коксом) называется прямым восстановлением, протекает в нижней части печи (зона распара), где более высокие температуры, по реакции:
FeO + C = Fe + CO — Q
Восстановление газами (CO и H2) называется косвенным восстановлением, протекает в верхней части печи при сравнительно низких температурах, по реакциям:
3Fe2O3 + CO = 2Fe3O4 + CO2 + Q
Fe3O4 + CO = 3FeO + CO2 — Q
FeO + CO = Fe + CO2 + QЗа счет CO и H2 восстанавливаются все высшие оксиды железа до низшего и 4060 % металлического железа.
При температуре 10001100 0C восстановленное из руды твердое железо, взаимодействуя с оксидом углерода, коксом и сажистым углеродом, интенсивно растворяет углерод. При насыщении углеродом температура плавления понижается и на уровне распара и заплечиков железо расплавляется (при температуре около 1300 0С).
Капли железоуглеродистого сплава, протекая по кускам кокса, дополнительно насыщаются углеродом (до 4%), марганцем, кремнием, фосфором, которые при температуре 1200 0C восстанавливаются из руды, и серой, содержащейся в коксе.
В нижней части доменной печи образуется шлак в результате сплавления окислов пустой породы руды, флюсов и золы топлива. Шлаки содержат Al2O3, CaO, MgO, SiO2, MnO, FeO, CaS. Шлак образуется постепенно, его состав меняется по мере стекания в горн, где он скапливается на поверхности жидкого чугуна, благодаря меньшей плотности. Состав шлака зависит от состава применяемых шихтовых материалов и выплавляемого чугуна.
Чугун выпускают из печи каждые 34 часа через чугунную летку 16, а шлак – каждые 11,5 часа через шлаковую летку 17 (летка – отверстие в кладке, расположенное выше лещади). Летку открывают бурильной машиной, затем закрывают огнеупорной массой. Сливают чугун и шлак в чугуновозные ковши и шлаковозные чаши.
Чугун поступает в кислородно-конвертерные (см. Кислородный конвертер) или мартеновские цехи (см. Мартеновская печь), или разливается в изложницы разливочной машиной, где он затвердевает в виде чушек-слитков массой 45 кг.
Строим малый и большой бизнес на производстве чугуна
Химический состав чугуна близок к составу стали, но отличается от неё повышенным, более 2%, содержанием углерода. Так же в его состав обязательно входят кремний, марганец, фосфор и сера.
При выплавке стали из железной руды он является промежуточным продуктом производственного процесса, так как температура его плавления на 300 градусов ниже температуры плавления стали.
На следующем этапе процесса при повышении температуры плавки и удаления примесей из него получают сталь. Для этого используется около 85% всего выплавляемого чугуна.
В силу этих обстоятельств он стоит гораздо дешевле стали.
Высокое содержание углерода делает чугун хрупким и уязвимым для ударных воздействий. Но при этом он обладает большой устойчивостью при сжатии.Из-за его структуры изделия из этого материала не чувствительны к повреждениям своей поверхности и такие повреждения не ведут к деформации или разрушению всего изделия в целом.
Эти свойства обуславливают большую, чем у стали, лёгкость резки чугуна, особенно при обработке на токарном станке.Поэтому его часто применяют для изготовления деталей различных устройств, которые не подвергаются ударным и растягивающим воздействиям.История промышленного производства чугуна в России насчитывает без малого 300 лет. В 20-и веке СССР занимал первое место в мире по выплавке чугуна и стали.
За это время валовое производство черных металлов достигло в России вместе с Украиной 153 млн. тонн.После распада СССР выплавка сократилась более чем в два раза. В 2008 году в России выплавлялось 68, 5 млн. тонн. Сейчас на долю России досталось четвертое место в рейтинге производителей черной стали после Китая, Японии и США.
Особенность современного положения дел в чугунолитейной отрасли в России состоит в том, что она большей частью работает на экспорт, производя чугун главным образом в виде чушек, отправляемых за рубеж для дальнейшей обработки.В результате сложилась ситуация, когда в России, несмотря на большой объём валового производства чугуна, существует постоянный дефицит готовых изделий из литейного чугуна.
Благодаря этому в России создалась ниша для малого бизнеса, занимающегося фасонным литьём чугуна.Следует сказать, что это производство относится к числу сложных и предъявляет высокие требования к технической грамотности и технологической дисциплине, как менеджеров, так и рядовых работников.
Постараемся дать в общих чертах представление об основных способах выделки чугуна и их привлекательности для малого бизнеса.
Доменный способ производства чугуна
Доменное производство имеет своей целью выплавку железа из руды, при этом в ходе плавки удаляются пустая порода и вредные примеси.
Принципиальная схема работы доменной печи остаётся неизменной со времён создания в России чугунолитейного производства.-
- Сама печь представляет собой сооружение с вертикальной рабочей камерой, внутренняя поверхность которой выложена огнеупорным кирпичом.
- Шихта – сырьё для плавки, подаётся в верхнюю часть доменной печи, называемую колошником.
Колошник оснащён газоотводами, через которые из доменной печи удаляется смесь из колошниковых газов и шихтовой пыли, скопившихся во время плавки. Затем смесь сепарируется, и пыль уходит в агломерацию, снова попадая в шихту, а газ применяется для использования на вспомогательных производствах.
- Основная часть рабочей камеры – шахта, выполнена в виде усеченного конуса, расположенного основанием вниз.
- Под шахтой расположена ёмкость цилиндрической формы – распар. В распаре происходит расплавление шихты, он опирается на столбы, которые укреплены непосредственно в фундаменте доменной печи.
- Под распаром находится ещё одна ёмкость цилиндрической формы – горн. В верхней части горна имеется летка для выпуска шлака, а в нижней – летка для выпуска чугуна. Через летки во время плавки периодически происходит вывод чугуна и шлака из доменной печи.
- Выше шлаковой летки расположены отверстия – фурмы, через которые производится подача кислорода, нагретого воздуха и прочих добавок.
Выплавка в доменной печи происходит следующим образом:
- Поданный через фурмы кислород вступает в реакцию с содержащимся в шихте углеродом, температура горения при этом составляет до 2000 градусов.
- Расплавленное железо, освобожденное от сгоревшего углерода, скапливается в переходной камере конусообразной формы между горном и распаром – заплечиках. Здесь часть выделившегося из шихты углерода соединяется с железом, науглероживая его. Здесь же с железом соединяются освобожденные из шихты марганец с кремнием, сера, фосфор и другие элементы.
- Образовавшийся таким образом чугун стекает из заплечиков в горн, а расплавленный шлак скапливается над ним.
- Чугун и шлак выпускаются из доменной печи через соответствующие летки.
- Из летки расплавленный чугун, температура которого при этом составляет около 1500 градусов, по желобу попадает в раздаточный ковш.
Выплавленный чугун делится в зависимости от его назначения на следующие виды:
- Передельный чугун, который в дальнейшем будет переделан в сталь.
- Литейный чугун, который характеризуется увеличенным содержанием кремния и уменьшенным содержанием серы, служит для выделки чугунного литья.
- Специальный (ферросплавный) чугун, в котором может быть увеличено содержание таких элементов, как марганец или хром, служит для производства специальных сталей.
При разливе из раздаточного ковша, передельный чугун отправляется в миксер, откуда его отбирают для передела в сталь. Литейный же чугун заливается в формы для изготовления чугунных чушек.
Объём доменной печи составляет от 1500 до 5000 м3, высота её может достигать нескольких десятков метровРабота доменной печи происходит в непрерывном режиме на протяжении нескольких лет, что требует постоянной подачи огромного количества шихты и топлива.
При этом функционирование доменной печи обеспечивается сложной и высокоразвитой инфраструктурой, состоящей из вспомогательных производств и коммуникаций по транспортировке сырья и конечного продукта.Инвестиции, необходимые для организации доменного производства, исчисляются миллиардами рублей. Поэтому его организация под силу только крупным корпорациям.
В силу всего вышесказанного можно резюмировать, что организация доменного производства чугуна слишком далеко выходит за рамки возможностей малого бизнеса.
Переплавка чугуна в вагранке
В отличие от доменной плавки, переплавка чугуна в вагранке при грамотном подходе способна приносить прибыль при относительно небольших вложениях и представляет несомненный интерес для малого бизнеса.Вагранка, как и домна, принадлежит к печам шахтного типа.
В качестве топлива в ней используется кокс, в последнее время всё большее распространение получают вагранки, работающие на газе.Для достижения высокой температуры горения используется нагнетание воздуха в рабочую камеру.
В отличие от доменной печи, где металл выплавляется из руды, в вагранке производится переплавка лома чугуна и чугунных чушек с последующим разливом расплава в формы для получения готовых изделий.
Ввиду небольшого размера обслуживание таких печей на порядки проще, чем обслуживание домны. По этой же причине упрощен их ремонт и процедура остановки.
Принципиальная схема вагранки, работающей на коксе, выглядит так:
- Основной частью вагранки является металлический цилиндр — кожух, изготовленный из листов стали 6-12 мм. Внутренняя поверхность его выложена жаропрочным кирпичом или иным огнеупорным материалом, толщина которого равняется 200-300 мм.
- Основанием для кожуха служит подовая плита, которая опирается на четыре колонны. Для удаления остатков чугуна при ремонте служит отверстие, расположенное в центре плиты, закрытое заслонкой.
- Для загрузки кусков чугуна, кокса и присадок служит завалочное окно.
- Часть рабочего пространства от подовой плиты до завалочного окна называется шахтой.
- Часть пространства кожуха, находящаяся выше завалочного отверстия, называется трубой.
- Нижняя часть шахты называется горном. В горне имеются фурмы для подачи воздуха или кислорода, а так же летки, чугунная и шлаковая.
- Часть горна в районе фурм – плавильный пояс.
- Розжиг производится через рабочее окно с помощью дров.
Процесс плавки происходит таким образом:
- Через завалочное окно в шахту загружаются куски чугуна и кокса, а так же флюса и иных присадок.
- При сгорании кокса, температура горения которого повышается благодаря нагнетаемому через фурмы воздуху, происходит расплавление чугуна, который выходит через чугунную летку.
- Шлак, который в силу своей лёгкости плавает поверх чугуна, выходит сквозь шлаковую летку.
- Газообразная смесь, образовавшаяся при горении, уходя вверх по шахте, нагревает опускающуюся от завалочного окна шихту и уходит в трубу.
Для облегчения заливки больших форм и выдерживания постоянного химического состава чугуна вагранки, как правило, оснащены еще одним горном – копильником, в котором накапливается выходящий из летки кожуха чугун.В этом случае раздача расплава производится из копильника.Рабочий цикл составляет от 10 до 20 часов, после чего вагранка гасится и производится ремонт жаропрочной облицовки её внутренней поверхности.
Производительность такой печи может равняться от 0,2 до 25 т/час, соответственно, при диаметре шахты от 500 до 2000 мм, при полезной высоте шахты от 3 до 5 метров.
Инвестиции, необходимые для начала производства по литью в вагранке
Постараемся определить рентабельность, которой обладает литейное производство, при использовании вагранки производительностью 0,2-0,35 т/час.Потребляемая электроэнергия такой печи равна 2 кВт/ч.Она способна выплавлять чугун нескольких видов – литейный, модифицированный и рафинированный. Это происходит за счёт использования технологии ШПР – шлейфовой продувки расплава.
За месяц такая печь способна производить 22 плавки с выходом готового продукта на одну плавку – 5400 кг. Что за месяц составит 118 т чугуна.Стоимость такой печи около 4500000 р. В эту цифру, кроме оборудования, входит стоимость его доставки и монтажа, а так же обучения сотрудников.
Аренда производственных помещений и их подготовка к монтажу оборудования, а так же закупка инструмента, спецодежды и тому подобного – 45000 р.
Доменная печь — устройство и работа
Категории: доменное производство
Назначение. Конструкция печи. Технологический процесс выплавки чугуна.
Доменная печь
Чугун выплавляют в печах шахтного типа – доменных печах. Сущность процесса получения чугуна в доменных печах заключается в восстановлении оксидов железа, входящих в состав руды оксидом углерода, водородом и твердым углеродом, выделяющимся при сгорании топлива.
При выплавке чугуна решаются задачи:- Восстановление железа из окислов руды, науглероживание его и удаление в виде жидкого чугуна определенного химического состава.
- Оплавление пустой породы руды, образование шлака, растворение в нем золы кокса и удаление его из печи.
Устройство и работа доменной печи
Доменная печь имеет стальной кожух, выложенный огнеупорным шамотным кирпичом. Рабочее пространство печи включает колошник6, шахту 5, распар 4, заплечики 3, горн 1, лещадь 15. В верхней части колошника находится засыпной аппарат 8, через который в печь загружают шихту.
Шихту подают в вагонетки 9 подъемника, которые передвигаются по мосту 12 к засыпному аппарату и, опрокидываясь, высыпают шихту в приемную воронку 7 распределителя шихты.
При опускании малого конуса 10 шихта попадает в чашу11, а при опускании большого конуса 13 – в доменную печь, что предотвращает выход газов из доменной печи в атмосферу.
Схема доменной печи
При работе печи шихтовые материалы, проплавляясь, опускаются, а через загрузочное устройство подают новые порции шихты, чтобы весь полезный объем был заполнен. Производство чугуна. Доменное производство чугуна. Технология производства чугуна.
Процесс производства чугуна.
Полезный объем доменной печи – объем, занимаемый шихтой от лещади до нижней кромки большого конуса засыпного аппарата при его опускании.
Полезная высота доменной печи (Н) достигает 35 м, а полезный объем – 20005000 м3.
В верхней части горна находятся фурменные устройства 14, через которые в печь поступает нагретый воздух, необходимый для горения топлива. Воздух поступает из воздухонагревателя, внутри которого имеются камера сгорания и насадка из огнеупорного кирпича, в которой имеются вертикальные каналы. В камеру сгорания к горелке подается очищенный доменный газ, который, сгорая, образует горячие газы. Проходя через насадку, газы нагревают ее и удаляются через дымовую трубу. Через насадку пропускается воздух, он нагревается до температуры 10001200 0С и поступает к фурменному устройству, а оттуда через фурмы 2 – в рабочее пространство печи. После охлаждения насадок нагреватели переключаются. Горение топлива. Вблизи фурм природный газ и углерод кокса, взаимодействуя с кислородом воздуха, сгорают: C + O2 = CO2 + Q CH4 + 2O2 = CO2 + 2H2O(пар) + Q В результате горения выделяется большое количество теплоты, в печи выше уровня фурм развивается температура выше 2000 0С. Продукты сгорания взаимодействуют с раскаленным коксом по реакциям: CO2 + C = 2CO — Q H2O + C = CO + H2 — Q Образуется смесь восстановительных газов, в которой окись углерода CO является главным восстановителем железа из его оксидов. Для увеличения производительности подаваемый в доменную печь воздух увлажняется, что приводит к увеличению содержания восстановителя. Горячие газы, поднимаясь, отдают теплоту шихтовым материалам и нагревают их, охлаждаясь до 300400 0С у колошника. Шихта (агломерат, кокс) опускается навстречу потоку газов, и при температуре около 570 0С начинается восстановление оксидов железа.
Восстановление железа в доменной печи. Восстановление железа происходит по мере продвижения шихты вниз по шахте и повышения температуры от высшего оксида к низшему, в несколько стадий:
Fe2O3 —> Fe3O4 —> FeO —> Fe
Температура определяет характер протекания химических реакций. Восстановителями окcидов железа являются твердый углерод, оксид углерода и водород. Восстановление твердым углеродом (коксом) называется прямым восстановлением, протекает в нижней части печи (зона распара), где более высокие температуры, по реакции:
FeO + C = Fe + CO — Q
Восстановление газами (CO и H2) называется косвенным восстановлением, протекает в верхней части печи при сравнительно низких температурах, по реакциям:
3Fe2O3 + CO = 2Fe3O4 + CO2 + Q Fe3O4 + CO = 3FeO + CO2 — Q FeO + CO = Fe + CO2 + Q За счет CO и H2 восстанавливаются все высшие оксиды железа до низшего и 4060 % металлического железа. При температуре 10001100 0C восстановленное из руды твердое железо, взаимодействуя с оксидом углерода, коксом и сажистым углеродом, интенсивно растворяет углерод. При насыщении углеродом температура плавления понижается и на уровне распара и заплечиков железо расплавляется (при температуре около 1300 0С). Капли железоуглеродистого сплава, протекая по кускам кокса, дополнительно насыщаются углеродом (до 4%), марганцем, кремнием, фосфором, которые при температуре 1200 0C восстанавливаются из руды, и серой, содержащейся в коксе. В нижней части доменной печи образуется шлак в результате сплавления окислов пустой породы руды, флюсов и золы топлива. Шлаки содержат Al2O3, CaO, MgO, SiO2, MnO, FeO, CaS. Шлак образуется постепенно, его состав меняется по мере стекания в горн, где он скапливается на поверхности жидкого чугуна, благодаря меньшей плотности. Состав шлака зависит от состава применяемых шихтовых материалов и выплавляемого чугуна.
Чугун выпускают из печи каждые 34 часа через чугунную летку 16, а шлак – каждые 11,5 часа через шлаковую летку 17 (летка – отверстие в кладке, расположенное выше лещади). Летку открывают бурильной машиной, затем закрывают огнеупорной массой. Сливают чугун и шлак в чугуновозные ковши и шлаковозные чаши.
Чугун поступает в кислородно-конвертерные или мартеновские цехи, или разливается в изложницы разливочной машиной, где он затвердевает в виде чушек -слитков массой 45 кг.
Основные процессы доменной печи. Особенности производства чугуна
Поговорим о том, какова роль кокса в доменном процессе. Подробно рассмотрим суть этого металлургического производства.
В наше время при изготовлении чугуна и стали используют доменный процесс, в котором важным компонентом является печь.
Специфика агрегата
Рассмотрим особенности устройства, его предназначение. Основные процессы доменной печи связаны с плавкой кокса. Он представляет собой пористый материал, который спекается из массы углерода, получаемой путем прокаливания каменного угля без присутствия кислорода воздуха.
Доменная печь – это мощный и высокопроизводительный агрегат, где расходуется существенное количество дутья и шихты.
сырья
Современная доменная печь предполагает нахождение в ней материалов в течение 4-6 часов, газообразных веществ – 3-12 секунд. Если газы будут полностью распределены по сечению печи, можно рассчитывать на высокие показатели плавки, идет производство чугуна. Доменный процесс предполагает учет движения газов по зонам, имеющим меньшее сопротивление шихты.
Поэтому при ее загрузке в печь осуществляется регулировка, перераспределение кокса и агломерата по сечению печи так, чтобы они отличались по газопроницаемости. В противном случае больший процент газов будет уходить из печи со значительной температурой, что негативно отразится на применении тепловой энергии, доменный процесс будет не в полной мере эффективным.
На тех участках, которые имеют большое сопротивление, шихта газов будет проходить незначительно нагретой, потребуется дополнительный расход тепла в нижней части печи, в результате существенно возрастет расход сырья.
Какие еще особенности важно учитывать при загрузке? Доменный процесс получения чугуна – энергоемкое производство. Именно поэтому у стен печи используют слой менее газопроницаемого агломерата, в центре – увеличивают слой кокса, благодаря чему перераспределяется поток газа к центру. Материалы по окружности располагают равномерно.
шихты осуществляется отдельными порциями – подачами. Одна порция состоит из нескольких скипов, рудной части (агломерата), кокса. Соотношение исходных ингредиентов определяют специалисты.
Доменный процесс допускает совместную подачу сырья, при которой скипы кокса и агломерата скапливают на большом конусе, а затем его загружают в печь.
Регулировка распределения шихты
Управление распределения кокса и агломерата по сечению колошников осуществляется следующими приемами:
- меняется порядок расположения сырья на большом конусе;
- применяются расщепленные и раздельные подачи;
- устанавливаются подвижные плиты у стен колошника.
Доменный процесс предполагает учет определенных закономерностей внесения сыпучих материалов:
- укладка сырья, падающего с большого конуса, на колошнике с возвышением – гребнем;
- у гребня (в месте падения) шихты накапливается мелочь, крупные куски скатываются к подножию гребня, поэтому в этой зоне газопроницаемость шихты больше;
- на гребень влияет уровень засыпки на колошнике, а также расстояние с большим конусом;
- большой конус опускается не полностью, благодаря чему на периферию попадают мелкие куски кокса.
В большей части в центр печи попадает материал из скипов подачи, которые последними загружались в большой конус. Если изменить порядок загрузки, то можно добиться перераспределения материалов по сечению колошника.
Для регулирования процесса распределения по объему печи используемой шихты применяют два конусных аппарата. В последнее время некоторые доменные печи оснащаются подвижными плитами у стенок колошника, позволяющие менять угол наклона, перемещать их по горизонтальной плоскости.
Куски шихты, которые падают на плиты, отражаются от них, что позволяет направлять сырье в определенные зоны колошника.
Варианты печей без конуса
В печи, которые не имеют конусного загрузочного устройства, сырья проводится через два открывающихся поочередно шлюзовых бункера. К ним сырье доставляется наклонными ленточными конвейерами, на которых с четкими интервалами располагается кокс и агломерат. Одна порция поступает с ленты в один бункер, затем выгружается на колошник печи по вращающемуся наклонному лотку. Им за период выгрузки совершается порядка десяти полных оборотов вокруг неподвижной центральной оси.
Цикл загрузки
Под ним принято называть повторяющееся количество порций шихтовых материалов. Максимальную порцию определяют по объему шлюзового бункера засыпного механизма. Количество порций в одном цикле может составлять от 5 до 14.
Как получить в полном объеме продукты доменного процесса? Для того чтобы ответить на этот вопрос, подробнее рассмотрим суть процесса. При повышенном содержании в смеси углекислого газа низкая температура способствует полноте протекания теплообменных и химических процессов в доменной печи.
Чтобы аппарат работал экономично и интенсивно, количественное содержание углекислого газа по оси и на периферии печи должно быть пониженным, а на высоте одного-двух метров от стен – повышенным.
Контроль температур в новых печах осуществляется путем введения через отверстия в кожухе зондов. Обязательным для всех процессов является контроль уровня засыпки на колошнике.
Среди новаций – применение бесконтактных способов измерения уровня, основанных на показаниях микроволновых, инфракрасных датчиков.
Особенности распределения температур
Кроме тепла, которое вносится нагретым дутьем, в качестве основного источника тепла для нагревания газов и шихты, проведения восстановления и компенсации теплопотерь, компенсировать потери можно теплом, что выделяется при сгорании топлива в верхней части горна. По мере движения газообразных продуктов из горна вверх тепло опускается к шихтовым холодным материалам, происходит теплообмен. Подобный процесс объясняет понижение с 1400 до 200 градусов температуры на выходе из печного колошника.
Выведение избыточной влаги
Рассмотрим основные физические и химические процессы в доменной печи. В шихте, которая загружается в доменную печь, имеется гигроскопическая влага. К примеру, в составе кокса ее содержание может составлять до пяти процентов. Влага быстро испаряется на колошнике, поэтому для ее устранения требуется дополнительное тепло.
Появляется гидратная влага при загрузке в доменную печь бурого железняка, а также каолина. Для решения проблемы в современном производстве чугуна практически не применяют в качестве сырья данные руды.
Процессы разложения карбонатов
Соли угольной кислоты могут поступать в доменную печь. По мере их нагревания происходит их разложение на оксиды кальция и углерода, а процесс сопровождается выделением достаточного количества энергии.
В последнее время в доменные печи почти не загружают руды. Какова роль флюсов в доменном процессе? Они повышают его эффективность, позволяют снижать затраты на производство. Благодаря использованию офлюсованного агломерата, полному выведению из доменной шихты известняка можно добиться существенной экономии кокса. Процесс разложения известняка при агломерации обеспечивается сгоранием топлива низкого сорта.
Железо вводится в доменную печь в виде оксидов. Основной задачей процесса является максимальное извлечение железа из оксидов путем восстановления. Суть процесса состоит в удалении кислорода, для этого используется углерод, угарный газ, водород.
Восстановление углеродом называют прямым процессом, а реакцию с газообразными веществами именуют косвенным взаимодействием. Каковы их отличительные особенности? При прямой реакции расходуется углерод, в результате чего существенно сокращается его количество.
Для второго вида восстановления железа из оксидов требуется избыточное количество водорода.
В ходе процесса образуется твердое железо. Степень восстановления в чугун составляет 99,8 %. Таким образом, только 0,2 -1 % превращаются в шлак.
Выплавка марганцовистых чугунов
В процессе выплавки переделываемых чугунов в доменную печь марганец попадает в виде агломерата. В некоторых количествах марганцевые руды в виде силикатов марганца способствуют получению марганцовистого чугуна.
Восстановление из оксидов марганца происходит ступенчато. Для того чтобы полностью провести процесс, в горне должны быть установлены высокие температуры. Процесс выплавки передельных чугунов сопровождается восстановлением марганца только в соотношении 55-65 %.
В настоящее время из-за дефицитности марганцевых руд и марганца в технологической цепочке стали использовать незначительное количество марганцовистых чугунов.
При переходе на маломарганцовистые чугуны можно экономить не только сам марганец, но и кокс, так как будет снижаться его расход на прямое восстановление металла.
Источник http://maminshop.ru/soedinenie-mn-biologicheskaya-rol-marganca-himicheskie-svoistva-marganca.html
Источник http://electric-idea.ru/generators/primenenie-i-svoistva-marganca-marganec-splavy-svoistva/
Источник http://magnetline.ru/metally-i-splavy/chto-neobhodimo-zagruzit-v-domennuyu-pech-dlya-polucheniya-chuguna.html