Содержание
Как правильно закалить металл в домашних условиях своими руками: накалить сверло и другое железо в масле
В технологии термической обработки сталей предусматривается ряд способов теплового воздействия. В результате меняется размер зерна. От этого меняется твердость.
В составе стали имеются:
- Феррит – это основная составляющая. Зерна металла под микроскопом легко увидеть. Они обычно на шлифах представлены в виде белого или светло-серого цвета.
- Перлит – это эвтектоидное механическое соединение железа и углерода. Для этой составляющей отмечают высокую твердость и прочность.
- Цементит – предельное соединение железа с углеродом Fe₃C. Одна чистый цементит довольно хрупкое вещество.
- Графит – одна из форм углерода. В металлах он может быть представлен в виде шарообразных включений. Его присутствие отмечают в дамасских сталях, которые получают методом ковки.
- Аустенит – одна из форм сплава. Она возникает при температуре 727 ⁰С и выше. Данная составляющая представляет псевдоожиженный металл. Для него характерна высокая пластичность, податливость. Появление аустенита при нагревании определяется по отсутствию магнитных свойств.
Принята классификация соединения – железо-цементит в следующих значениях:
- 0,0…2,18 % углерода – это стали;
- 2,14…6,67 % углерода – чугуны.
У сталей есть и еще различия:
- 0,0…0,8 – низкоуглеродистые стали;
- 0,8…2,14 – углеродистые стали.
Диаграмма Fe – Fe₃C. В зависимости от температуры и концентрации железа и углерода образуются разные виды соединений. Они определяют механические свойства металла:








Что такое закалка металла?
Один из видов термообработки — закалка металла. Она состоит из нескольких этапов, выполняемых в определенной последовательности:
- Нагрев металла до определенной температуры. Выдержка для выравнивания по всей глубине детали.
- Быстрое охлаждение.
- Отпуск для снятия напряжений и коррекции твердости до заданного значения.
В процессе изготовления сложные детали могут проходить несколько закалок разного вида.
По глубине обработки закалка делится на два вида:
- объемная;
- поверхностная.
В основном в машиностроении применяется объемная термообработка, когда деталь прогревается на всю глубину. В результате резкого охлаждения, после завершения термообработки твердость внутри и снаружи отличается всего на несколько единиц.
Поверхностная закалка применяется для деталей, которые должны быть твердые сверху и пластичные внутри. Индуктор прогревает сталь на глубину 3–20 мм и сразу за ним расположен спрейер, поливающий горячий металл водой.
Сталь нагревается до состояния аустенита. Для каждой марки своя температура, определяемая по таблице состояния сплавов железо-углерод. При резком охлаждении углерод остается внутри зерна, не выходит в межкристаллическое пространство. Превращение структуры не успевает происходить, и внутреннее строение содержит перлит и феррит. Зерно становится мельче, сам металл тверже.
Какие стали можно закаливать?
При нагреве и быстром охлаждении внутренние изменения структуры происходят во всех сталях. Твердость повышается только при содержании углерода более 0,4%. Ст 35 по ГОСТ имеет его 0,32 – 0,4%, значит может «подкалиться» — незначительно изменить твердость, если углерод расположен по верхнему пределу.
Закаливаемыми считаются стали, начиная от СТ45 и выше по содержанию углерода. В то же время закалка нержавеющей стали с низким содержанием углерода типа 3Х13 возможна. Хром и некоторые другие легирующие элементы заменяют его в кристаллической решетке и повышают прокаливаемость металла.
Высоколегированные углеродистые стали содержат вещества, ускоряющие процесс охлаждения и повышающие способность стали к закалке. Для них требуется сложная ступенчатая система охлаждения и высокотемпературный отпуск.
Температура и скорость нагрева
Температура нагрева под закалку повышается с содержанием в стали углерода и легирующих веществ. Для Ст45 она, например, 630–650⁰, Ст 90ХФ — более 800⁰.
Высокоуглеродистые и высоколегированные стали при быстром нагреве могут «потрещать» — образовать на поверхности и внутри мелкие трещины. Их нагревают в несколько этапов. При температурах 300⁰ и 600⁰ делают выдержку. Кроме выравнивания температуры по всей глубине, происходит структурное изменение кристаллической решетки и переход к другим видам внутреннего строения.
Свойства стали после закалки
После закалки деталей происходят структурные изменения, влияющие на технические характеристики металла:
- увеличивается твердость и прочность;
- уменьшается зерно;
- снижается гибкость и пластичность;
- повышается хрупкость;
- увеличивается устойчивость к стиранию;
- уменьшается сопротивление на излом.
На поверхности каленой детали легко получить высокий класс чистоты. Сырая сталь не шлифуется, тянется за кругом.
Отпуск и старение металла
Часто путём закалки повышается не только твёрдость металла, но и его хрупкость, поэтому необходимо выполнять ещё один этап — отпуск, при котором прочность и твёрдость несколько снижаются, но материал становится более пластичным. Делают отпуск при температуре, ниже, чем в предыдущем процессе, и охлаждают металл постепенно.
Можно проводить закалку без изменения структуры металла (полиморфного превращения). В этом случае не возникнет проблем с хрупкостью, но необходимая твёрдость не будет достигнута. А повысить её удастся путём ещё одного процесса термообработки, называемого старением. При старении происходит распад пересыщенного твёрдого раствора, в результате которого увеличивается прочность и твёрдость материала.
Отпуск стали — это разновидность термообработки, используемая для деталей, закалённых до критической точки, при которой происходит полиморфное изменение кристаллической решётки. Он заключается в выдерживании металла определённый промежуток времени в нагретом состоянии и медленном охлаждении на открытом воздухе. Делают отпуск, чтобы снизить внутреннее напряжение, а также исключить хрупкость металла и увеличить его пластичность.
При помощи старения достигается необходимая твёрдость закалённой стали. Старение может быть:
- естественным, при котором самопроизвольно повышается прочность закалённого металла и снижается его пластичность. Происходит данный процесс при выдержке в естественной среде;
- термическим. Такое старение — это процесс повышения твёрдости металла посредством выдержки при высоких температурах. По сравнению с первым видом, в данном случае может произойти перестаривание — это когда твёрдость, пределы прочности и текучести, достигая максимальной величины, начинают снижаться;
- деформационным. Такое старение достигается при помощи пластической деформации закалённого сплава, имеющего структуру пересыщенного твёрдого раствора.

Виды закалки стали
Основные параметры для закалки стали: температура нагрева и скорость охлаждения. Они полностью зависят от марки стали — содержания углерода и легирующих веществ.
Закаливание в одной среде
При закаливании стали среда определяет скорость охлаждения. Наибольшая твердость получается при окунании детали в воду. Так можно калить среднеуглеродистые низколегированные стали и некоторые нержавейки.
Если металл содержит более 0,5% углерода и легирующие элементы, то при охлаждении в воде деталь потрещит — покроется трещинами или полностью разрушится.
Высоколегированные стали повышают свою твердость даже при охлаждении на воздухе.
При закалке на воде легированная сталь подогревается до 40–60⁰. Холодная жидкость будет отскакивать от горячей поверхности, образуя паровую рубашку. Скорость охлаждения значительно снизится.
Ступенчатая закалка
Закалка сложных по составу сталей может производиться в несколько этапов. Для ускорения охлаждения крупных деталей из высоколегированных сталей, их сначала окунают в воду. Время пребывания детали определяется несколькими минутами. После этого закалка продолжается в масле.
Вода быстро охлаждает металл на поверхности. После этого деталь окунается в масло и остывает до критической температуры структурных преобразований 300–320⁰. Дальнейшее охлаждение проводится на воздухе.
Если калить массивные детали только в масле, температура изнутри затормозит остывание и значительно снизит твердость.
Изотермическая закалка
Закалить металл с высоким содержанием углерода сложно, особенно изделия из инструментальной стали — топоры, пружины, зубила. При быстром охлаждении в нем образуются сильные напряжения. Высокотемпературный отпуск снимает часть твердости. Закалка производится поэтапно:
- Нормализация для улучшения структуры.
- Нагрев до температуры закалки.
- Опускание в ванну с селитрой, прогретой до 300–350⁰, и выдержка в ней.
После закалки в селитровой ванне отпуск не нужен. Напряжения снимаются во время медленного остывания.

Изотермическая закалка
Светлая закалка
Технического термина «светлая закалка» не существует. Когда производится закалка легированных сталей, включая нагрев, в вакууме или инертных газах, металл не темнеет. Закалка в среде защитных газов дорогостоящая и требует специального оборудования отдельно на каждый тип деталей. Она применяется только при массовом изготовлении однотипной продукции.
В вертикальной печи деталь нагревается, проходя через индуктор, и сразу же опускается ниже — в соляную или селитровую ванну. Оборудование должно быть герметично. После каждого цикла с него откачивается воздух.
Закалка с самоотпуском
При быстром охлаждении в процессе закалки стали внутри детали остается тепло, которое постепенно выходит и отпускает материал — снимает напряжения. Делать самоотпуск могут только специалисты, которые знают, насколько можно сократить время пребывания детали в охлаждающей жидкости.
Самоотпуск можно производить дома, если нужно незначительно увеличить твердость крепежа или мелких деталей. Необходимо уложить их на теплоизолирующий материал и сверху накрыть асбестом.
Способы закалки
Суть любой закалки — превращение аустенита в мартенсит (диаграмма «железо-углерод»). В зависимости от температурного режима, закалка может быть полной или неполной. Первым способом закаливают инструментальную сталь, а вторым — цветную.
При закалке могут использоваться один или несколько охладителей. От этого также зависит способ термообработки. В зависимости от охлаждающей среды, термическая обработка металла может быть:
- с использованием одного охладителя;
- с подстуживанием;
- прерывистой;
- ступенчатой;
- изотермической.
Закалка в одном охладителе
Данный метод применяется для термообработки простых деталей, изготовленных из легированной и углеродистой стали. Деталь нагревается до необходимой температуры, а затем охлаждается в жидкости. Углеродистую сталь диаметром от 2 до 5 мм охлаждают в воде, детали меньшего диаметра и всю легированную сталь — в масле.
Закалка с подстуживанием
При термообработке с одним охладителем часто возникают состояния термического и структурного внутреннего напряжения. Развиваются они в том случае, когда разность температур достигает минимума. На поверхности металла образуется напряжение растяжения, в центре — напряжение сжатия. Чтобы данные напряжения уменьшить, перед тем, как опустить нагретую деталь в жидкость, её недолго держат на открытом воздухе. Температура детали в данном случае не должна быть ниже линии 0,8К по диаграмме «железо-углерод».
Прерывистая
Эту закалку проводят в двух средах — воде и масле или воде и воздухе. Нагретую до критической точки деталь сначала быстро охлаждают в воде, а потом медленно в масле или на открытом воздухе. Такой способ термообработки применяют для высокоуглеродистой стали. Этот метод — сложный, так как время охлаждения в первой среде очень мало и определить его сможет лишь специалист высокой квалификации.

Ступенчатая
При прерывистой термообработке деталь охлаждается неравномерно — более тонкие поверхности быстрее, чем все остальные. К тому же очень трудно отрегулировать время нахождения детали в первой среде (воде). Поэтому лучше использовать ступенчатую закалку. Данный метод позволяет охлаждать деталь в среде при температуре, превышающей мартенситную точку. Первая ступень — охлаждение и выдержка детали в данной среде до того момента, когда все сечения детали достигнут одной и той же температуры. Вторая ступень — окончательное медленное охлаждение (преобразование аустенита в мартенсит).
Изотермическая
При изотермической термообработке деталь нагревают до критической точки, а затем опускают в масляную или соляную ванну температурой 250 градусов. Выдерживают полчаса, а далее остужают на открытом воздухе. Такая закалка обеспечивает высокую конструкционную прочность и применяется для легированных и конструкционных сталей, у которых распад аустенита в промежуточной области не происходит до конца. В дальнейшем он превращается не в мартенсит, а в бейнит + 20% остаточный аустенит, обогащённый углеродом. Такой закалкой можно достичь высокой прочности при хорошей вязкости.
Как закалить металл в домашних условиях
Пользуясь элементарными знаниями, можно провести закалку стали в домашних условиях. Нагревание металла обычно проводят с помощью костра, муфельных электропечей или горелок с использованием газа.
Закалка топора на костре и в печи
Если требуется придать дополнительную прочность бытовым инструментам, например, сделать топор более прочным, то самый простой способ его закалки можно провести в домашних условиях.
На топорах при изготовлении ставится клеймо, по которому можно узнать марку стали. Мы рассмотрим процесс закалки на примере инструментальной стали У7.

Выполнять технологию нужно с соблюдением следующих правил:
1. Отжиг. Перед обработкой затупить острую кромку лезвия и поместить топор в горящую кирпичную печь для нагрева. За процедурой термообработки нужно внимательно следить, чтобы не допустить перегрева (допустимый нагрев 720-780°C). Более продвинутые мастера температуру узнают по цвету каления.

А новички, температуру могут узнать с помощью магнита. Если магнит перестал приставать к металлу, значит топор нагрелся свыше 768°C (цвет красно-бордовый) и пришло время охлаждения.

Кочергой придвинуть раскаленный топор к дверце печи, жар убрать вглубь, закрыть дверцу и задвижку, оставить нагретый металл в печи на 10 часов. Пусть топор постепенно остывает с печкой.
2. Закалка стали. Нагреть топор на костре, буржуйке или печи до темно-красного цвета — температура 800-830°C (магнит перестал магнитится, подождать ещё 2-3 минуты).
Закалка выполняется в подогретой воде (30°C) и масле. Опустить лезвие топора в воду на 3-4 см, интенсивно двигая его.

Далее топор поместить в емкость с маслом, в случае возгорания масла нужно накрыть емкость плотной тканью. Выдерживать в масле нужно до полного остывания.
3. Отпуск лезвия топора. Отпуск уменьшает хрупкость стали и снимает внутренне напряжение. Зачистить металл наждаком, чтобы лучше различать цвета пебежалости.

Выдержать топор в течение 1 часа в духовке, при температуре 270-320°C. После выдержки, достать и остудить на воздухе.
Закаливание ножа
Самостоятельно для закалки металлов целесообразно использовать печи. Для предметов быта в виде ножей, топоров, сверл и других, наиболее подходящими являются муфельные печи небольшого размера. В них можно достичь температуры закалки намного выше, чем на костре и проще добиться равномерного прогрева металла.
Такую печь можно изготовить самостоятельно. В интернете можно найти множество простых вариантов ее конструкции. В таких печах можно разогреть металлическое изделие до 700-900°C.

Рассмотрим, как закалить нож из нержавейки в домашних условиях, используя муфельную электропечь. Для охлаждения вместо воды или масла используется расплавленный сургуч (можно достать в воинской части).
Последовательность процесса закалки следующая:
- нож (без ручки, если она деревянная) кладут в холодную печь;
- включив закрытую печь, нагревают ее вместе с ножом до получения ярко-красного цвета лезвия (800-900°C);
- раскаленным лезвием ножа режут сургуч до 10 раз, погружаясь в него на 1,5 см;
- процедуру повторяют до 5 раз, нагревая лезвие ножа и остужая в сургуче;
- остатки сургуча снимают скипидаром с помощью смоченной ткани.
Процедуру лучше делать на свежем воздухе, сургуч при плавке пахнет ужасно. Также, лезвие ножа можно греть на открытом огне.
Необходимость этой процедуры возникает тогда, когда нужно, чтобы металлический предмет без усилий разрезал стекло.
Случается, что потребность закалить инструмент из металла появляется из-за того, что он либо не закален до нужной степени, либо, наоборот, в его закалке переусердствовали.
В первом случае металлические предметы, например сверла, заминаются, во втором – буквально крошится.
Проверить еще в магазине, как хорошо закален инструмент из металла, вряд ли получится.

Хотя возможность такой проверки существует. Надо взять напильник и провести им по краю режущего предмета – ножа или топора.
То, что напильник пристает и липнет к металлу, означает, что изделие мало закаливали.
При этом его край будет слишком мягким и податливым.
Если напильник отходит от предмета с легкостью и будто гладит его, а рука во время нажатия не ощущает никаких неровных мест, то на лицо перекал изделия.
Если в ваших руках все-таки оказалось оборудование из металла, которое нуждается в дополнительной закалке, то ничего страшного.
Закалить нож можно и своими руками, даже не прибегая сложным технологиям, то есть в домашних условиях.
Единственное, что нужно помнить: запрещено закаливать малоуглеродистые стали.
А вот увеличить прочность углеродистых и инструментальных сталей вполне вероятно.

Свойства стали после закалки
После закалки увеличивается твердость и прочность стали, но при этом повышаются внутренние напряжения и возрастает хрупкость, провоцирующие разрушение материала при резких механических воздействиях. На поверхности изделия появляется толстый слой окалины, который необходимо учитывать при определении припусков на обработку.
Внимание! Некоторые изделия закаляются частично, например, это может быть только режущая кромка инструмента или холодного оружия. В этом случае на поверхности изделия можно наблюдать четкую границу, разделяющую закаленную и незакаленную части. Закаленную часть на клинках называют «хамон», что в переводе на современный язык металлургии означает «мартенсит».
Определение! Мартенсит – основная составляющая структуры стали после закалки. Вид этой микроструктуры – игольчатый или реечный.
Для уменьшения внутренних напряжений и роста пластичности осуществляют следующий этап термообработки – отпуск. При отпуске происходит некоторое снижение твердости и прочности.
Технология закалки
Режим закалки определяется температурой, временем выдержки, скоростью охлаждения, используемой охлаждающей средой.
Способы закалки стали:

- в одном охладителе – применяется при работе с деталями несложной конфигурации из углеродистых и легированных сталей;
- прерывистый в двух средах – востребован для обработки высокоуглеродистых марок, которые сначала остужают в быстро охлаждающей среде (воде), а затем в медленно охлаждающей (масле);
- струйчатый – обычно востребован при частичной закалке изделия, осуществляется в установках ТВЧ и индукторах обрызгиванием детали мощной струей воды;
- ступенчатый – процесс, при котором деталь остывает в закалочной среде, приобретая во всех точках сечения температуру закалочной ванны, окончательное охлаждение осуществляют медленно;
- изотермический – похож на предыдущий вид закалки стали, отличается от него временем пребывания в закалочной среде.
Типы охлаждающих сред
От правильного выбора охлаждающей среды во многом зависит конечный результат процесса.
-
- Для поверхностной закалки и работы с изделиями простой конфигурации, предназначенными для дальнейшей обработки, применяется в основном вода. Она не должна содержать соли и примеси моющих средств, оптимальная температура +30°C.
Внимание! Использовать этот способ охлаждения для деталей сложной конфигурации не рекомендуется из-за риска появления трещин.
- Для изделий сложной формы применяют 50% раствор каустической соды, который нагревают до +60°C. При использовании такого состава для охлаждения сталь приобретает светлый оттенок. Пары каустической соды вредны для здоровья человека.
- Для тонкостенных деталей, изготовленных из углеродистых и легированных сталей, применяются минеральные масла, обеспечивающие постоянную температуру охлаждения, не зависящую от температуры окружающей среды. Главное условие, которое необходимо соблюдать при охлаждении сталей после закалки, – отсутствие воды в минеральных маслах. Недостатки процесса: выделение вредных для человека паров, возможность возгорания масла, образование налета, постепенная потеря эффективности охлаждающего состава.
Внимание! Для работы с изделиями из углеродистых сталей со сложным химическим составом используют комбинированное охлаждение. Оно состоит из двух этапов. Первый – охлаждение детали в воде, второй, после +200°C, – в масляной ванне. Перемещение из одной охлаждающей среды в другую должно производиться очень быстро.
Температурный режим
Закалка — это превращение аустенита в мартенсит. На производстве при выборе температур термообработки пользуются диаграммой «железо-углерод». Температуру закалки углеродистых сталей определить очень легко. Нагрев конструкционной стали с содержанием углерода менее 0,8% доводят до температур, расположенных над линией GS и выше точки Ас3 на 30-50 градусов. Нагрев сталей, содержащих более 0,8% углерода, проводят при температурах на 30-50 градусов выше тех, которые расположены выше линии PSK. Температуру закалки легированной стали также выбирают, исходя из критических точек, но данный процесс много сложнее, так как помимо углерода такие стали содержат и другие компоненты.

Какую сталь подвергают закалке
Термически обрабатывают только такой металл, в котором содержится не менее 0,45% углерода, а также инструментальную и легированную стали, твёрдость которых после закалки становится в несколько раз выше. Тот металл, в котором содержание углерода не превышает 0,45%, не обрабатывается термически. Ниже приведена таблица режимов термообработки для некоторых видов сталей.
Закалка ножа в домашних условиях

Много столетий назад, мастера-кузнецы задавались вопросом, твердости клинка. И многие из них понимали, что сталь после нагрева нужно быстро остудить. Дамасские мастера, закаливали сталь в ущельях, где дули сильные ветра. Они считали, что сила ветра передавалась клинку, и он становился упругим, твердым и не ломался.
Закалка режущей кромки ножа.
Еще немного истории
Некоторые кузнецы использовали для этих целей мочу барана, собранную в течение трех дней. А другие применяли для такого процесса мочу мальчика, и он должен был быть непременно рыжим. Вот на какие хитрости шли мастера прошлого. Кстати, применение мочи, можно частично оправдать, так как присутствие в ней солей, сопутствовало быстрому забору тепла у раскаленного металла.
Были даже довольно варварские методы закалки, раскаленный клинок вонзали между ребер раба, и считалось, что его сила переходила в металлическую заготовку. Хорошо, что те времена миновали. Но люди постепенно замечали, что если после нагревания металла, его поместить в соленую среду, качество и характеристики его улучшались.
Шло время, и было проделано тысячи способов до достижения положительного результата. Молодой ученый металлург Д. К. Чернов, работавший над этой проблемой в 1866 году, достиг немалых успехов в определении для каждого металла определенных значений.
Завод, на котором проводил испытания господин Дмитрий Константинович Чернов, полностью избавился от брака и этого человека можно назвать прародителем современной металлургии. Сегодня любой студент, имея багаж знаний, накопленный веками, может справиться с закалкой стали.
Выбор стали для закалки ножа
Как известно, сталь это есть не что иное, как сплав углерода с железом. В них добавляются в небольших дозах добавки. Большую роль на качество будущего клинка они не играют. Важнейшим элементом является углерод.
Добавки могут быть такие, как цинк, хром, молибден, кальций и т.д. А вот чем меньше углерода в стали, она приобретает высокую прочность, но изнашивается быстрее и коррозия развивается быстрее. Для правильной закалки нужно обязательно знать состав будущего клинка.
Лучше всего провести углеродный анализ стали.
Идеальная закалка лезвия ножа.
Если будущее изделие будет, к примеру, из напильника или рессоры автомобиля. Закалка в данном случае просто необходима, тем более ковка такого металла подразумевает его обязательный нагрев. Проверить качество закалки, можно в домашних условиях, но он довольно «жестокий».
Нужно готовый клинок затянуть в тисках и начать постепенно гнуть его, и если излом клинка произойдет на отметке приблизительно в 45 градусов. Можно смело сказать – закалка была проведена верно.
Но так следует сделать, после первой вашей самостоятельной закалки клинка, нужно хорошо запомнить весь процесс и повторить его заново.
Способы закаливания
Способов закаливания существует, по сути, 2 типа. На открытом огне и в печи. Но, к сожалению, в обычном костре поднять температуру выше 900 градусов, не получится. Тогда приходит на помощь печь. Ее можно изготовить самостоятельно. Это довольно непростой процесс, но изготовив ее единожды, она прослужит вам достаточно долго. Тем более если вы начинающий мастер, она вам просто необходима.
В камере
Далее мы поговорим, как сделать самостоятельно муфельную печь для правильной термообработки заготовок, а сейчас просто и коротко опишем процесс закалки в ней, сталь клинка будет использована 50Х14МФ:
- Прогреваем печь до нужной температуры, в данном случае 1070 градусов, и погружаем клинки в печь.
- Загрузив клинок в печь, разогреваем печь опять до 1070 градусов, и при данной температуре начинается отсчет времени. Принцип прост: 1 минута 40 секунд, на каждый миллиметр толщины клинка.
- По прошествии нужного времени, клинок вытаскивают и охлаждают на воздухе, в течение 15 минут под небольшим прессом.
- Затем производится отпуск металла в духовке при 200 градусах.
Закалка ножа в камере выполненной в домашних условиях.
При данном процессе сталь получает твердость в 56 HRC.
Но учтите, что в данном случае закалка происходила без погружения в жидкости. Для каждой стали свои условия закалки. И результат, которого вы хотите добиться, будет целиком и полностью зависеть от самого процесса.
На открытом огне
Способ, можно сказать, опробованный нашими предками и ему уже много лет.
Чтобы правильно закалить сталь, без каких-либо точных измерительных приборов, так сказать «на глазок», нужна внимательность, и наберитесь терпения. Единственным способом проверки может являться магнит.
Когда металл достигает определенного для него точки накала, так называемой точки Кюри, он перестает взаимодействовать с магнитом.
И еще один признак, это цвет самой заготовки, она должна стать темно-красной. Но также в процессе нужно следить, чтобы не появлялось синих или черных пятен, это говорит о перегреве. Заготовку стоит класть в угли, когда цвет пламени от них будет малиновый.
- минеральное масло в емкости (можно отработку);
- ведро с водой;
- хорошо подготовленные угли;
- длинные металлургические клещи.
Закалка ножа на открытом огне.
После того как деталь приобрела нужный оттенок и не магнитится, нужно аккуратно взять ее клещами и опустить в масло на 3-и секунды, и так нужно поступить несколько раз. С каждым разом удерживая заготовку в масле немного дольше. И в конечном этапе погружаем ее в воду.
Как изготовить камеру для закаливания металла
Понятно, что изготавливая такую камеру, к процессу лучше подойти серьезно, так как делать вы ее будете не на один день или раз. Попробуем кратко описать процесс изготовления такой камеры, также называют ее – муфельная печь.
- Главное, правильно изготовить «тело» такой камеры, здесь прибегают к простому процессу. Будущая горловина изготавливается из любого бумажного твердого материала (типа картон), обмазывается огнеупорной глиной толстым слоем. Не забываем сделать тонкую прослойку парафина, между формообразующим бумажным материалом и глиной.
- Вторым этапом, минимум сутки высушивается будущая камера, а затем помещается в духовой шкаф и прокаливается на невысокой температуре около 90-110 градусов по Цельсию. После этого этапа бумажную составляющую уже можно извлекать.
- Окончательный обжиг конструкции происходит на открытом огне при температуре около 900 градусов, затем производится остужение при естественных условиях. Нужно дождаться полного охлаждения камеры.
- После того как заготовка будет остужена, она приобретает свойства камня, становится очень жесткой как кирпич. К ней приделывают дверцы, открывающиеся по горизонтали.
- Заключительным этапом можно назвать обматывание будущей печи проволокой из нихрома, диаметром сечения около 0,75 мм. На всю конструкцию потребуется около 18 метров. Для исключения короткого замыкания при обмотке обмазывать сразу лучше сырой глиной. В корпусе проделываем два отверстия, одно для термопары (измерять температуру), а второе для визуального контроля.
Изготовленная своими руками камера для закалки ножа.
На этом, можно сказать, что печь для каления металла готова. Как видите, нет ничего сложного в изготовлении муфельной печи для дома.
Очень хорошо, если имеется печь для закаливания стали. Ее можно даже приобрести в специализированном магазине, но стоит удовольствие не дешево. Так как закалить нож в домашних условиях, не имея специальной муфельной печи? Выход есть и честно говоря не один.
Но для начала, нужно провести небольшие эксперименты, и подробно запомнить все ваши действия. Если результат окажется положительным, то эти же манипуляции можно производить с уже настоящей деталью.
Такой хитрый прием, поможет «набить руку» на небольших заготовках и приобрести навыки нагрева и охлаждения клинка. Нельзя забывать, что для разных сплавов, требуется разная температура и способы охлаждения, а иначе не избежать трещин и хрупкости заготовки.
Источник нагрева
В основном можно выделить несколько источников нагревания заготовки. Муфельную печь, лучше исключить, так как по всем экспертным оценкам – она самая лучшая в этом деле. Но мы попробуем оценить другие довольно распространенные приспособления для нагрева.
Кузнечный горн, довольно неплохо, справляется с накаливанием заготовок. Для такой цели может подойти паяльная лампа или пропановая горелка, способом проб и ошибок, можно достигнуть желаемого результата. Кстати, для этих двух вариантов, можно соорудить небольшую печь из огнеупорного кирпича, и процесс будет проще, а результат положительный.
Огнеупорная печь из кирпича для закалки ножа.
Ну и последний, можно сказать, совсем неприемлемый источник нагрева, это газовая плита. Если хотите, что-то испортить воспользуйтесь этим вариантом.
Температурный режим
Как уже много раз говорилось, что каждая сталь требует определенной температуры. На производстве используют специальные термометры для контроля, но в быту можно использовать магнит (также выше говорилось).
Нельзя допускать темных пятен, это перегрев, что впоследствии испортит всю заготовку.
Если у мастера достаточно опыта, то он может на глаз по цвету раскаленного металла определить, достаточно или нет, разогрета заготовка.
Существует и такой метод закалки: нагревается трижды затачиваемая часть клинка до температуры в 285 градусов, а режущую часть только один раз, и до предельных 950-1000 градусов.
Режимы нагрева для каждой марки стали разные:
- низкоуглеродистая сталь требует нагрева в пределах 757-950 °С;
- стали с большим содержанием углерода достаточно и 680-850 °С;
- а вот легирующие марки требуют от 850 до 1150 °С.
Существует целая таблица цветов, цветов каления. К примеру: коричнево-красный 580-650 °С, темновато-красный 780-830 °С или оранжевый 950-1000 °С. Так что будьте бдительны и не перекалите заготовку.
Охлаждение и отпуск
Для правильной закалки нужно выдержать правильный температурный режим при охлаждении. Нержавеющие сплавы предпочтительнее охлаждать в минеральном масле с присадками. А низколегированные стали, в водных растворах с солью, и другими добавлениями.
Охлаждение ножа минеральным маслом с присадками.
Существует много вариантов охлаждения:
- клинки с двусторонними лезвиями, опускают сперва в масло, а затем в водный раствор;
- трижды в масло опускают заготовки раскаленные докрасна, каждое погружение, по времени чуть дольше предыдущего. И только потом опускают в воду;
- для придания упругости середине клинка прогревают эту часть, затем опускают в кипяток на 2 часа, а затем в ледяную воду.
При этих всех манипуляциях стоит учитывать, что в масле металл остывает в два раза быстрее.
Заготовка, прошедшая закалку, для восстановления кристаллической решетки структуры метала, подвергают специальному процессу, который называется– отпуск.
В процедуре этой нет ничего сложного: клинок нужно прогреть в течение пары часов. Для легированной стали 270-320 градусов, для простой 150-200 градусов.
Определение качества работы
Пройдя все вышеописанные этапы, хотелось бы узнать, что из этого выйдет. Как проверить качество проделанной работы, довольно просто:
- заточки должно хватать надолго;
- лезвие не должно сминаться или крошиться при соприкосновении с плотными материалами;
- клинок должен иметь пластичность, изгибаясь – восстанавливать прежнюю форму;
- нормальный инструмент, при регулярной заточке и постоянном использовании, должен прослужить не менее 10 лет.
Не забывайте, что настоящее мастерство приходит с опытом. А опыт, как известно – сын ошибок трудных.
Если не получилось с первого раза, или со второго, то проявите настойчивость – с десятого выйдет не хуже, чем у других. Изучайте материал, упражняйтесь и ваяйте истинную красоту.
Суть закалки металлических изделий
Для того чтобы правильно закалять железо и другие металлы, следует рассмотреть суть этого процесса.
К особенностям этой разновидности термообработки можно отнести следующее:
- Закаливать — это значит, нагревать материал до температуры, которая может изменить структуру. У металлов структура представлена кристаллической решеткой.
- Процесс предусматривает также охлаждение материала, для чего может использоваться масло или вода.
Целью подобной термической обработки является увеличение твердости структуры стали или другого сплава.
С закалкой также связан процесс, получивший название отпуск. Он проводится для того, чтобы снизить хрупкость структуры после термической обработки. Отпуск проводится при более низкой температуре, а на охлаждение уходит намного больше времени. Важность этого процесса велика, иначе в структуре могут образовываться серьезные дефекты.
Какие металлы можно закалить

Следует учитывать, что не все металлы подходят для подобной термической обработки. Очень часто проводится улучшение физико-механических качеств конструкционных сталей, к примеру, стали 45, а также некоторых легированных сплавов (65Г, У7Х).
Алюминий и многие другие цветные сплавы подвергаются термической обработке, при которой кристаллическая решетка остается неизменной. Это можно достичь путем нагрева до невысоких температур с последующим быстрым охлаждение в различной среде.
Особенности технологии
Можно выделить 3 основных этапа термической обработки стали:

- Отжиг. Для начала проводится нагрев структуры до температуры, которая выбирается в зависимости от типа закаливаемого материала (для У7 +780°С). После нагрева металл оставляют в печи для медленного охлаждения.
- Закалка. После выполнения отжига наступает этап закалки. В зависимости от типа металла температура нагрева может варьировать в пределах +800…+1000°С и выше. В домашних условиях можно достигнуть лишь показателя +800°С или чуть выше. Нагрев проводится до момента, пока металл не станет полностью красным, при этом графит и вся кристаллическая решетка перестраивается. Охлаждение может проходить в воде, но лучше использовать масло, что позволит снизить вероятность появления серьезных дефектов в структуре. При этом следует учитывать, что при нагреве масла может образовываться дым и другие продукты горения, которые вредны для человека.
- Отпуск. За счет отпуска можно существенно снизить хрупкость структуры, при этом изделие выдерживается в духовке на протяжении 1 часа или более при температуре не выше +320°С. Важно учитывать, что на этом этапе не должно происходить перестроение кристаллической решетки, т. к. сильный нагрев может привести к снижению твердости поверхностного слоя.
Закалка ножа в домашних условиях осуществима, этого потребуется обычная печь, место для проведения работы, а также емкость с маслом или водой для охлаждения металла.
Много внимания уделяется выбору способа охлаждения стали. Различают следующие методы:

- Применение одной среды.
- Охлаждение при использовании двух жидкостей.
- Струйный метод снижения температуры поверхности металла.
- Метод ступенчатого охлаждения, применяемый для снижения напряжений в структуре материала.
При проведении закалки в домашних условиях следует учитывать, что слишком быстрое охлаждение становится причиной повышенной хрупкости структуры. Важно обеспечивать равномерное охлаждение, что позволяет получить равномерную структуру.
При работе с раскаленной сталью следует соблюдать осторожность. Нельзя проводить подобные работы вблизи легковоспламеняющихся материалов.
Какие стали можно закаливать?
Процедурам закалки и отпуска не подвергается прокат и изделия из него, изготовленные из малоуглеродистых сталей типа 10, 20, 25. Этот вид термообработки эффективен для углеродистых сталей (45, 50) и инструментальных, у которых в результате твердость увеличивается в три-четыре раза.
Таблица режимов закалки и областей применения для некоторых видов инструментальных сталей
Марка стали Для какого инструмента используется Температура закалки, °C Температура отпуска, °C Охлаждающая среда для закалки Охлаждающая среда для отпуска У7 Молотки, кувалды, плотницкий инструмент 800 170 Вода Вода, масло У7А Зубила, отвертки, клейма, топоры 800 170 Вода Вода, масло У8, У8А Пуансоны, матрицы, стамески, пробойники, ножовочные ручные полотна 800 170 Вода Вода, масло У10, У10А Деревообрабатывающий инструмент, керны, резцы строгальные и токарные 790 180 Вода Вода, масло У11 Метчики 780 180 Вода Вода, масло У12 Надфили 780 180 Вода Вода, масло Р9 Метчики, ножовочные полотна станочные, сверла по металлу, фрезы 1250 580 Масло Воздух в печи Р18 Ножовочные полотна станочные, сверла по металлу, фрезы 1300 580 Масло Воздух в печи ШХ6 Напильники 810 200 Масло Воздух ШХ15 Ножовочные полотна станочные 845 400 Масло Воздух 9ХС Плашки, сверла спиральные по дереву 860 170 Масло Воздух Как закалить сталь в домашних условиях?
Закалку и отпуск желательно осуществлять в производственных условиях с использованием специального оборудования и приборов. Однако домашние умельцы часто практикуют это в собственных мастерских. Для нагрева изделия используют электроплиты, духовки, раскаленный песок, паяльные лампы, костер. Самостоятельная термообработка оправдана в случае необходимости упрочнения режущей кромки инструмента.
Как сделать закаленную сталь:
- перед термообработкой изделие необходимо очистить от масла и ржавчины;
- равномерно разогреть;
- охладить и произвести отпуск в соответствии с режимами, рекомендованными для конкретной марки стали.
При необходимости проведения термообработки в домашних условиях в отсутствии приборов температуру металла ориентировочно определяют по цветам побежалости. Условие – помещение не должно быть освещено солнцем.
Определение! Цветами побежалости называют оксидные пленки, образующиеся без участия молекул воды на сплавах на основе железа во время нагрева. Каждому интервалу температур соответствует определенный цвет:
- темно-коричневый – 530-580°C;
- коричнево-красный – 580-650°C;
- вишневый – 650-730°C;
- вишнево-красный – 730-770°C;
- вишнево-алый – 770-800°C;
- светло-вишнево-алый – 800-830°C;
- ярко-красный – 830-870°C;
- красный – 870-900°C;
- оранжевый – 900-1050°C;
- темно-желтый – 1050-1150°C;
- светло-желтый – 1150-1250°C;
- желто-белый – 1250-1300°C;
Ослепительно белый – более 1300°C.
Как выполнить закалку?
Когда есть горн, то закалку можно выполнить довольно просто:
- Сначала разводят огонь. Для розжига используют древесину небольшого формата (щепки, мелкие ветки, стружку от деревообработки и бумагу).
- Готовят емкости, в которых будут производить закалку. Минеральное масло (отработка от двигателей внутреннего сгорания) является лучшим охлаждением для деталей. Ёмкость должна позволять загрузить деталь полностью. Синтетические и полусинтетические масла использовать можно, но следует иметь в виду, что некоторые могут закипать. Скорость охлаждения будет снижаться. Поэтому использование подобного масла применяют с осторожностью.
- Емкость для воды нужна, чтобы промывать детали после закалки.
- Потребуется уголь. Используют бурые и черные угли. На практике часто применяют древесный уголь, полученный после обработки березы.
- Чтобы брать заготовку и перемещать ее внутри кузни, понадобятся клещи. У опытных кузнецов имеются несколько типов клещей.
- После получения стабильного огня на колосниках можно подсыпать уголь. Сначала он разгорается медленно. При включении подачи воздуха начинается интенсивный разогрев. Угольки меняют окраску на белый цвет.
- Пора закладывать деталь, которую хотят закалить. Ее кладут в огонь. Наблюдают за разогревом.
- Нужен магнит. Он покажет, наступил нужный нагрев или нет. Аустенит не магнитится.
- При возникновении свечения темно-вишневого цвета можно рассчитывать на нагрев до близких значений температуры.
- Вынимают заготовку и пробуют, намагничивается она или нет. Если нет, то температура достигнута.
- Нужен прогрев не менее 15…20 минут. Теплопроводность разогретого металла низкая, поэтому внутри массивных предметов может возникнуть не полный прогрев. В этом случае при закалке наблюдают изгибы.
- Вынув деталь из огня, ее опускают в масло в несколько этапов. Опускают и поднимают ритмичными движениями. Так добиваются высокой скорости охлаждения. Поднимая и опуская, перемешивают охлаждающую жидкость в процессе закалки. Может возникнуть пламя. Оно быстро погаснет.
- Остается промыть деталь.
- Проверить произошло закаливание или нет можно напильником. Если напильник «не берет», значит, произошло закаливание.
Испытывают качество закаливания на стекле. Если удается оставить след на стекле закаленной деталью, то получена твердость HRC более 55 единиц.
Рейтинг металлов

Я выступлю борцом за социальную справедливость, потому что вижу в этом списке дискриминацию по металлическим свойствам. Где таблица неметаллов? Если кто-то хрупкий и забирает электроны, то это повод его игнорировать? Мне кажется вы самый настоящий неметаллофоб!
А где же открытие всяких Калифорниев? Тоже ведь металл открытый в 20 веке.
А где ртуть на всяких шкалах Мооса? А её царапают при температуре меньше -38.73? Если да, то как вообще определяется температура, при которой царапается металл? Если нет, то как она вообще царапается O_o
Пошел погуглить, делают ли богатые люди проводку из серебра у себя дома или какие там ограничения кроме цены, а там пиздец творится, аудиофильские кабели отливают, в страйкболе какой-то срач на эту тему.
Хром, сука, оказывается самый твердый, а я его на физике в школе ножовкой пилить пытался неделю.
Помню-помню. Куб из золота с ребром 37 см весит тонну.
Надо же, оказывается, у ртути электропроводность не очень, хотя ртуть применяется именно как проводник, например, в ртутных выключателях или в полярографии. И, напротив, вольфрам входит в топ 10 проводников, хотя вольфрамовая нить в лампочке накаливания является резистором.
У лития прямо таки аномально высокая теплоемкость. Не знал
Это наверное единственный случай когда использование сименсов целесообразнее омов.
Медь открыли раньше чем золото? Что-то не уверен. Золото ведь чаще встречалось в самородной форме, а медь обычно надо еще догадаться выплавить.
В шкале Мооса новый недавно открытый элемент — Рубилий))
Осмий топ металл, хотел бы я себе броню из него. Нужен правда мощный экзоскелет, но все же
Я так понял, что позолоченные провода всюду только из-За склонности серебряных к окислению, проводимость лучше ведь у последних. Хотя, Может золото просто пафоснее и лучше продается)
в таблицах полно ошибок
А почему ртуть в списке минимальной температуры плавления на первом месте, хотя у цезия и галлия Т плавления ниже?
Такс, а где уран в таблице плотности? 19,05 г/см³ МЕЖДУ ПРОЧИМ =)
В рейтинге металлов на первом месте должна стоять Metallica, а не какой-то там сраный литий с осмием.
Электропотенциал где? Важнейшая практическая характеристика.
А то повадились скрутки меди с алюминием плодить.
А как же злой карлик Нико( никель) и гномы кобальды (кобальт ). PS все нашел их☺
В таблице плотности нет бериллия! Свободу бериллию!
Вольфрам оказывается очень крутой металл. Очень прочный, твердый и его хрен расплавишь.
Я за вольфрам болел. Оле Оле Олле оле.
Это Рубидий-то нерадиоактивен.
Что произошло между 1000 до н.э. и 1735 годами н.э.?

Вопрос про оголённый конец
Вооружившись прошлогодним салатом, наблюдаю шедевры синематографа, и в одном из них весьма затейливо умертвили персонажа. У меня возник нубский вопрос: если я стою в широченной луже с одного края, а с другого края в лужу падает оголённый электропровод, меня ёбом токнет, или же электричество по кратчайшему пути должно пойти через воду в землю?
И как вообще выглядит движение электронов из провода в землю? Почему они стремятся в землю, как разбегаются по площади и куда в земле деваются?
Пожалуйста, не пинайте за глупые вопросы жертву системы среднего образования, а лучше поддержите знаниями.

Ломаем голову, господа геологи, химики-аналитики и просто пытливые умы:




Правда ли, что Фаренгейт принял за 100 градусов температуру тела своей больной жены?

Согласно распространённой версии, немецкий естествоиспытатель собирался зафиксировать важную отметку на своей шкале на уровне нормальной температуры человеческого тела. Однако у его супруги в этот момент был жар, из-за чего сегодня 100 °F соответствует 37,8 °C. Мы проверили, насколько правдоподобна эта легенда и разобрались в истории появления температурных делений.
(Спойлер для ЛЛ: неправда)
Если воспользоваться онлайн-калькулятором для перевода градусов Фаренгейта в более привычные нам градусы Цельсия, то получим следующий результат:
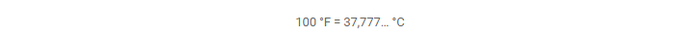
То есть, действительно, если версия с температурой тела как мотивом истинна, то эталоном для Фаренгейта должен был послужить не совсем здоровый человек. Ознакомимся с историей появления его изобретения поподробнее.
Даниэль Габриэль Фаренгейт родился в 1686 году в Данциге (нынешнем Гданьске) в немецкой семье. С юных лет он проявил интерес к естественнонаучным экспериментам, и позднее, когда уже обосновался в Нидерландах, изготовил термометр и барометр. Сначала термоскопической жидкостью ему служил спирт, однако около 1714 года он заменил спирт ртутью, чем достиг гораздо большей точности измерений. Наконец, в 1724 году он предложил принципиально новую шкалу, которая станет стандартом в англоязычных странах для метеорологических, промышленных и медицинских целей на следующие два с половиной века. Для перевода температуры по этой шкале в градусы Цельсия и обратно используются следующие формулы:
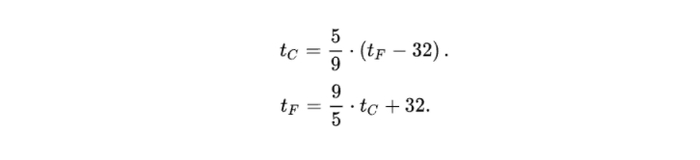
Многие люди, впервые сталкивающиеся с ними, сетуют на неудобство подобного преобразования. Однако шкала Цельсия была предложена на 18 лет позже, в 1742 году, то есть вопросы в данном случае должны быть обращены не к Фаренгейту.
Итак, что мы знаем сегодня о трёх калибровочных точках шкалы Фаренгейта?
Задумавшись о подходящей разметке для своего будущего термометра, Фаренгейт в 1708 году посетил пожилого датского астронома Оле Рёмера (не путать с Реомюром), который разработал собственную шкалу. Следует отметить, что у Рёмера температура кипения воды равнялась 60 градусам, за ноль была взята температура очень холодной зимы в Дании, вода замерзала при 7,5 градуса, а нормальная температура тела составляла 22,5 градуса.
Много лет спустя в письме к другому физику Фаренгейт расскажет об этом своём визите:
Таким образом, за базу своей шкалы Фаренгейт взял разработку Оле Рёмера, однако для удобства умножил некоторые (но не все, как мы убедимся далее) числа на 4. При этом уже в описании шкалы датчанина упоминается некая «температура тела». Однако это не даёт точного ответа на вопрос о калибровочных точках. В своей публикации 1724 года Фаренгейт пишет, что в его шкале таковых используется три: максимально низкая температура смеси льда, воды и нашатыря или даже морской соли» (0 °F), температура таяния льда (32 °F) и температура тела (96 °F). Однако это не совсем корректное сообщение. Как отмечают современные учёные, в первом случае можно получить +5 °F или даже –8 °F (в случае морской соли), то есть это даже не одна и та же величина, не говоря уже о несоответствии нулю. Возможно, права легенда о том, что за ноль было взято положение столбика в аномально холодную зиму 1708–1709 годов в Данциге (а не в Дании).
После смерти Фаренгейта его шкала немного поменялась. В 1776 году комиссия Лондонского Королевского общества во главе с Генри Кавендишем приняла решение откалибровать шкалу так, чтобы вода замерзала ровно при 32 °F, а кипела, соответственно, при 212 °F (расстояние в 180 градусов — круглое число, особенно для градусов). Так что сегодня «нормальная температура тела» составляет не 96 °F, как при Фаренгейте (сейчас это было бы равно 35,56 °С), а 97,88 °F (в подмышечной впадине) и 98,6 °F (во рту).
Да, и, наконец, о жене Даниэля Фаренгейта. Увы, увлечённый своими опытами, за всю свою жизнь он так ни разу и не женился.

Ещё нас можно читать в Телеграме, в Фейсбуке и в Вконтакте.
В сообществах отсутствуют спам, реклама и пропаганда чего-либо (за исключением здравого смысла), а в день обычно публикуем не больше двух постов.


Изготавливаем электролюминесцентный индикатор по технологиям 60-х годов
В прошлый раз я показал вам свою коллекцию советских электролюминесцентных индикаторов. Я капитально подсел на эту тему и за последние три месяца получил технологию изготовления самодельных индикаторов, которые уже не стыдно показать читателю.
Думаю еще через несколько месяцев я смогу написать уже Исчерпывающее руководство по изготовлению самодельных индикаторов, с подробным обоснованием всех возможных комбинаций материалов, но пока же ограничусь описанием проведенных экспериментов и полученными текущими результатами.

Время в чёрной дыре
Что такое световые конусы? В чём разница между временем и пространством? Почему время и пространство меняются ролями внутри чёрной дыры? Что такое диаграмма Пенроуза? В видео от ScienceClic в моей озвучке.

Загадки Вади-эн-Натрун. Как египетские жрецы изобрели важнейшую технологию на 2000 лет раньше чем европейские учёные
Когда вы учились в 5 классе, школьный учитель, почти наверняка, рассказывал вам легенду, о том, как финикийские торговцы изобрели стекло, выложив куски белого вещества вокруг костра на песчаном берегу. Но эта история, не так проста, как может показаться. Она таит в себе загадки даже для современных учёных – историков, лингвистов и химиков. Ответы на эти загадки могут перевернуть наши представления о технологиях Древнего мира.

Финикийцы. Иллюстрация из игры Humankind.
О чём будет пост.
В данном посте мы познакомимся с последними исследованиями археологов и химиков, а также проведём небольшое расследование, открывающее поразительные факты о древних технологиях. Мы отправимся с вами в бронзовый век и совершим путешествие с группой финикийских купцов, побываем в оазисах Египта, на побережье Ливана, в мастерских древнего Шумера, перенесёмся во Францию XVIII века, расшифруем таинственные римские записи и с помощью археологов, историков и лингвистов откроем тайны древних гениев. Мы узнаем, как египетский жрец на тысячелетия опередил французского учёного в создании важнейшей химической технологии; узнаем что делали древние охотники за ископаемыми с костями мифических чудовищ; из чего раньше делали соду; как переводчики перепутали её с селитрой, и как это сделало современные названия химических элементов слегка нелепыми; почему химические заводы были самыми высокими сооружениями в XIX веке; а также почему учебники химии и Википедия умалчивают о первенстве российского академика в изобретении наиболее важного метода промышленной химии, и называют первооткрывателем французского врача?

Гавань финикийского города Библос, кедровую древесину доставляют на берег. Иллюстрация Balage Balogh с сайта Archaeology Illustrated.
Древняя легенда и трудности перевода.
Ученикам 5-х классов обычно рассказывают легенду об изобретении стекла финикийскими моряками. Авторам школьного курса она известна из книги «Естественная история» римского писателя букв стилосом по восковой табличке Плиния Старшего. Давайте посмотрим на оригинальный текст. Нас интересует параграф 191 книги XXXVI, где Плиний пишет:
Слово nitri в русском переводе Г.М. Севера интерпретируется как «селитра». Аналогично в переводе Вестника древней истории — это селитра. Селитрой называют нитрат калия (KNO3) или натрия (NaNO3); стекло из неё не делают (#comment_220486655). Химику вполне очевидно, что речь в данной легенде шла не о селитре, и везли финикийцы вовсе не её. Да и стекло финикийцы не изобретали, как то утверждают Плиний и учебник истории Древнего мира для 5 класса (кто изобрел стекло и как учёные химики и археологи это поняли, мы узнаем ниже). Тем не менее, история про финикийцев имеет правдивые основания. Они действительно перевозили через море некое белое вещество, которое пользовалось огромным спросом в Древнем мире (и тогда это был не героин). А описанный Плинием торговый путь был крайне важен для технологического развития человечества. Место добычи белого камня nitri имело такую огромную значимость, что дало название многим современным химическим веществам. Что же это за вещество, откуда, куда и зачем возили его финикийцы?
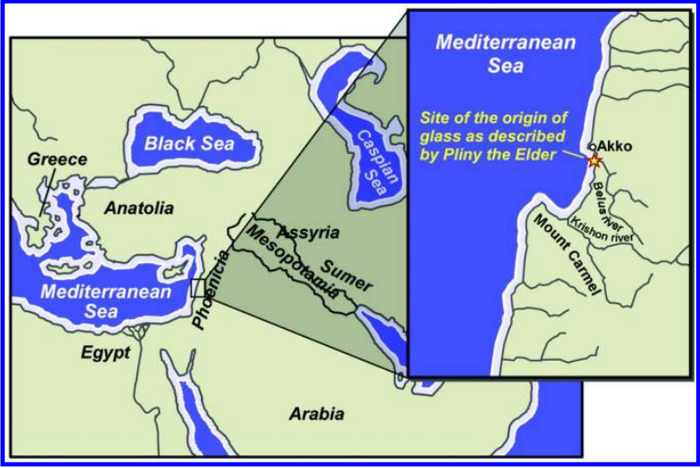
Карта Ближнего Востока эпохи бронзового века. Показано место открытия стекла, описанное Плинием Старшим — устье реки Белос (сегодня Нааман). Источник.
Вади-эн-Натрун. Ливийская пустыня. Египет. Около 1500 год до н.э. (место на карте).
Перенесёмся в Ливийскую пустыню, в долину в 100 км на западе от столицы древнего Египта Мемфиса. Там есть цепочка из 10 озер, расположенных на 23 метра ниже уровня моря. Египтяне ещё до эпохи Нового царства (1550—1069 годы до н. э.) отжали это местность у ливийских племён. Долина была крайне примечательным местом. Древние путешественники находили здесь кости мифических существ. По мнению историка античной науки Адриенны Майор многие кости вывозились и выставлялись в храмах в качестве пруфов, доказывающих правдивость мифов о грифонах, гигантах и монстрах (у неё есть целая книга на эту тему — The First Fossil Hunters, очень захватывающее чтиво).
Берега водоёмов выглядели как Чудское озеро после Ледового побоища. Они были как будто покрыты снегом и льдом с кровавыми подтёками. Хотя вокруг жара, словно кто-то решил приготовить из тебя запеканку на ужин. Настоящий фантастический пейзаж.
Толстая корка белого едкого вещества толщиной до полуметра, покрывающая берега, это вовсе не поваренная соль. Египтяне называли это вещество nṯrj, что означает чистый, божественный. От этого название и происходит слово nitra, которое использовал Плиний, финикийцы и все народы ойкумены. Вещество было настолько важно для египтян, что всю долину назвали в честь него – долина Натрона (Вади-эн-Натрун по-арабски).


Юго-восточный край озера Фазда. Источник.
Египетские жрецы нуждались в этом веществе. Натрон отличался исключительной гигроскопичностью (впитывал воду) — хорошее подспорье для изготовления мумий. А охотники и рыбаки использовали его для сушки рыбы. Но ещё большее значение натрон сыграл в развитии ремесла и новых технологий бронзового века. Белые и красные куски собирали с помощью шестов и лопат и раскладывали для просушки на берегах. Затем натрон в корзинах доставляли на Нил, где его отправляли потребителям. Натрон пользовался огромным спросом у купцов и был очень важным товаром. И именно натрон везли финикийские купцы из рассказа Плиния Старшего. Но для чего он был нужен, куда и зачем его везли — это мы обсудим позже. Для начала выясним, что же представляла из себя эта бесценная субстанция?

Нил, Боковой канал. Иллюстрация Balage Balogh с сайта Archaeology Illustrated.
Химический контекст. Парадокс натрона.
Тут будет немножко сложно. Минерал натрон это декагидрат карбоната натрия (Na2CO3*10H2O). Что-то вроде соды. Минерал, не сложно догадаться, назван в честь озера. И считалось, что озеро было одним из главных источников, таких минералов как натрон (Na2CO3*10H2O) и трона (Na2CO3*NaHCO3*2H2O) или, проще говоря, природной соды. Но недавние исследования химического состава показали, что отложения вокруг содержат очень мало карбоната натрия. Белое вещество в основном состоит из буркеита (Na6CO3*2SO4) и галита (NaCl). Иными словами, «натрон» состоит из натрона меньше чем наполовину. Можно было предположить, что за тысячи лет просто поменялся состав озера. Но проблема в том, что проведённые анализы древнего «натрона», собранного из гробниц, дали аналогичные результаты и показали присутствие сложного состава из карбонатов, сульфатов и хлоридов натрия. Таким образом, как утверждают британские исследователи, финикийцы не могли получать стекло, используя сырьё из Вади-эн-Натрун. Если только египтяне не.
Впрочем об этом потом. Давайте сначала узнаем, куда и зачем могли везти натрон финикийские купцы.

Сара, жена Авраама и служанка торгуются за ткань. Том Ловелл. Напомню, что действие происходит в шумерском городе Уре согласно Библии.
Шумер. Южная Месопотамия. Ранее 2500 года до н.э. (место на карте).
Кроме плодородной почвы и стад овец в Шумере было скудно с ресурсами. Шумер был производственным центром Древнего мира, в который стекалось сырьё и вытекала продукция перерабатывающей промышленности: в первую очередь бронзовые изделия и ткани.
Текстильное производство было одной из наиболее важных отраслей в Месопотамии. Ткани делали из шерсти овец и льна. Но в первую очередь из шерсти овец. Шерсть овец содержит ланолиновые жиры, чтобы ткань можно было покрасить, жир следует удалить. И для этого нужны были щёлочные растворы. В дальнейшем совершенствование этой практики привело к изобретению мыла в 2500 году до н.э. (об этом я расскажу в следующем посте). Но пока мыла не было, приходилось его делать, так сказать, in situ, то есть непосредственно в процессе обработки ткани при взаимодействии щёлочного раствора с жиром. Щёлочной раствор можно было бы приготовить из того самого натрона, но торговля с Египтом ещё не была налажена. Да и Египет едва ли тогда так хорошо контролировал Вади-эн-Натрун. Где же взять натрон? И здесь шумеры сделали революционный скачек эквивалентный неолитической революции, когда добыча еды (присваивающая экономика) сменилась производством еды (производящим сельским хозяйством). Вместо добычи сырья из природы люди стали его производить.

Ур, Шумер, Южная Месопотамия, Великая гавань и Зиккурат. Archaeology Illustrated.
Химический контекст. Зола.
Зола это минеральный остаток после горения древесины, растений и другого топлива. Она состоит из различных компонентов, таких как карбонат кальция, фосфатов, сульфатов. Многие из них нерастворимы в воде. Но значительную часть составляют карбонаты калия (K2CO3) и натрия (Na2CO3). Первое называется поташ, второе сода. Оба вещества гидролизуются в воде, давая щёлочной раствор. В дальнейшем оба вещества стали основой для производства мыла и стекла во всём мире. И мыло, и стекло можно делать как из соды, так и из поташа. Но сода лучше – из поташа получается жидкое мыло, а стекло слишком тугоплавкое и хрупкое.
Проблема в том, что в золе большинства деревьев и трав преобладает именно карбонат калия (поташ). Но в случае некоторых травянистых растений и водорослей зола преимущественно содержит карбонат натрия. Одно из таких растений солянка содоносная (она же барилла) — основной источник кальцинированной соды вплоть до середины XIX века.
Раньше даже считалось, что слово «сода» происходит от арабского названия этого растения. Но в те времена это вещество называлось во всех языках Ближнего Востока словом nitra. Именно от этого слова происходит название элемента «натрий». Состава веществ никто не знал, поэтому в Средние века слово nitre стали использовать и для селитры (нитрат калия или натрия; видимо по принципу того, что это легко растворимые в воде соли), а в XVI веке, когда селитра для производства пороха стала актуальнее соды, слово nitre как обозначение солей азотной кислоты окончательно вытеснило первоначальный смысл Помните странные переводы легенды о финикийских купцах, где стекло делали из селитры? Именно этим объясняется ошибка в русских переводах «Естественной истории» Плиния Старшего, где латинское nitre перевели как селитра. В итоге и «натрий» и «нитрат» восходят к египетскому «божественному» nṯrj. А латинское название азота (nitrogen) можно скорее перевести как “порождающий соду”, что с точки зрения химии звучит немного абсурдно.

Шумер, Типичный пейзаж с каналом. Archaeology Illustrated.
Изобретение стекла. Месопотамия или/и Египет, 3000-2500 года до н.э.
Жители Шумера активно торговали шерстью и тканями, меняли их на медную и оловянную руду. Металлургия была второй по важности отраслью местной экономики. Шумер родина бронзы. Руда, из которой выплавляли металл, содержит примеси, такие как кварц и алюмосиликаты. И они очень плохо плавятся. Например, температура плавления кварца 1728 °C. Для древних печей достичь такой температуры было не реально. Нужен флюс. Флюс это добавка, которая способствует плавлению примесей. И угадайте, что использовали в качестве флюса? Древние металлурги к плавильной смеси добавляли ту же самую золу. Выглядело это как на картинке ниже.
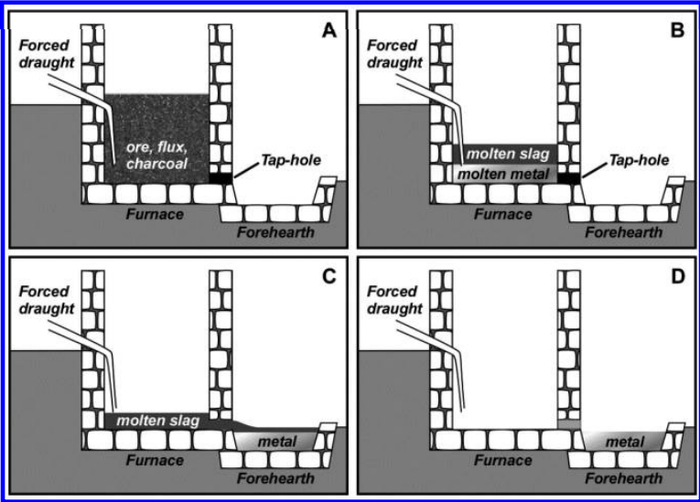
Основной процесс плавки: A) руда, флюс и древесный уголь смешиваются в плавильной печи и обжигаются; B) При нагревании образуются несмешивающиеся слои расплавленного металла и шлака; C) Летка (отверстие для выпуска металла и шлака) открывается. Металл/шлак, собираются в накопителе; D) Жидкий шлак снимается, а металлу дают остыть. Из книги Chemical Technology in Antiquity.
Таким образом, кроме целевого продукта получался красивый блестящий материал. Иногда он выкатывался отдельными шариками. Они не были прозрачными. Из-за меди они имели красивый синий оттенок. Такие шарики были похожи на полудрагоценные камни – лазурит и бирюзу, которые обожали древние египтяне. Именно такие бусинки находят в Египте и Месопотамии. В частности сетчатые платья служанок фараонов делали из подобного материала (про эти платья я писал отдельный пост).
Именно древние металлурги, как считают современные историки, археологи и химики, изобрели стекло, а вовсе не легендарные финикийские купцы. Есть и альтернативная версия появления стекла, связанная с древним производством керамики и фаянса. Но это другая история, которую я расскажу в следующем посте.
Позднее стекольное производство в Египте достигнет больших масштабов. К эпохе Нового царства (XVI-XI века до н.э.) стеклянные сосуды станут обычной вещью. А в период Античности наступит золотой век стекла. В Александрии будет создан один из наиболее известных шедевров стекольной индустрии древности – кубок Ликурга. Благодаря применению древних нанотехнологий достигался удивительный оптический эффект: кубок имеет зеленый цвет в отражённом свете и красный в проходящем (об этом я писал в одном из прошлых постов). Известно, что для производства стекла использовался карбонат натрия из Вади-эн-Натрун. Помните? Тот, из которого невозможно сделать стекло. Если только египтяне его каким-то образом предварительно не обрабатывали, чтобы превратить хлориды и сульфаты в карбонат натрия.

Бегемот «Уильям». Среднее царство, ок. 1961–1878 годов до н.э. Гробница B3 номарха Сенби II. Сделан из египетского фаянса. Египетский фаянс конечно же не имеет отношения к фаянсу. Египетский фаянс это материал, сделанный из кремнезёма, щелочи (либо зола, либо натрон), извести и придающей голубую окраску примеси меди. В процессе обжига щелочь (действующая как флюс) и известь (действующая как стабилизатор) реагируют с кремнезёмом, образуя глазурь на поверхности. Ядро остаётся рыхлым. Метропόлитен-музей.
“Хлеб насущный” промышленной революции в химии.
Давайте теперь перенесёмся в Европу XVIII века. Англия, Франция и их соседи переживают невиданный рост экономики и производства. Как и 3000 лет до этого сода остаётся незаменимой в текстильной промышленности, при производстве мыла и стекла. Спрос на данное сырьё рос небывалыми темпами, и к XVIII веку потребности превзошли возможности производства соды, сжиганием водорослей и галофитов.
К концу XVIII века десятки тысяч тонн соды, полученной сжиганием водорослей и бариллы, поставлялись из Шотландии и средиземноморского побережья. Чтобы удовлетворить потребности промышленности приходилось сжигать миллионы тонн растений.
В 1775 году французская Академия наук предлагает премию в 2400 ливров (среднегодовая заработная плата в Париже была равна 452 ливра) за разработку способа получения соды из соли. К этому времени многие химики работали над этой проблемой.
Например, российский академик Эрик Лаксман в 1764 году открыл способ получения соды спеканием сульфата натрия (мирабилит) с древесным углем. Способ был успешно опробован на стекольном заводе в городе Тальцинск (около Иркутска) в 1784 году. Но по сложившейся традиции в России это было никому не интересно (настолько, что об этом не упоминает даже Википедия), изобретение никакого развития не получило и было благополучно забыто.
Поэтому первым разработчиком действительно практически значимого в промышленных масштабах процесса считается Николя Леблан — врач герцога Орлеанского. Леблан предложил свой способ в 1787 году.
Вначале морскую соль обрабатывали серной кислотой при температуре 800—900 °С, так что образующийся хлороводород улетал, делая процесс весьма неприятным для тех кому не повезло жить рядом с производством. Поэтому трубы заводов в последствии достигали 140 м в высоту и являлись одними из самых высоких сооружений в мире на тот момент. На следующей стадии смесь сульфата натрия, карбоната кальция (известняк или мел) и древесного угля запекали при температуре около 1000 °C. Уголь восстанавливал сульфат натрия до сульфида, который реагировал с карбонатом кальция. Полученный продукт содержал растворимую соду и нерастворимый сульфид кальция. Поэтому целевой продукт просто вымывали водой и чистили перекристаллизацией.
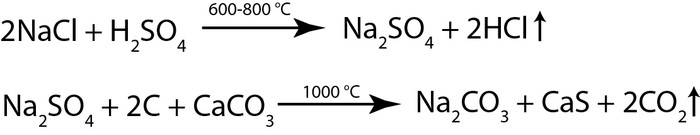
В 1791 году Леблан получил патент на свой метод, открыл несколько заводов в Сен-Дени, Руане и Лилле, производя в год по 320 тонн кальцинированной соды. В 1794 завод был конфискован французским революционным правительством. Позднее Наполеон попытался вернуть Леблану заводы, но тот,
вероятно от радости,застрелился.По мнению специалистов в области истории технологии Т. Дерри и Т. Уильямса метод Леблана оставался одним из наиболее важных промышленных процессов в течение столетия. Первый завод по производству соды методом Леблана в России открылся в 1864 году. Ровно через 100 лет после того как этот способ изобрел Лаксман… и через 3 года после того как был предложен более современный способ получения соды по методу Сольвье.

Assassin Creed Unity, Леблан вполне бы мог быть героем этой игры. Интересно, кем бы он был, ассасином или тамплиером?
Таинственный отрывок из книги Плиния Старшего.
В «Естественной истории» Плиния Старшего есть фрагмент, которой долго не могли объяснить. Плиний считал, что египтяне смешивали натрон с «известью».
Кроме того, похоже, что натрон плавили с серой на угольном огне.
Таким образом, Плиний, кажется, обсуждает обработку натрона в сочетании со словами «известь», «сера», «древесный уголь» и нагревание. Что-то это описание напоминает.
В 2011 году группа британских учёных показала, что описанный Плинием метод позволяет получить хорошее стекло, близкое по составу к римскому стеклу. Возможно, что ранняя версия процесса Леблана применялась для очистки натрона из Вади-Натрун, чтобы сделать его пригодным для использования в стекольном производстве. Это могло произойти более чем за 2000 лет до получения Лебланом своего патента.

Знаменитая картина Карла Брюллова «Последний день Помпеи». Этот день, вероятно, стал последним и для Плиния Старшего, он умер в 79 году во время извержения Везувия отравившись серными испарениями, решив понаблюдать за редким явлением природы вблизи. Это случилось всего через год после издания его монументального труда «Естественная история».
В качестве заключения приведу одну из любимых цитат из Библии, которая была написана примерно в ту же эпоху и в том же регионе, о которых шла речь в посте.
На этом у меня всё.
Благодарю за внимание!

Римские леди наслаждаются прохладительными напитками из стеклянных сосудов. Archaeology Illustrated.
Рекомендуемая литература:
Прошлые мои посты по истории химии:

Цвет газов под импульсным полем мини-катушки Тесла
Слева направо. Водород, Гелий, Неон, Аргон, Криптон, Ксенон и Азот.
Эмиссионный спектр газов. Газы подвергаются высокочастотному импульсному полю мини-катушки Тесла. Цвет каждого газа обусловлен смешением цветов, испускаемых при электронных энергетических переходах, специфичных для каждого элемента. (Перевод Гугл)

Энтропия и стрела времени
Что такое энтропия? В каких областях она используется? И как она объясняет направление, в котором происходят преобразования? Об этом в видео от ScienceClic

Теория струн
Как описать гравитацию на квантовом уровне? Почему существуют разные частицы? Как можно проверить существование дополнительных измерений? Ответы в этом видео от ScienceClic.

Тайна снежинок (Veritasium)
Какие тайны скрывает процесс образования снежинок, обеспечивающий такое широкое разнообразие форм и сложность узора? Как выращивать снежинки в лабораторных условиях, влияя всего на два параметра: температуру и влажность, чтобы приблизиться к пониманию того, как работает формообразование кристаллов льда?
Почему гелий меняет наш голос, а также что такое инертные газы
На уроках химии мы слышали об инертных газах. Их еще называют благородными, такое красивое название было дано не с проста, ведь все инертные газы, а именно гелий, неон, аргон, криптон, ксенон, а также радиоактивные радон и оганесон обладают очень низкой химической активностью, их соединения с другими веществами существуют лишь в специальных, экстремальных условиях, а значит, эти газы не горят и не поддерживают горение, более того, не имея цвета, запаха и вкуса они не токсичны для человека, их вообще как будто нет, настоящее благородство!)
Но это не совсем так, инертные газы хоть и не отравляют человека, но наркотически действуют на него, однако это не относится к гелию и неону, поскольку их наркотический эффект проявляется при очень повышенном давлении, впрочем, поэтому наркоманы и не дышат шариками с гелием.
Все благородные газы одноатомны. То есть в одной молекуле газа содержится один атом. Причем химические оболочки атомов полностью заполнены электронами. Что это значит? Вспомните уроки химии — на каждой оболочке атома может быть лишь определенное число электронов: на первой 2, на второй 8 и так далее. Полная заполненность оболочек у благородных газов и объясняет то, что они почти не вступают в химические реакции, потому что просто не способны присоединить к себе больше электронов.
Интересным фактом является то, что инертные газы переходят в жидкое состояние при экстремально низких температурах, при этом почти сразу после переходя в твердое состояние. Таким образом разница между температурой кипения и плавления у веществ состовляющих инертные газы 2-5, максимум 10 градусов.
Правда вот гелий при обычном давлении в твердое состояние так и не переходит. Он кипит при температуре -270 градусов, то есть температуре космического пространства, ниже которой ничего нет, поэтому кристаллизация гелия проходит под давлением в 25 раз больше атмосферного!
Вообще гелий удивителен. Во Вселенной он второй по распространенности после водорода, но на Земле существует в совсем малых количествах, однако не беспокойтесь, на надувание шариков всем хватит). Из за практически самого малого размера атомов гелия, они почти не сталкиваются друг с другом, когда гелий находится в газообразном состоянии, что делает гелий идеальным газом (идеальный газ это такая теоретическая модель, можете посмотреть о ней в Википедии подробнее).
Еще одна занимательная вещь, что гелий, как и все инертные газы светится при пропускании через него электрического тока. Причем при изменении давления внутри газа, можно менять его цвет. Это связанно с тем, что с увеличением давления, электроны начинают чаще сталкиваться с атомами гелия и общая энергия вещества увеличивается, приводя к изменению цвета. Так гелий может светиться желтым, розовым, оранжевым и зеленым цветами.
Но мы то все знает гелий как веселый газ, смешно изменяющий наш голос. Почему так происходит? Тут нужно разобраться, что вообще такое звук, издаваемый нами при выдохе.
По простому звук есть колебание молекул или других мельчайших частиц среды, улавливаемое нашим ухом. Такой средой является воздух. Когда мы издаем какие либо звуки, наши голосовые связки вибрируют, создавая колебания среды, то есть воздуха. Чем чаще колеблятся связки, тем выше высота звука. Если мы вдохнем вместо воздуха гелий, он станет средой для распространения звука. Но из за гораздо меньшей плотности гелия, он создает меньшее давление на голосовые связки, чем воздух, позволяя им вибрировать быстрее и издавать более тонкий звук.
Так, для понижения голоса можно вдохнуть плотный газ, например фторид серы, он в 5 раз тяжелее воздуха и сильно понижает частоту колебаний голосовых связок, позволяя Вам говорить как Халк:).
Какой самый прочный металл в мире — ТОП-5 элементов




У этого металла сразу три достоинства: он прочный, плотный и очень устойчив к коррозии. Кроме того, этот элемент относится к группе тугоплавких металлов, таких как вольфрам. Чтобы расплавить тантал вам придется развести огонь температурой 3 017 °C.
Тантал в основном используется в секторе электроники для производства долговечных, сверхмощных конденсаторов для телефонов, домашних компьютеров, камер и даже для электронных устройств в автомобилях.
Рений
Переходному серебристому металлу рению достается седьмая позиция в нашем списке. Предположение о существовании этого элемента были сделаны Д. И. Менделеевым в 1871 году, а открыть его удалось химикам из Германии в 1925 году. Уже через 5 лет после этого удалось наладить добычу этого редкого, прочного и тугоплавкого металла. На то время за год удавалось получить 120 кг рения. Сейчас количество ежегодной добычи металла увеличилось до 40 тонн. Он применяется для производства катализаторов. Из него также изготавливают электрические контакты, способные самоочищаться.

9. Бериллий

А вот к этому металлическому красавцу лучше не приближаться без средств защиты. Потому что бериллий высокотоксичен, и обладает канцерогенным и аллергическим действием. Если вдыхать воздух, содержащий пыль или пары бериллия, то возникнет заболевание бериллиоз, поражающее легкие.
Однако бериллий несет не только вред, но и благо. Например, добавьте всего 0,5 % бериллия в сталь и получите пружины, которые будут упругими даже если довести их до температуры красного каления. Они выдерживают миллиарды циклов нагрузки.
Бериллий применяют в аэрокосмической промышленности для создания тепловых экранов и систем наведения, для создания огнеупорных материалов. И даже вакуумная труба Большого Адронного Коллайдера сделана из бериллия.
Бериллий
Пятая позиция в списке наиболее твердых металлов досталась бериллию. Его открытие принадлежит химику Луи Никола Воклену из Франции, которое было сделано в 1798 году. Этот металл имеет серебристо-белый цвет. Несмотря на свою твердость, бериллий является хрупким материалом, что сильно усложняет его обработку. Его применяют для создания высококачественных громкоговорителей. Он применяется для создания реактивного топлива, огнеупорных материалов. Металл широко используется при создании аэрокосмической техники и лазерных установок. Он также применяется в атомной энергетике и при изготовлении рентгенотехники.


Это естественное радиоактивное вещество очень широко распространено в земной коре, но сконцентрировано в определенных твердых скальных образованиях.
Один из самых твердых металлов в мире имеет два коммерчески значимых применения — ядерное оружие и ядерные реакторы. Таким образом, конечной продукцией урановой промышленности являются бомбы и радиоактивные отходы.











Легкий прочный металл серебристо-белого цвета
Каждая из добавок, будь то хром, никель или ванадий, отвечают за определенное качество. А вот для прочности добавляют титан – получаются самые твердые сплавы.
По одной версии, металл получил свое название от Титанов, могучих и бесстрашных детей богини Земли Геи. Но по другой версии, серебристое вещество названо в честь королевы фей Титании.Титан открыли немецкий и английский химики Грегор и Клапрот независимо друг от друга с разницей в шесть лет. Произошло это в конце 18-го века. Вещество тут же заняло место в периодической системе Менделеева. Спустя три десятилетия был получен первый образец металлического титана. И довольно долго металл не использовали из-за его хрупкости. Ровно до 1925 года – именно тогда, после ряда опытов, иодидным методом был получен чистый титан. Открытие стало настоящим прорывом. Титан оказался технологичным, на него тут же обратили внимание конструкторы и инженеры. И сейчас металл из руды получают, в основном, магниетермический способом, который предложили в 1940 году.

Титан — самый твёрдый используемый металл
Если затрагивать физические свойства титана, то можно отметить его высокую удельную прочность, прочности при высоких температурах, маленькую плотность и коррозийную стойкость. Механическая прочность титана в два раза выше прочности железа и в шесть – алюминия. При высоких температурах, где легкие сплавы уже не работают (на основе магния и алюминия), на помощь приходят титановые сплавы. К примеру, самолет на высоте в 20 километров развивает скорость в три раза выше, чем скорость звука. И температура его корпуса при этом около 300 градусов по Цельсию. Нагрузки такие выдерживает только титановый сплав.
По распространенности в природе металл занимает десятое место. Титан добывают в ЮАР, России, Китае, Украине, Японии и Индии. И это далеко не полный перечень стран.
Титан — прочный и легкий металл в мире Перечень возможностей применения металла вызывает уважение. Это военная промышленность, остепротезы в медицине, ювелирные и спортивные изделия, платы мобильных телефонов и многое другое. Постоянно возносят титан конструкторы ракето, авиа, кораблестроения. Даже химическая промышленность не оставила металл без внимания. Титан отличен для литья, ведь очертания при отливке точны и имеют гладкую поверхность. Расположение атомов в титане аморфное. И это гарантирует высокую прочность при растяжении, ударную вязкость, превосходные магнитные свойства.
Железо и сталь

Как чистое вещество железо не такое твердое по сравнению с другими участниками рейтинга. Но из-за минимальных затрат на добычу оно часто комбинируется с другими элементами для производства стали.
Сталь — это очень прочный сплав из железа и других элементов, таких как углерод. Это наиболее часто используемый материал в строительстве, машиностроении и других отраслях промышленности. И даже если вы не имеете к ним никакого отношения, то все равно используете сталь каждый раз, когда режете продукты ножом (если он, конечно, не керамический).
6. Титан

Титан — это практически синоним прочности. Он обладает впечатляющей удельной прочностью (30-35 км), что почти вдвое выше, чем аналогичная характеристика легированных сталей.
Будучи тугоплавким металлом, титан обладает высокой устойчивостью к нагреву и истиранию, поэтому является одним из самых популярным сплавов. Например, он может быть легирован железом и углеродом.
Если вам нужна очень твердая и при этом очень легкая конструкция, то лучше чем титан металла не найти. Это делает его выбором номер один для создания различных деталей в авиа- и ракетостроении и судостроении.
Титан

Открывает наш рейтинг титан – высокопрочный твердый металл, который сразу же привлек к себе внимание. Свойствами титана являются:
- высокая удельная прочность;
- стойкость к высоким температурам;
- низкая плотность;
- коррозийная стойкость;
- механическая и химическая стойкость.
Титан применяется в военной промышленности, медицине авиации, кораблестроении, и других сферах производства.
5. Рений

Это очень редкий и дорогой металл, который хотя и встречается в природе в чистом виде, обычно идет «довеском»-примесью к молибдениту.
Если бы костюм Железного человека был сделан из рения, он мог бы выдержать температуру в 2000 ° C без потери прочности. О том, что стало бы с самим Железным человеком внутри костюма после такого «фаер-шоу» мы умолчим.
Россия — третья страна в мире по природным запасам рения. Этот металл используется в нефтехимической промышленности, электронике и электротехнике, а также для создания двигателей самолетов и ракет.








Тантал
Открытому в 1802 гуду металлу, названному танталом, достается третье место в нашем списке. Его обнаружил шведский химик А. Г. Экеберг. Долгое время считалось, что тантал тождественен ниобию. Но немецкому химику Генриху Розе удалось доказать, что это два разных элемента. Выделить тантал в чистом виде смог ученый Вернер Болтон из Германии в 1922 году. Это очень редкий металл. Больше всего залежей танталовой руды было обнаружено в Западной Австралии.

Благодаря своим уникальным свойствам, тантал является очень востребованным металлом. Он применяется в различных сферах:
- в медицине из тантала изготавливают проволоку и другие элементы, которые могут скреплять ткани и даже выступать заменителем кости;
- сплавы с этим металлом устойчивы к агрессивной среде, благодаря чему они используются при изготовлении авиакосмической техники и электроники;
- тантал также применяют для создания энергии в атомных реакторах;
- элемент широко применяется в химической промышленности.

По шкале Мооса, которая измеряет устойчивость химических элементов к царапинам, хром находится в пятерке лучших, уступая лишь бору, алмазу и вольфраму.
Хром ценится за высокую коррозионную стойкость и твердость. С ним легче обращаться, чем с металлами платиновой группы, к тому же он более распространен, поэтому хром является популярным элементом, используемым в сплавах, таких, как нержавеющая сталь.
А еще один из прочнейших металлов на Земле используется при создании диетических добавок. Конечно, вы будете принимать внутрь не чистый хром, а его пищевое соединение с другими веществами (например, пиколинат хрома).
ТОП-10 самых крепких металлов в мире
Оговоренные выше 8 показателей не являются единственно верной формулой просчета крепости металлов. Существует 10+ вспомогательных параметров, которые также реально включить в комплекс, но существенных изменений в наш топ прочности они не привнесут.
Ниже мы проанализируем, какой металл самый крепкий, а также рассмотрим 10 наиболее прочных металлов в чистом виде, найденных в мире. Начнем от самого «слабенького» и доберёмся до лидера прочности в конце статьи. Параллельно обозначим особенности каждого из веществ + расскажем в каких областях те применяются порядком на 2020 год.1) Тантал

Распространенность ★★ (2.0 из 5.0) Общая привлекательность в промышленности ★★★ 3.0 Стоимость ★★★★ (4.0 из 5.0) Применение ★★★ (3.0 из 5.0) В таблице Менделеева именуется как «Та». Внешне – это серебряный + белый оттенок и плотная оксидная плёнка. Открытие металла произошло В 1802 году Экебергом, но в чистом виде вещество смогли получить только спустя 42 года, и сделал это немец Розе. В отношении промышленности, первые шаги в данном направлении были сделаны вообще в 1922 году, а его активное распространение началось в период второй мировой.
Область применения тантала:
- при создании сплавов с высоким сопротивлением к коррозии и жару;
- лабораторная посуда и устойчивая к коррозии тех аппаратура в химической промышленности;
- оборудование для теплообмена для систем ядерной энергетики;
- хирургические расходники. Проволоку из тантала используют для сшивания нервных тканей;
- как составляющий элемент криотронов;
- как декоративный элемент для украшений.
Тантал относят к металлам с низким уровнем распространения в природе. Если брать в качестве точки отсчета земную поверхность, его долевое вхождение в кору земли менее двух миллионных процента – это сказывается и стоимости чистого металла. За один грамм тантала на рынке просят от 250 долларов. Основные физические свойства металла – высокая температура плавления (3000+ градусов) и пластичность (как у золота), хотя по твёрдости у материала конкурентов очень мало.
2) Бериллий

Распространенность ★★★★ (4.0 из 5.0) Общая привлекательность в промышленности ★★★★ 4.0 Стоимость ★★★★ (4.0 из 5.0) Применение ★★★★ (4.0 из 5.0) Химический элемент впервые открыт в 1798 году французом Вокленом. Средний показатель по объемам в земной коре – от 4 грамм на одну тонну. Если речь идет о щелочных породах, то его содержание повышается до 70 грамм на тонну. Основными месторождениями бериллия являются территории вблизи вулканов, где тот замещает в магматических породах такой материал, как кремний.
- твёрдость по Моосу в 5.5 балла;
- высокая хрупкость;
- большой модуль упругости;
- при контакте с воздухом покрывается оксидной пленкой;
- рекордсмен по звукопроводимости – от 12 500 метров в секунду;
- низкая реакционная способность.
В 2021 году основными поставщиками бериллия является Америка, Китай и Казахстан. Суммарный показатель добычи всех остальных стран по бериллию менее 1%. Среднегодовой объем добычи металла составляет всего 400 000 килограмм. В России планируется запустить комбинат по добыче данного металла, в том числе, но пока завод находится на стадии разработки, и не факт, что он будет запущен вообще.
Металл хорошо себя зарекомендовал в рентгенотехнике, ядерной энергетике, акустике и даже при разработке аэрокосмической технике. Благодаря высокой проводимости тепла в связке с его прочностью, материал часто используют для изготовления лабораторных тиглей и прочих специализированных компонентов, где требуются перечисленные свойства металла.
Назначение и способы напыления металла
3) Уран

Распространенность ★★★★ (4.0 из 5.0) Общая привлекательность в промышленности ★★★★ 4.0 Стоимость ★★★★ (4.0 из 5.0) Применение ★★★★ (4.0 из 5.0) Уран относят к семейству актиноидов и является слабо реактивным элементом периодической системы Менделеева. Впервые об уране начали говорить всерьёз в 1789 году. В 1840 удалось выделить первый образец чистого вещества, а в 1896 был открыт всем печально известный радиоактивный распад, который послужил дальнейшему применению металла в оружейной сфере.
Физические свойства урана:- тяжелый;
- поверхность глянцевая с серебристо-белым оттенком;
- в чистом виде имеет меньшую прочность нежели сталь, что делает его более гибким;
- небольшие парамагнитные свойства;
- температура плавления от 1 100 градусов.
В химических свойствах мы здесь разбираться не будем, ибо для понимания происходящего придется углубляться в недра атомной энергетики. Только отметим, что основная сфера использования урана в промышленности – это производство ядерного топлива. Изотопы урана могут применяться для синтеза в промышленной медицине, а геологическая ценность – выявление возраста минералов или горных пород.

Отмеченные на карте страны сосредотачивают в себе 94% всей добычи урана для промышленных целей. Если по странам, то лидирующие позиции по объемам находятся у Казахстана, Австралии и Канады, а Россия занимает твердое 4-е место.
4) Железо/сталь

Распространенность ★★★★★ (5.0 из 5.0) Общая привлекательность в промышленности ★★★★★ 5.0 Стоимость ★★★★★ (5.0 из 5.0) Применение ★★★★★ (5.0 из 5.0) Само по себе железо не имеет высокого запаса прочности, но в комбинации с другими металлами, можно получить невероятно прочные соединения. Именно потому мы дописали в оглавлении «/сталь». Известность железа «Fe» пришла к нам еще с древних времен. Металл одним из первых начали использовать в быту древние греки, а это 4 тысячи лет до нашей эры. По содержанию в земной коре, железо является одним из самых распространенных элементов таблицы – 5% в коре, до 12% в мантии и до 90% в ядре.
- сам по себе пластичен, но сталь может корректироваться в отношении хрупкости у уровня прочности;
- ярко выраженные магнитные свойства;
- полиморфизм, обусловленный 4мя кристаллическими модификациями;
- плавиться металл начинает при 1 500+ градусах, а закипает при 2 850+.
По последним исследованиям американцев, мировые запасы железа составляют почти 180 миллиардов тонн. Крупные месторождения имеются в Бразилии, Австралии, Швеции, Индии, Польше, Украине. На территории России железо копают в Курске. О применении железа можно писать диссертацию. Его доля в рамках всей промышленности составляет 95%. Элемент важен не только в производстве, но и для организма человека – является катализатором для процесса дыхания.
Суть технологии отжига стали, виды и назначение
5) Титан

Распространенность ★★★★ (4.0 из 5.0) Общая привлекательность в промышленности ★★★★ 4.5 Стоимость ★★★★★ (5.0 из 5.0) Применение ★★★★ (4.0 из 5.0) Титан одновременно открыли 2 ученых – англичанин Грегор и немец Клапрот в 1791 году. Впервые в чистом виде металл был получен в 1825 году. Сделал это швед Берцелиус. Промышленное применение металла началось только после 1940 года, когда вышел патент на его восстановление из тетрахлорида.
По распространенности, элемент замыкает 10-ку. В земной коре содержание титана находится на уровне 0.5%. Крупные месторождения титана — это ЮАР, Россия, Украина, Канада и США, но «по мелочи», металл добывают в большинстве развитых стран.
Область применения титана:
- важный элемент сплавов в авиа –, судо- и ракетостроении;
- как материал для реакторов, трубопроводов и насосов в химии;
- броня жилетов и обшивка подлодок – титан;
- благодаря физиологической инертности металла, титан широко применяется в медицине, при разработке различных протезов и имплантатов;
- как добавка в легированных сталях.
Средняя стоимость 1 килограмма титана начинается с 6 долларов. Чем чище металл, тем дороже он обойдется. По физическим свойствам – это серебристо-белый металл с температурой плавления в 1 700 градусов. При температурах ниже 70, повышается хрупкость металла. Весьма пластичен, а его прочность сильно зависима от предварительной обработки. По Виккерсу показатель твердости достигает 800 МПа.
6) Рений

Распространенность ★★ (2.0 из 5.0) Общая привлекательность в промышленности ★★ 2.5 Стоимость ★★ (2.0 из 5.0) Применение ★★★ (3.0 из 5.0) Название металла обусловлено местом его первой добычи – река Рейн в Германии. Элемент относится к списку таковых, что были предсказаны Менделеевым. Официальное открытие рения в чистом виде датировано 1928 годом, а переход на промышленную добычу произошел после 1930 года. Установка добывала порядка 130 килограмм металла за год, и оговоренного объема вполне хватало, чтобы закрыть мировую потребность в данном металле.
- крайне высокая плотность – 21 грамм на сантиметр кубический;
- расплавить рений можно только при температурах выше 3 200 Цельсия;
- точка кипения – 5 600+ градусов, что дает возможность металлу занять твердое 2 место в рейтинге термоустойчивости;
- относится к тугоплавким металлам;
- при комнатной температуре обладает хорошей пластичностью;
- способен выдерживать многократный цикл нагрева-охлаждения без потери прочности.
По распространению, рений является одним из редчайших металлов на земле. Его массовая доля составляет 7*10 в минус 8 степени на всю массу земной коры. Главный источник извлечения металла – молибденовая руда. К слову, в России имеется одно из крупнейших месторождений данного металла с запасами в почти 20 тонн. Однако рений здесь также не чистый, а как составляющая минерала ринита. Цена одного килограмма рения от 1000 до 10 000 долларов. Металл используется в нефтеперерабатывающей промышленности, электротехнике/электронике и как элемент в сплавах в ракетостроении.
7) Хром

Распространенность ★★★★ (4.0 из 5.0) Общая привлекательность в промышленности ★★★★★ 3.0 Стоимость ★★★★ (4.0 из 5.0) Применение ★★ (2.0 из 5.0) Нет, это не браузер, а химический элемент из металлов. Шкала Мооса присуждает хрому место в пятерке лучших. Он уступает только бору, вольфраму и конечно же алмазу. Первое упоминание более-менее чистого вещества упоминается в 1797 году, когда француз Воклен смог получить карбид хрома. Одно из важнейших применений хрома в промышленности – хромирование деталей посредством электролитического покрытия.
Физические свойства хрома:
- металл с голубоватым оттенком и решеткой кубического объёмоцентрированного типа;
- при температурах ниже 37 градусов, хром становится антиферромагнетиком, а выше – становится парамагнитным веществом;
- по Моосу твердость хрома оценивается в 8.5 баллов из 10;
- хром высокой чистоты подвержен механической обработке довольно неплохо;
- не реагирует с азотными и серными кислотами;
- при сгорании на температуре 2000+ градусов, образуется зеленоватый порошок – оксид хрома.
Редким в природе хром назвать нельзя. Металл составляет порядка 3 сотых от массы земной коры. В чистом виде он не встречается. Основными соединениями в природе является хромит и крокоит. Крупнейшее месторождение хрома расположено в ЮАР. Далее идет Казахстан и Россия. Базовые месторождения хрома по территории РФ расположены в рамках Урала. Базовое применение хрома – это добавка в легированные стали. Порошок способен в 2-3 раза повысить прочность сплава и добавить материалу антикоррозийные свойства. Именно потому хромирование гальванических покрытий в РФ так популярно.
 Иридий
Иридий
Применение ★ (1.0 из 5.0) Общая привлекательность в промышленности ★★★★★ 2.0 Распространенность ★★ (2.0 из 5.0) Стоимость ★ (1.0 из 5.0) Что нужно знать рецензентам России в первую очередь – металл ставят в один ряд с драгоценными, а потому, его незаконное хранение, приобретение и сбыт в рамках РФ уголовно наказуемый проступок. Открытие металла произошло в 1803 году. Сделал это англичанин-химик Теннант. Происхождение самого названия от греческого, в переводе символизирующее радугу. Называть металл так стали из-за разноцветных солей, которые получались в осадке при реакциях с иридием.
Какими свойствами обладает иридий:
- из-за высокого показателя твердости, механической обработке почти не поддается;
- температура плавления металл составляет от 2 500+, а точка кипения достигается при температуре в 4 450+;
- одна из лучших коррозийных устойчивостей;
- сохраняет инертность на воздухе и при нагревании.
Особой значимости иридий в промышленности не имеет. Свечи зажигания, основа электродов и прочие мелочи применимы с иридием, но из-за его высокой стоимости, от 50 долларов за грамм, массовое производство оговорённых деталей низкорентабельно.
9) Осмий

Применение ★★★ (3.0 из 5.0) Общая привлекательность в промышленности ★★★★★ 3.0 Распространенность ★★★ (3.0 из 5.0) Стоимость ★★★★ (4.0 из 5.0) Металл открыт англичанином Теннантом в 1803 году. Его получили как осадок от растворения платины в царской водке. По своему внешнему виду, осмий является серо-голубым металлом высокой прочности. Высокая удельная масса + сохранении блеска даже при влиянии высоких температур в совокупности с оттенком голубого, делают химический элемент привлекательным внешне. Массовая доля осмия в природе — 5•10 в −6 степени % по массе.
Где можно найти осмий:
- растворы с иридием;
- полиметаллические руды;
- минералы платины;
- в переработках от золотосодержащих руд.
Главные точки добычи осмия сосредоточены в Сибири и Урале, если мы говорим о РФ. Немалый объем металла добывается также США, Колумбией, Канадой и некоторыми странами в Южной Африке.
Распространённость осмия в земной коре – 7 тысячных грамма на тонну, а его получение происходит через обогащение сырья от платиновых металлов через прокаливание при температурном режиме от 800 Цельсия. Тугоплавкость металла позволяет его использовать в узлах трения, а благодаря близким свойствам к драгоценным металлам, элемент используют для украшений.
Обзорное видео по самому крепкому металлу на земном шаре:
10) Вольфрам

Применение ★★★★ (4.0 из 5.0) Общая привлекательность в промышленности ★★★★★ 4.0 Распространенность ★★★ (3.0 из 5.0) Стоимость ★★★★★ (5.0 из 5.0) История вольфрама туманная. Его вывели еще в 1750 годах, но официальное признание произошло только после 1780, когда за исследование элемента всерьез взялись испанские химики-братья Элюар. В природе металл распространяется в нечистом виде (преимущественно окисленные сложные соединения), а как кларк в отношении 1.3 грамма на тонну земной массы. Крупнейшими месторождениями вольфрама являются Казахстан, Китай, США и Канада. Россия также имеет пару точек поставок. Годовой объем добычи самого крепкого металла в мире – до 50 000 тонн. Для обработки вольфрама приходится использовать метод порошковой металлургии. Проблема в прочности металла.
Химические/физические свойства вольфрама:
- плотность составляет 19.3 грамма на сантиметр кубический;
- самый термостойкий металл в мире. Плавиться начинает после достижения температуры в 2 450 градусов Цельсия. Точка кипения – 5 600 градусов (только вдумайтесь!);
- имеет парамагнитные свойства;
- твердость по Бринеллю 488 килограмм на миллиметр квадратный;
- хорошо проводит звук – от 4300 метров в секунду.
Ключевая область вольфрама – основа тугоплавких металлов в металлургии. Посмотрите на нить накаливания лампочки – она состоит из сплава с вольфрамом. Вакуумные трубки, электроды, прочие нагревательные элементы, где нужно выдерживать высокие температуры, представить без вольфрама нереально.
Таким образом, элемент не только самый крепкий метал в мире, но и один из незаменимых компонентов повседневной жизни и промышленности.
3. Иридий

Как и его «собрат» осмий, иридий относится к металлам платиновой группы, и по внешнему виду напоминает платину. Он очень твердый и тугоплавкий. Чтобы расплавить иридий, вам придется развести костер температурой выше 2000 °C.
Иридий считается одним из самых тяжелых металлов на Земле, а также одним из самых устойчивых к коррозии элементов.
Иридий

Лидером среди всех металлов, обладающих высокой прочностью, считается Иридий. Твёрдый и тугоплавкий элемент серо-белого цвета принадлежит к платиноидам. Сегодня на поверхности Земли почти не встречается, но нередко встречается в соединениях с осмием. По причине твердости воздействие на металл затруднено, а значит и обработка, стоек под влиянием химических веществ. Его значение в обыденной жизни весьма велико. Иридий используется для придания таким металлам, как титан, хром и вольфрам лучшей устойчивости к влиянию кислотной и щелочной среды. Применяется для изготовления термопар, топливных баков, термоэлектрических генераторов, в медицине, нашёл широкое применение для сплавов с платиной у ювелиров.
2. Осмий

Этот «крепкий орешек» в мире металлов относится к платиновой группе и обладает высокой плотностью. Фактически это самый плотный природный элемент на Земле (22,61 г/см3). По этой же причине осмий не плавится до 3033 ° C.
Когда он легирован другими металлами платиновой группы (такими как иридий, платина и палладий), он может использоваться во многих различных областях, где необходимы твердость и долговечность. Например, для создания емкостей для хранения ядерных отходов.
1. Вольфрам

Самый прочный металл, который только есть в природе. Этот редкий химический элемент также самый тугоплавкий из металлов (3422 ° C).
Впервые он был обнаружен в форме кислоты (триоксида вольфрама) в 1781 году шведским химиком Карлом Шееле. Дальнейшие исследования привели двух испанских ученых — Хуана Хосе и Фаусто д’Эльхуяра — к открытию кислоты из минерала вольфрамита, из которого они впоследствии изолировали вольфрам с помощью древесного угля.
Помимо широкого применения в лампах накаливания, способность вольфрама работать в условиях сильной жары делает его одним из наиболее привлекательных элементов для оружейной промышленности. Во время Второй мировой войны этот металл сыграл важную роль в инициировании экономических и политических отношений между европейскими странами.
Вольфрам также используется для изготовления твердых сплавов, а в аэрокосмической промышленности — для изготовления ракетных сопел.
Самый прочный сплав
Самые твердые сплавы в мире — вольфрамовые. Основу составляют порошки, состоящие из нескольких карбидов металлов и кобальта. Смешивание ведется в определенной пропорции. Разработанная учеными технология позволяет получать сплавы высокой степени твердости.
Маркируются такие соединения буквенным обозначением: ВК3, где В —принадлежность к вольфрамовой группе. К — содержание кобальта в процентах.
Физические и химические свойства
Основные физические свойства вольфрамовых сплавов:
- Характерной особенностью является красностойкость. Она составляет 800 градусов. Термин означает, что режущая кромка в состоянии выдерживать такую температуру. Это обеспечивается высокой теплопроводностью. Благодаря чему идет отвод тепла.
- Высокая твердость, которая составляет 90 единицы по Роквеллу.
- Температура плавления достигает 2780 градусов.
Химическая стойкость к внешней среде повышается с увеличением процентного содержания кобальта.

Химические свойства титана
Особенности изготовления и сферы применения
Технология получения твердых сплавов из вольфрама состоит из следующих этапов:
- Сначала формируется грубый порошок вольфрама, который затем измельчается и просеивается.
- Таким же образом получаются порошки карбида вольфрама и кобальта.
- Идет их перемешивание с добавлением клея. В этом качестве выступает каучук, растворенный в бензине.
- Смесь подсушивается и прессуется.
- Технологический процесс заканчивается двумя спеканиями.
Твердый материал используется в изготовлении следующих изделий:
- резцов для токарных станков;
- клейм;
- валки для прокатки;
- шариков и обоймы для подшипников.
- напайки для инструмента горнодобывающего оборудования;
Любое производство нуждается в обработке изделий. Чтобы обеспечить этот процесс, необходим материал более высокой твердости. Эту функцию выполняют твердые сплавы.
Таблица предела прочности металлов
Металл Обозначение Предел прочности, МПа Свинец Pb 18 Олово Sn 20 Кадмий Cd 62 Алюминий Al 80 Бериллий Be 140 Магний Mg 170 Медь Cu 220 Кобальт Co 240 Железо Fe 250 Ниобий Nb 340 Никель Ni 400 Титан Ti 600 Молибден Mo 700 Цирконий Zr 950 Вольфрам W 1200 Сплавы против металлов

Сплавы представляют собой комбинации металлов, и основной причиной их создания является получение более прочного материала. Наиболее важным сплавом является сталь, которая представляет собой комбинацию железа и углерода.
Чем выше прочность сплава — тем лучше. И обычная сталь тут не является «чемпионом». Особенно перспективными представляются металлургам сплавы на основе ванадиевой стали: несколько компаний выпускают варианты с пределом прочности до 5205 МПа.
А самым прочным и твердым из биосовместимых материалов на данный момент является сплав титана с золотом β-Ti3Au.
Как производят металлы?
Металлосодержащие руды считаются источником этих самых необходимых для всего современного человечества веществ. Чтобы выяснить их точное расположение, используют определенные методы поиска, которые построены на разведке и изучении месторождений. Металлы получают следующим образом:
- Производится разработка рудных месторождений открытым способом или карьерным, а также подземным или шахтным. Возможны комбинированные способы.
- Обогащение руд — выделение из сырья полезных компонентов, так называемых рудных концентратов.
- Извлечение металлов из обогащенных руд путем химического или электролитического восстановления с использованием высоких температур или водной химии.
- Чаще всего металлы выплавляют, нагревают до очень высоких температур руду и восстановитель. Для железа обычно применяют углерод.
Источник https://tutsvarka.ru/raznoe/kak-pravilno-zakalit-metall-v-domashnih-usloviyah-svoimi-rukami-nakalit-sverlo-i-drugoe-zhelezo-v-masle-rocta
Источник https://pikabu.ru/story/reyting_metallov_6006971
Источник https://master-pmg.ru/oborudovanie/samyj-tverdyj-metall.html