Легкие металлы и их свойства
Металлы, как и все химические элементы, имеют три формы существования: атомы, простые и сложные вещества. Из 118 элементов периодической системы к металлам относят 96.
Общие физические свойства металлов.
Физические свойства металлов обусловлены металлической кристаллической решёткой и металлической химической связью. Напомним, что для металлов характерны металлический блеск, пластичность, высокая электро- и теплопроводность, рост электрического сопротивления при повышении температуры, а кроме того, такие практически значимые свойства, как ковкость, твёрдость, магнитные свойства.
Металлы — твёрдые при обычных условиях вещества (кроме ртути, которая становится твёрдой и ковкой при низких температурах).
Металлы пластичны и тягучи, кроме хрупких висмута и марганца. Из меди, алюминия, олова, а также золота изготавливают тончайшие листы — фольгу. Золотая фольга может иметь толщину около 100 нм! Такую фольгу используют для золочения предметов интерьера, стен и потолков, изделий из гипса, дерева, металла, стекла и пластика.
Все металлы имеют металлический блеск, большинство из них серебристо-белого или серого цвета. Из-за того, что стронций, золото и медь поглощают в большей степени близкие к фиолетовому цвету короткие волны и отражают длинные волны светового спектра, эти металлы окрашены в светло-жёлтый и медный цвет. Очень тонкие листки серебра и золота имеют совершенно необычный вид — они представляют собой голубовато-зелёную фольгу, а мелкие порошки металлов кажутся тёмно–серыми и даже чёрными. И только порошки магния и алюминия сохраняют серебристо-белый цвет.
В технике металлы принято классифицировать по различным физическим свойствам:
- а) плотности — лёгкие (р < 5,0 г/см 3 ) и тяжёлые (р > 5,0 г/см 3 );
- б) температуре плавления — легкоплавкие (tпл < 1000 °С) и тугоплавкие (tпл > 1000 °С).
Металлы принято делить на чёрные (железо и его сплавы) и цветные (остальные металлы и сплавы). Соответственно называются и отрасли металлургической промышленности: чёрная и цветная металлургия.
Важнейшими продуктами цветной металлургии являются титан, вольфрам, молибден и другие металлы, которые могут использоваться в качестве специальных легирующих добавок для производства сверхтвёрдых, тугоплавких, устойчивых к коррозии сплавов, широко применяемых в машино– и станкостроении, в оборонно–космической отрасли.
Современные композиционные материалы, выполненные на основе керамики или полимеров, становятся сверхпрочными, если укреплены металлическими нитями из молибдена, вольфрама, титана, специальных сталей и т. д.
Химические свойства металлов.
Во всех реакциях простые вещества — металлы проявляют только восстановительные свойства.
- Металлы взаимодействуют с неметаллами, образуя бинарные соединения. По правилам ИЮПАК названия этих соединений образуются в соответствии со схемой:

Так, с очень активными неметаллами (галогенами, серой) металлы образуют соединения, которые молено рассматривать, как соли бескислородных кислот: 2Na + Сl2 = 2NaCl
Если металл проявляет переменные степени окисления, подобная соль имеет состав, который зависит от окислительных свойств неметалла. Например, железо энергично взаимодействует с хлором, образуя хлорид железа(III): 2Fe + 3Сl2 = 2FeCl3
При взаимодействии железа с серой, окислительная способность которой ниже, чем у галогенов, продуктом реакции является сульфид железа(II): Fe + S = FeS
- При взаимодействии металлов с кислородом образуются оксиды или пероксиды:
Оксиды в этом случае имеют основный или амфотерный характер:
2Mg + O2 = 2MgO
4Аl + 3O2 = 2Аl2O3
Эти реакции сопровождаются выделением большого количества теплоты и очень ярким пламенем, поэтому применяются для изготовления сигнальных ракет, фейерверков, салютов и других пиротехнических средств. Поэтому обращение с ними требует строгого соблюдения правил техники безопасности.
Продуктом горения железа в кислороде является смешанный оксид 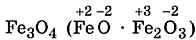 :
:
3Fe + 2O2 = Fe3O4
- Металлы — простые вещества, образованные элементами IA– и IIА–групп, в полном соответствии с названием этих групп взаимодействуют с водой с образованием щёлочи и водорода. В общем виде эти реакции можно записать так:
2М + 2Н2O = 2МОН + Н2↑, где М — щелочной металл
М + 2Н2O = М(ОН)2 + H2↑, где М — Mg или щёлочноземельный металл.
Для характеристики химических свойств металлов важное значение имеет их положение в электрохимическом ряду напряжений:
К, Са, Na, Mg, Al, Zn, Fe, Sn, Pb, (H2) , Cu, Hg, Ag, Au
Вспомните известные вам из курса основной школы два вывода:
- взаимодействие металлов с растворами кислот происходит, если металл находится в ряду напряжений левее водорода;
- взаимодействие металлов с растворами солей происходит, если металл находится в ряду напряжений левее металла соли.
Лабораторный способом получения водорода:
Zn + 2НСl = ZnCl2 + H2↑
Zn 0 + 2H + = Zn 2+ + H2 0
Аналогично протекает реакция металлов и с органическими кислотами:
2СН3СООН + Zn —> (CH3COO)2Zn + Н2↑
2СН3СООН + Zn –> 2СН3СОO – + Zn 2+ + Н2 0
Реакция между цинком и раствором сульфата меди(II) протекает согласно уравнению:
Zn + CuSO4 = ZnSO4 + Сu
Zn 0 + Сu 2+ = Zn 2+ + Сu 0
Подчеркнём, что в этом случае металл может находиться в ряду напряжений и после водорода, но не после металла соли. Например, реакция замещения серебра медью:
Cu + 2AgNO3 = Сu(NО3)2 + 2Ag
Cu 0 + 2Ag + = Cu 2+ + 2Ag 0
В завершение рассмотрим ещё одно характерное не для всех металлов свойство, которое называется металлотермия. Такие активные металлы, как алюминий, кальций, магний, литий, способны взаимодействовать с оксидами других металлов. Для того чтобы началась такая реакция, смесь активного металла и оксида металла (её называют термитной) необходимо поджечь. После этого процесс сопровождается выделением большого количества теплоты и света (отсюда и название процесса). Металлотермию применяют для получения и более ценных металлов: 2Аl + Сr2О3 = Al2O3 + 2Сг
Химия металлов (таблица)

Конспект урока по химии в 11 классе «Металлы». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
Классификация металлов: металлы, их сплавы, характеристики и другое
Металлы – соединения, в которых атомы закономерно расположены в узлах кристаллической решетки. Они имеют ряд особенных свойств:
- металлический блеск;
- твердость (исключение – ртуть);
- проводимость электрического тока и тепла;
- пластичность.
В химических реакциях металлы играют роль восстановителей, т. е. стремятся отдать свои электроны другим атомам. Металлы не встречаются в чистом виде. Человек, как правило, применяет сплавы – смесь из двух и более металлических компонентов.
Как классифицируются металлы
Классификация по химическим свойствам
- Щелочные (Li, Na, K, Rb, Cs, Fr)
- Щелочноземельные(Be, Mg, Ca, Sr, Ba, Ra)
- Переходные (Сu, Zn, Cr, Mn и др.)
Переходные металлы – элементы побочных групп, атомы которых содержат электроны на d- и f-орбиталях. В соединениях они проявляют положительную степень окисления. В соединениях атомы используют валентные s- и p, так и d-электроны. Исходя из этого, d-элементы обладают переменной валентностью. По этой причине они могут образовывать комплексные соединения.
Для переходных металлов характерна небольшая электроотрицательность и переменная степень окисления. Они представляют собой твердые вещества с высокими температурами плавления и кипения.

Классификация по физическим свойствам
- Тугоплавкие (Мо, W)
- Цветные(Cu, Zn, Ni, Sn и др.)
- Черные
- Благородные (Au, Ag и металлы платиновой группы)
Благородные металлы — металлы, которые не подвергаются коррозии и окислению. Они не реагируют с соляной кислотой. Благородные металлы часто называют драгоценными.
Различные классификации позволяют эффективно использовать металлы и применять их во многих отраслях.
Тема №7 «Свойства простых веществ — металлов»
Свойства металлов, разобраны основные представители металлов, и их химические и физические свойства, некоторые их соединения и их химические свойства.
Свойства простых веществ − металлов
Оглавление
Характерные химические свойства простых веществ – металлов
Большинство химических элементов относят к металлам — 92 из 114 известных элементов. Металлы — это химические элементы, атомы которых отдают электроны внешнего (а некоторые — и предвнешнего) электронного слоя, превращаясь в положительные ионы. Это свойство атомов металлов определяется тем, что они имеют сравнительно большие радиусы и малое число электронов (в основном от 1 до 3 на внешнем слое). Исключение составляют лишь 6 металлов: атомы германия, олова, свинца на внешнем слое имеют 4 электрона, атомы сурьмы и висмута — 5, атомы полония — 6. Для атомов металлов характерны небольшие значения электроотрицательности (от 0,7 до 1,9) и исключительно восстановительные свойства, т. е. способность отдавать электроны. В Периодической системе химических элементов Д. И. Менделеева металлы находятся ниже диагонали бор — астат, а также выше ее, в побочных подгруппах. В периодах и главных подгруппах действуют известные вам закономерности в изменении металлических, а значит, восстановительных свойств атомов элементов.
Химические элементы, расположенные вблизи диагонали бор — астат (Be, Al, Ti, Ge, Nb, Sb и др.), обладают двойственными свойствами: в одних своих соединениях ведут себя как металлы, в других — проявляют свойства неметаллов. В побочных подгруппах восстановительные свойства металлов с увеличением порядкового номера чаще всего уменьшаются.
Сравните активность известных вам металлов I группы побочной подгруппы: Cu, Ag, Au; II группы побочной подгруппы: Zn, Cd, Hg — и вы убедитесь в этом сами. Это можно объяснить тем, что на прочность связи валентных электронов с ядром у атомов данных металлов в большей степени влияет величина заряда ядра, а не радиус атома. Величина заряда ядра значительно увеличивается, притяжение электронов к ядру усиливается. Радиус атома при этом хотя и увеличивается, но не столь значительно, как у металлов главных подгрупп.
Простые вещества, образованные химическими элементами — металлами, и сложные металлосодержащие вещества играют важнейшую роль в минеральной и органической «жизни» Земли. Достаточно вспомнить, что атомы (ионы) элементов металлов являются составной частью соединений, определяющих обмен веществ в организме человека, животных. Например, в крови человека найдено 76 элементов, и из них только 14 не являются металлами.
В организме человека некоторые элементы металлы (кальций, калий, натрий, магний) присутствуют в большом количестве, т. е. являются макроэлементами. А такие металлы, как хром, марганец, железо, кобальт, медь, цинк, молибден присутствуют в небольших количествах, т. е. это микроэлементы. Если человек весит 70 кг, то в его организме содержится (в граммах): кальция — 1700, калия — 250, натрия — 70, магния — 42, железа — 5, цинка — 3. Все металлы чрезвычайно важны, проблемы со здоровьем возникают и при их недостатке, и при избытке.
Например, ионы натрия регулируют содержание воды в организме, передачу нервных импульсов. Его недостаток приводит к головной боли, слабости, слабой памяти, потере аппетита, а избыток — к повышению артериального давления, гипертонии, заболеваниям сердца.
Простые вещества — металлы
С развитием производства металлов (простых веществ) и сплавов связано возникновение цивилизации (бронзовый век, железный век). Начавшаяся примерно 100 лет назад научно-техническая революция, затронувшая и промышленность, и социальную сферу, также тесно связана с производством металлов. На основе вольфрама, молибдена, титана и других металлов начали создавать коррозионностойкие, сверхтвердые, тугоплавкие сплавы, применение которых сильно расширило возможности машиностроения. В ядерной и космической технике из сплавов вольфрама и рения делают детали, работающие при температурах до 3000 °С; в медицине используют хирургические инструменты из сплавов тантала и платины, уникальной керамики на основе оксидов титана и циркония.
И, конечно же, мы не должны забывать, что в большинстве сплавов используют давно известный металл железо, а основу многих легких сплавов составляют сравнительно «молодые» металлы — алюминий и магний. Сверхновыми стали композиционные материалы, представляющие, например, полимер или керамику, которые внутри (как бетон железными прутьями) упрочнены металлическими волокнами из вольфрама, молибдена, стали и других металлов, и сплавов — все зависит от поставленной цели, необходимых для ее достижения свойств материала. На рисунке изображена схема кристаллической решетки металлического натрия. В ней каждый атом натрия окружен восемью соседями. У атома натрия, как и у всех металлов, имеется много свободных валентных орбиталей и мало валентных электронов. Электронная формула атома натрия: 1s 2 2s 2 2p 6 3s 1 3p 0 3d 0 , где 3s, 3p, 3d — валентные орбитали.

Единственный валентный электрон атома натрия 3s 1 может занимать любую из девяти свободных орбиталей — 3s (одна), 3р (три) и 3d (пять), ведь они не очень отличаются по уровню энергии. При сближении атомов, когда образуется кристаллическая решетка, валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются с одной орбитали на другую, осуществляя связь между всеми атомами кристалла металла. Такую химическую связь называют металлической.
Металлическую связь образуют элементы, атомы которых на внешнем слое имеют мало валентных электронов по сравнению с большим числом внешних энергетически близких орбиталей. Их валентные электроны слабо удерживаются в атоме. Электроны, осуществляющие связь, обобществлены и перемещаются по всей кристаллической решетке в целом нейтрального металла. Веществам с металлической связью присущи металлические кристаллические решетки, которые обычно изображают схематически так, как показано на рисунке. Катионы и атомы металлов, расположенные в узлах кристаллической решетки, обеспечивают ее стабильность и прочность (обобществленные электроны изображены в виде черных маленьких шариков).

Металлическая связь — это связь в металлах и сплавах между атом-ионами металлов, расположенными в узлах кристаллической решетки, осуществляемая обобществленными валентными электронами. Некоторые металлы кристаллизуются в двух или более кристаллических формах. Это свойство веществ — существовать в нескольких кристаллических модификациях — называют полиморфизмом. Полиморфизм простых веществ известен под названием аллотропии. Например, железо имеет четыре кристаллические модификации, каждая из которых устойчива в определенном температурном интервале:
• α — устойчива до 768 °С, ферромагнитная;
• β — устойчива от 768 до 910 °С, неферромагнитная, т. е. парамагнитная;
• γ — устойчива от 910 до 1390 °С, неферромагнитная, т. е. парамагнитная;
• δ — устойчива от 1390 до 1539 °С (£°пл железа), неферромагнитная.
Олово имеет две кристаллические модификации:
• α — устойчива ниже 13,2 °С (р = 5,75 г/см 3 ). Это серое олово. Оно имеет кристаллическую решетку типа алмаза (атомную);
• β — устойчива выше 13,2 °С (р = 6,55 г/см 3 ). Это белое олово.
Белое олово — серебристо-белый очень мягкий металл. При охлаждении ниже 13,2 °С он рассыпается в серый порошок, т. к. при переходе значительно увеличивается его удельный объем. Это явление получило название «оловянной чумы».
Конечно, особый вид химической связи и тип кристаллической решетки металлов должны определять и объяснять их физические свойства. Каковы же они? Это металлический блеск, пластичность, высокая электрическая проводимость и теплопроводность, рост электрического сопротивления при повышении температуры, а также такие значимые свойства, как плотность, высокие температуры плавления и кипения, твердость, магнитные свойства. Механическое воздействие на кристалл с металлической кристаллической решеткой вызывает смещение слоев ион-атомов друг относительно друга (рис. 17), а так как электроны перемещаются по всему кристаллу, разрыв связей не происходит, поэтому для металлов характерна большая пластичность. Аналогичное воздействие на твердое вещество с ковалентными свя зями (атомной кристаллической решеткой) приводит к разрыву ковалентных связей. Разрыв связей в ионной решетке приводит к взаимному отталкиванию одноименно заряженных ионов. Поэтому вещества с атомными и ионными кристаллическими решетками хрупкие. Наиболее пластичные металлы — это Au, Ag, Sn, Pb, Zn. Они легко вытягиваются в проволоку, поддаются ковке, прессованию, прокатыванию в листы. Например, из золота можно изготовить золотую фольгу толщиной 0,003 мм, а из 0,5 г этого металла можно вытянуть нить длиной 1 км. Даже ртуть, которая при комнатной температуре жидкая, при низких температурах в твердом состоянии становится ковкой, как свинец. Не обладают пластичностью лишь Bi и Mn, они хрупкие.
Почему металлы имеют характерный блеск, а также непрозрачны?
Электроны, заполняющие межатомное пространство, отражают световые лучи (а не пропускают, как стекло), причем большинство металлов в равной степени рассеивают все лучи видимой части спектра. Поэтому они имеют серебристо-белый или серый цвет. Стронций, золото и медь в большей степени поглощают короткие волны (близкие к фиолетовому цвету) и отражают длинные волны светового спектра, поэтому имеют светло-желтый, желтый и «медный» цвета. Хотя на практике металл не всегда нам кажется «светлым телом». Во-первых, его поверхность может окисляться и терять блеск. Поэтому самородная медь выглядит зеленоватым камнем. А во- вторых, и чистый металл может не блестеть. Очень тонкие листки серебра и золота имеют совершенно неожиданный вид — они имеют голубовато-зеленый цвет. А мелкие порошки металлов кажутся темно-серыми, даже черными. Наибольшую отражательную способность имеют серебро, алюминий, палладий. Их используют при изготовлении зеркал, в том числе и в прожекторах.
Почему металлы имеют высокую электрическую проводимость и теплопроводны?
Хаотически движущиеся электроны в металле под воздействием приложенного электрического напряжения приобретают направленное движение, т. е. проводят электрический ток. При повышении температуры металла возрастают амплитуды колебаний находящихся в узлах кристаллической решетки атомов и ионов. Это затрудняет перемещение электронов, электрическая проводимость металла падает. При низких температурах колебательное движение, наоборот, сильно уменьшается и электрическая проводимость металлов резко возрастает. Вблизи абсолютного нуля сопротивление у металлов практически отсутствует, у большинства металлов появляется сверхпроводимость.
Следует отметить, что неметаллы, обладающие электрической проводимостью (например, графит), при низких температурах, наоборот, не проводят электрический ток из-за отсутствия свободных электронов. И только с повышением температуры и разрушением некоторых ковалентных связей их электрическая проводимость начинает возрастать. Наибольшую электрическую проводимость имеют серебро, медь, а также золото, алюминий, наименьшую — марганец, свинец, ртуть.
Чаще всего с той же закономерностью, как и электрическая проводимость, изменяется теплопроводность металлов. Она обусловлена большой подвижностью свободных электронов, которые, сталкиваясь с колеблющимися ионами и атомами, обмениваются с ними энергией. Происходит выравнивание температуры по всему куску металла.
Механическая прочность, плотность, температура плавления у металлов очень сильно отличаются. Причем с увеличением числа электронов, связывающих ион-атомы, и уменьшением межатомного расстояния в кристаллах показатели этих свойств возрастают.
Так, щелочные металлы (Li, K, Na, Rb, Cs), атомы которых имеют один валентный электрон, мягкие (режутся ножом), с небольшой плотностью (литий — самый легкий металл с р = 0,53 г/см 3 ) и плавятся при невысоких температурах (например, температура плавления цезия 29 °С). Единственный металл, жидкий при обычных условиях, — ртуть — имеет температуру плавления, равную -38,9 °С. Кальций, имеющий два электрона на внешнем энергетическом уровне атомов, гораздо более тверд и плавится при более высокой температуре (842 °С). Еще более прочной является кристаллическая решетка, образованная ионами скандия, который имеет три валентных электрона. Но самые прочные кристаллические решетки, большие плотности и температуры плавления наблюдаются у металлов побочных подгрупп V, VI, VII, VIII групп. Это объясняется тем, что для металлов побочных подгрупп, имеющих неспаренные валентные электроны на d-подуровне, характерно образование очень прочных ковалентных связей между атомами, помимо металлической, осуществляемой электронами внешнего слоя с s-орбиталей.
Самый тяжелый металл — это осмий (Os) с р = 22,5 г/см 3 (компонент сверхтвердых и износостойких сплавов), самый тугоплавкий металл — это вольфрам W с t = 3420 °С (применяется для изготовления нитей накаливания ламп), самый твердый металл — это хром Cr (царапает стекло). Они входят в состав материалов, из которых изготавливают металлорежущий инструмент, тормозные колодки тяжелых машин и др. Металлы поразному взаимодействуют с магнитным полем. Такие металлы, как железо, кобальт, никель и гадолиний выделяются своей способностью сильно намагничиваться. Их называют ферромагнетиками. Большинство металлов (щелочные и щелочноземельные металлы и значительная часть переходных металлов) слабо намагничиваются и не сохраняют это состояние вне магнитного поля — это парамагнетики. Металлы, выталкиваемые магнитным полем, — диамагнетики (медь, серебро, золото, висмут).
При рассмотрении электронного строения металлов мы разделили металлы на металлы главных подгрупп (s- и p-элементы) и металлы побочных подгрупп (переходные d- и f-элементы).
В технике принято классифицировать металлы по различным физическим свойствам:
1. Плотность — легкие (р < 5 г/см 3 ) и тяжелые (все остальные).
2. Температуре плавления — легкоплавкие и тугоплавкие.
Железо и его сплавы принято считать черными металлами, а все остальные — цветными.
Существуют классификации металлов по химическим свойствам. Металлы с низкой химической активностью называют благородными (серебро, золото, платина и ее аналоги — осмий, иридий, рутений, палладий, родий). По близости химических свойств выделяют щелочные (металлы главной подгруппы I группы), щелочноземельные (кальций, стронций, барий, радий), а также редкоземельные металлы (скандий, иттрий, лантан и лантаноиды, актиний и актиноиды).
ЭЛЕКТРОПРОВОДНОСТЬ МЕТАЛЛОВ ТЕМПЕРАТУРА ПЛАВЛЕНИЯ МЕТАЛЛОВ ПЛОТНОСТЬ МЕТАЛЛОВ
Общие химические свойства металлов
Атомы металлов сравнительно легко отдают валентные электроны и переходят в положительно заряженные ионы, то есть окисляются. В этом заключается главное общее свойство и атомов, и простых веществ — металлов. Металлы в химических реакциях всегда восстановители. Восстановительная способность атомов простых веществ — металлов, образованных химическими элементами одного периода или одной главной подгруппы Периодической системы Д. И. Менделеева, изменяется закономерно.
Электрохимический ряд напряжений металлов
Восстановительную активность металла в химических реакциях, которые протекают в водных растворах, отражает его положение в электрохимическом ряду напряжений металлов.

На основании этого ряда напряжений можно сделать следующие важные заключения о химической активности металлов в реакциях, протекающих в водных растворах при стандартных условиях (t = 25 °С, р = 1 атм).
· Чем левее стоит металл в этом ряду, тем более сильным восстановителем он является.
· Каждый металл способен вытеснять (восстанавливать) из солей в растворе те металлы, которые в ряду напряжений стоят после него (правее).
· Металлы, находящиеся в ряду напряжений левее водорода, способны вытеснять его из кислот в растворе
· Металлы, являющиеся самыми сильными восстановителями (щелочные и щелочноземельные), в любых водных растворах взаимодействуют прежде всего с водой.
Восстановительная активность металла, определенная по электрохимическому ряду, не всегда соответствует положению его в периодической системе. Это объясняется тем, что при определении положения металла в ряду напряжений учитывают не только энергию отрыва электронов от отдельных атомов, но и энергию, затрачиваемую на разрушение кристаллической решетки, а также энергию, выделяющуюся при гидратации ионов. Например, литий более активен в водных растворах, чем натрий (хотя по положению в периодической системе Na — более активный металл). Дело в том, что энергия гидратации ионов Li + значительно больше, чем энергия гидратации Na + , поэтому первый процесс является энергетически более выгодным. Рассмотрев общие положения, характеризующие восстановительные свойства металлов, перейдем к конкретным химическим реакциям.
Взаимодействие металлов с неметаллами
· С кислородом большинство металлов образуют оксиды — основные и амфотерные. Кислотные оксиды переходных металлов, например оксид хрома (VI) CrOg или оксид марганца (VII) Mn2O7, не образуются при прямом окислении металла кислородом. Их получают косвенным путем.
Щелочные металлы Na, K активно реагируют с кислородом воздуха, образуя пероксиды:

Оксид натрия получают косвенным путем, при прокаливании пероксидов с соответствующими металлами:

Литий и щелочноземельные металлы взаимодействуют с кислородом воздуха, образуя основные оксиды:

Другие металлы, кроме золота и платиновых металлов, которые вообще не окисляются кислородом воздуха, взаимодействуют с ним менее активно или при нагревании:

· С галогенами металлы образуют соли галогеноводородных кислот, например:

· С водородом самые активные металлы образуют гидриды — ионные солеподобные вещества, в которых водород имеет степень окисления —1, например:

Многие переходные металлы образуют с водородом гидриды особого типа — происходит как бы растворение или внедрение водорода в кристаллическую решетку металлов между атомами и ионами, при этом металл сохраняет свой внешний вид, но увеличивается в объеме. Поглощенный водород находится в металле, повидимому, в атомарном виде.
Существуют и гидриды металлов промежуточного характера.
· С серые металлы образуют соли — сульфиды, например:

· С азотом металлы реагируют несколько труднее, т. к. химичес кая связь в молекуле азота N2 очень прочна; при этом образуются нитриды. При обычной температуре взаимодействует с азотом только литий:

Взаимодействие металлов со сложными веществами
· С водой. Щелочные и щелочноземельные металлы при обычных условиях вытесняют водород из воды и образуют растворимые основания — щелочи, например:

Другие металлы, стоящие в ряду напряжений до водорода, тоже могут при определенных условиях вытеснять водород из воды. Но алюминий бурно взаимодействует с водой, только если удалить с его поверхности оксидную пленку:

Магний взаимодействует с водой только при кипячении, при этом также выделяется водород:

Если горящий магний внести в воду, то горение продолжается, т. к. протекает реакция:

Железо взаимодействует с водой только в раскаленном виде:

· С кислотами в растворе (HCl, H2SO4), CH3COOH и др., кроме HNO3) взаимодействуют металлы, стоящие в ряду напряжений до водорода. При этом образуются соль и водород.

А вот свинец (и некоторые другие металлы), несмотря на его положение в ряду напряжений (слева от водорода), почти не растворяется в разбавленной серной кислоте, т. к. образующийся сульфат свинца PbSO4 нерастворим и создает на поверхности металла защитную пленку.
· С солями менее активных металлов в растворе. В результате такой реакции образуется соль более активного металла и выделяется менее активный металл в свободном виде.

Нужно помнить, что реакция идет в тех случаях, когда образующаяся соль растворима. Вытеснение металлов из их соединений другими металлами впервые подробно изучал Н. Н. Бекетов — великий русский ученый в области физической химии. Он расположил металлы по химической активности в «вытеснительный ряд», ставший прототипом ряда напряжений металлов.
· С органическими веществами. Взаимодействие с органическими кислотами аналогично реакциям с минеральными кислотами. Спирты же могут проявлять слабые кислотные свойства при взаимодействии со щелочными металлами:

Аналогично реагирует и фенол:

Металлы участвуют в реакциях с галогеналканами, которые используют для получения низших циклоалканов и для синтезов, в ходе которых происходит усложнение углеродного скелета молекулы (реакция А. Вюрца):


· Со щелочами в растворе взаимодействуют металлы, гидроксиды которых амфотерны. Например:

· Металлы могут образовывать друг с другом химические соединения, которые получили общее название интерметаллических соединений. В них чаще всего не проявляются степени окисления атомов, которые характерны для соединений металлов с неметаллами. Например:
Интерметаллические соединения обычно не имеют постоянного состава, химическая связь в них в основном металлическая. Образование этих соединений более характерно для металлов побочных подгрупп.
Металлы главных подгрупп I-III групп Периодической системы химических элементов Д. И. Менделеева
Общая характеристика
Щелочные металлы — это металлы главной подгруппы I группы. Их атомы на внешнем энергетическом уровне имеют по одному электрону. Щелочные металлы — сильные восстановители. Их восстановительная способность и химическая активность возрастают с увеличением порядкового номера элемента (т. е. сверху вниз в Периодической таблице). Все они обладают электронной проводимостью. Прочность связи между атомами щелочных металлов уменьшается с увеличением порядкового номера элемента. Также снижаются их температуры плавления и кипения. Щелочные металлы взаимодействуют со многими простыми веществами — окислителями. В реакциях с водой они образуют растворимые в воде основания (щелочи). Щелочноземельными элементами называются элементы главной подгруппы II группы. Атомы этих элементов содержат на внешнем энергетическом уровне по два электрона. Они являются сильнейшими восстановителями, имеют степень окисления +2. В этой главной подгруппе соблюдаются общие закономерности в изменении физических и химических свойств, связанные с увеличением размера атомов по группе сверху вниз, также ослабевает и химическая связь между атомами. С увеличением размера иона ослабевают кислотные и усиливаются основные свойства оксидов и гидроксидов.
Главную подгруппу III группы составляют элементы бор, алюминий, галлий, индий и таллий. Все элементы относятся к p-элементам. На внешнем энергетическом уровне они имеют по три (s 2 p 1 ) электрона, чем объясняется сходство свойств. Степень окисления +3. Внутри группы с увеличением заряда ядра металлические свойства увеличиваются. Бор — элемент-неметалл, а у алюминия уже металлические свойства. Все элементы образуют оксиды и гидроксиды.
Большинство металлов находится в подгруппах Периодической системы. В отличие от элементов главных подгрупп, где происходит постепенное заполнение электронами внешнего уровня атомных орбиталей, у элементов побочных подгрупп заполняются d-орбитали предпоследнего энергетического уровня и s-орбитали последнего. Число электронов соответствует номеру группы. Элементы с равным числом валентных электронов входят в группу под одним номером. Все элементы подгрупп — металлы.
Простые вещества, образованные металлами подгрупп, имеют прочные кристаллические решетки, устойчивые к нагреванию. Эти металлы самые прочные и тугоплавкие среди других металлов. У d-элементов ярко проявляется переход с увеличением их валентности от основных свойств через амфотерные к кислотным.
Щелочные металлы (Na, K)

На внешнем энергетическом уровне атомы щелочных металлов элементов содержат по одному электрону, находящемуся на большом удалении от ядра. Они легко отдают этот электрон, поэтому являются сильными восстановителями. Во всех соединениях щелочные металлы проявляют степень окисления +1. Их восстановительные свойства с ростом радиуса атомов усиливаются от Li к Cs. Все они типичные металлы, имеют серебристо-белый цвет, мягкие (режутся ножом), легкие и легкоплавкие. Активно взаимодействуют со всеми неметаллами:

Все щелочные металлы при взаимодействии с кислородом (исключение Li) образуют пероксиды. В свободном виде щелочные металлы не встречаются из-за их высокой химической активности.
Оксиды — твердые вещества, имеют основные свойства. Их получают, прокаливая пероксиды с соответствующими металлами:

Гидроксиды NaOH, KOH — твердые белые вещества, гигроскопичны, хорошо растворяются в воде с выделением теплоты, их относят к щелочам:

Соли щелочных металлов почти все растворимы в воде. Важнейшие из них: Na2CO3 — карбонат натрия; Na2CO3 • 10H2O — кристаллическая сода; NaHCO3 — гидрокарбонат натрия, пищевая сода; K2CO3 — карбонат калия, поташ; Na2SO4 • 10H2O — глауберова соль; NaCl — хлорид натрия, пищевая соль.



Щелочноземельные металлы (Ca, Mg)

Кальций (Ca) является представителем щелочноземельных металлов, которыми называются элементы главной подгруппы II группы, но не все, а только начиная с кальция и вниз по группе. Это те химические элементы, которые, взаимодействуя с водой, образуют щелочи. Кальций на внешнем энергетическом уровне содержит два электрона, степень окисления +2.
Физические и химические свойства кальция и его соединений представлены в таблице.

Магний (Mg) имеет такое же строение атома, как и кальций, степень его окисления также +2. Мягкий металл, но его поверхность на воздухе покрывается защитной пленкой, что немного снижает химическую активность. Его горение сопровождается ослепительной вспышкой. MgO и Mg(OH)2 проявляют основные свойства. Хотя Mg(OH)2 и малорастворим, но окрашивает раствор фенолфталеина в малиновый цвет.
Оксиды MO — твердые белые тугоплавкие вещества. В технике CaO называют негашеной известью, а MgO — жженой магнезией, эти оксиды используют в производстве строительных материалов. Реакция оксида кальция с водой сопровождается выделением теплоты и называется гашением извести, а образующийся Ca(OH)2 — гашеной известью. Прозрачный раствор гидроксида кальция называется известковой водой, а белая взвесь Ca(OH)2 в воде — известковым молоком.
Соли магния и кальция получают взаимодействием их с кислотами.
CaCO3 — карбонат кальция, мел, мрамор, известняк. Применяется в строительстве. MgCO3 — карбонат магния — применяется в металлургии для освобождения от шлаков.
CaSO4 • 2H2O — гипс. MgSO4 — сульфат магния — называют горькой, или английской, солью, содержится в морской воде. BaSO4 — сульфат бария — благодаря нерастворимости и способности задерживать рентгеновские лучи применяется в диагностике («баритовая каша») желудочно-кишечного тракта.
На долю кальция приходится 1,5 % массы тела человека, 98 % кальция содержится в костях. Магний является биоэлементом, его в теле человека около 40 г, он участвует в образовании белковых молекул.





Элементы III группы главной подгруппы
Алюминий

Алюминий (Al) — элемент главной подгруппы III группы периодической системы Д. И. Менделеева. Атом алюминия содержит на внешнем энергетическом уровне три электрона, которые он легко отдает при химических взаимодействиях. У родоначальника подгруппы и верхнего соседа алюминия — бора — радиус атома меньше (у бора он равен 0,080 нм, у алюминия — 0,143 нм). Кроме того, у атома алюминия появляется один промежуточный восьмиэлектронный слой (2е; 8е; 3е), который препятствует протяжению внешних электронов к ядру. Поэтому у атомов алюминия восстановительные свойства выражены достаточно сильно.
Почти во всех своих соединениях алюминий имеет степень окисления +3.
Алюминий простое вещество
Серебристо-белый легкий металл. Плавится при 660 °С. Очень пластичен, легко вытягивается в проволоку и прокатывается в фольгу толщиной до 0,01 мм. Обладает очень большой электрической проводимостью и теплопроводностью. Образуют с другими металлами легкие и прочные сплавы. Алюминий — очень активный металл. Если порошок алюминия или тонкую алюминиевую фольгу сильно нагреть, то они воспламеняются и сгорают ослепительным пламенем:

Эту реакцию можно наблюдать при горении бенгальских огней и фейерверков. Алюминий, как и все металлы, легко реагирует с неметаллами, особенно в порошкообразном состоянии. Для того чтобы началась реакция, необходимо первоначальное нагревание, за исключением реакций с галогенами — хлором и бромом, зато потом все реакции алюминия с неметаллами идут очень бурно и сопровождаются выделением большого количества теплоты:

Алюминий хорошо растворяется в разбавленных серной и соляной кислотах:

А вот концентрированные серная и азотная кислоты пассивируют алюминий, образуя на поверхности металла плотную прочную оксидную пленку, которая препятствует дальнейшему протеканию реакции. Поэтому эти кислоты перевозят в алюминиевых цистернах.
Оксид и гидроксид алюминия обладают амфотерными свойствами, поэтому алюминий растворяется в водных растворах щелочей, образуя соли — алюминаты:
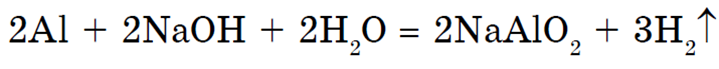
Алюминий широко используется в металлургии для получения металлов — хрома, марганца, ванадия, титана, циркония из их оксидов. Этот способ носит название алюмотермия. На практике часто применяют термит — смесь Fe3O4 с порошком алюминия. Если эту смесь поджечь, например, с помощью магниевой ленты, то происходит энергичная реакция с выделением большого количества теплоты:

Выделяющейся теплоты вполне достаточно для полного расплавления образующегося железа, поэтому этот процесс используют для сварки стальных изделий.
Алюминий можно получить электролизом — разложением расплава его оксида Al2O3 на составные части с помощью электрического тока. Но температура плавления оксида алюминия около 2050 °С, поэтому для проведения электролиза необходимы большие затраты энергии.
Соединения алюминия
Алюмосиликаты. Эти соединения можно рассматривать как соли, образованные оксидом алюминия, кремния, щелочных и щелочноземельных металлов. Они и составляют основную массу земной коры. В частности, алюмосиликаты входят в состав полевых шпатов — наиболее распространенных минералов и глин.
Боксит — горная порода, из которой получают алюминий. Она содержит оксид алюминия Al2O3.
Корунд — минерал состава Al2O3, обладает очень высокой твердостью, его мелкозернистая разновидность, содержащая примеси, — наждак, применяется как абразивный (шлифовочный) материал. Эту же формулу имеет и другое природное соединение — глинозем.
Хорошо известны прозрачные, окрашенные примесями, кристаллы корунда: красные — рубины и синие — сапфиры, которые используют как драгоценные камни. В настоящее время их получают искусственно и применяют не только для украшений, но и для технических целей, например, для изготовления деталей часов и других точных приборов. Кристаллы рубинов применяются в лазерах.
Оксид алюминия Al2O3 — белое вещество с очень высокой температурой плавления. Может быть получен разложением при нагревании гидроксида алюминия:

Гидроксид алюминия Al(OH)3 выпадает в виде студенистого осадка при действии щелочей на растворы солей алюминия:

Как амфотерный гидроксид он легко растворяется в кислотах и растворах щелочей:


Алюминатами называют соли неустойчивых алюминиевых кислот — ортоалюминиевой H2AlO3, метаалюминиевой HAlO2 (ее можно рассматривать как ортоалюминиевую кислоту, от молекулы которой отняли молекулу воды). К природным алюминатам относится благородная шпинель и драгоценный хризоберилл. Соли алюминия, кроме фосфатов, хорошо растворимы в воде. Некоторые соли (сульфиды, сульфиты) разлагаются водой. Хлорид алюминия AlCl3 применяют в качестве катализатора в производстве очень многих органических веществ.





Характеристика переходных элементов — меди, цинка, хрома, железа

Медь (Cu) — элемент побочной подгруппы первой группы. Электронная формула: (…3d 10 4s 1 ). Десятый d-электрон у нее подвижный, т. к. он переместился с 4S-подуровня. Медь в соединениях проявляет степени окисления +1 (Cu2O) и +2 (CuO). Медь — металл светло-розового цвета, тягучий, вязкий, отличный проводник электричества. Температура плавления 1083 °С.

Как и другие металлы подгруппы I группы периодической системы, медь стоит в ряду активности правее водорода и не вытесняет его из кислот, но реагирует с кислотами-окислителями:
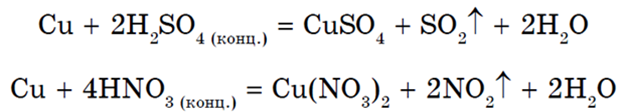
Под действием щелочей на растворы солей меди выпадает осадок слабого основания голубого цвета — гидроксида меди (II), который при нагревании разлагается на основный оксид CuO черного цвета и воду:





Цинк (Zn) — элемент побочной подгруппы II группы. Его электронная формула следующая: (…3d 10 4s 2 ). Так как в атомах цинка предпоследний d-подуровень полностью завершен, то цинк в соединениях проявляет степень окисления +2.
Цинк — металл серебристо-белого цвета, практически не изменяющийся на воздухе. Обладает коррозионной стойкостью, что объясняется наличием на его поверхности оксидной пленки. Цинк — один из активнейших металлов, при повышенной температуре реагирует с простыми веществами:

Цинк вытесняет водород из кислот:

Цинк как и другие металлы вытесняет менее активные металлы из их солей:
Гидроксид цинка амфотерен, т. е. проявляет свойства и кислоты, и основания. При постепенном приливании раствора щелочи к раствору соли цинка выпавший вначале осадок растворяется (аналогично происходит и с алюминием):





На примере хрома (Cr) можно показать, что свойства переходных элементов меняются вдоль периода не принципиально: происходит количественное изменение, связанное с изменением числа электронов на валентных орбиталях. Максимальная степень окисления хрома +6. Металл в ряду активности стоит левее водорода и вытесняет его из кислот:

При добавлении раствора щелочи к такому раствору образуется осадок Me(OH)2, который быстро окисляется кислородом воздуха:

Ему соответствует амфотерный оксид Cr2O3. Оксид и гидроксид хрома (в высшей степени окисления) проявляют свойства кислотных оксидов и кислот соответственно. Соли хромовой кислоты (H2Cr O4) в кислой среде превращаются в дихроматы — соли дихромовой кислоты (H2Cr2O7). Соединения хрома обладают высокой окислительной способностью.



Железо

Железо Fe — элемент побочной подгруппы VIII группы и 4-го периода периодической системы Д. И. Менделеева. Атомы железа устроены несколько отлично от атомов элементов главных подгрупп. Как и положено элементу 4-го периода, атомы железа имеют четыре энергетических уровня, но заполняется из них не последний, а предпоследний, третий от ядра, уровень. На последнем же уровне атомы железа содержат два электрона. На предпоследнем уровне, который может вместить 18 электронов, у атома железа находятся 14 элекронов. Следовательно, распределение электронов по уровням в атомах железа таково: 2е; 8e ; 14е; 2е. Подобно всем металлам, атомы железа проявляют восстановительные свойства, отдавая при химических взаимодействиях не только два электрона с последнего уровня, и приобретая степень окисления +2, но и электрон с предпоследнего уровня, при этом степень окисления атома повышается до +3.
Железо простое вещество
Это серебристо-белый блестящий металл с температурой плавления 1539 °С. Очень пластичный, поэтому легко обрабатывается, куется, прокатывается, штампуется. Железо обладает способностью намагничиваться и размагничиваться. Ему можно придать большую прочность и твердость методами термического и механического воздействия. Различают технически чистое и химически чистое железо. Технически чистое железо, по сути, представляет собой низкоуглеродистую сталь, оно содержит 0,02-0,04 % углерода, а кислорода, серы, азота и фосфора — еще меньше. Химически чистое железо содержит менее 0,01 % примесей. Из технически чистого железа сделаны, например, канцелярские скрепки и кнопки. Такое железо легко корродирует, в то время как химически чистое железо почти не подвергается коррозии. В настоящее время железо — это основа современной техники и сельскохозяйственного машиностроения, транспорта и средств связи, космических кораблей и вообще всей современной цивилизации. Большинство изделий, начиная от швейной иглы, и заканчивая космическими аппаратами, не может быть изготовлено без применения железа.
Химические свойства железа
Железо может проявлять степени окисления +2 и +3, соответственно, железо дает два ряда соединений. Число электронов, которое атом железа отдает при химических реакциях, зависит от окислительной способности реагирующих с ним веществ.
Например, с галогенами железо образует галогениды, в которых оно имеет степень окисления +3:

а с серой — сульфид железа (II):

Раскаленное железо сгорает в кислороде с образованием железной окалины:

При высокой температуре (700-900 °С) железо реагирует с парами воды:

В соответствии с положением железа в электрохимическом ряду напряжений оно может вытеснить металлы, стоящие правее него, из водных растворов их солей, например:

В разбавленных соляной и серной кислотах железо растворяется, т. е. окисляется ионами водорода:

Растворяется железо и в разбавленной азотной кислоте, при этом образуется нитрат железа (III), вода и продукты восстановления азотной кислоты — N2, NO или NH3(NH4NO3) в зависимости от концентрации кислоты.
Соединения железа
В природе железо образует ряд минералов. Это магнитный железняк (магнетит) Fe3O4, красный железняк (гематит) Fe2O3, бурый железняк (лимонит) 2Fe2O3 • 3H2O. Еще одно природное соединение железа — железный, или серный, колчедан (пирит) FeS2, не служит железной рудой для получения металла, но применяется для производства серной кислоты.
Для железа характерны два ряда соединений: соединения железа (II) и железа (III). Оксид железа (II) FeO и соответствующий ему гидроксид железа (II) Fe(OH)2 получают косвенно, в частности, по следующей цепи превращений:

Оба соединения имеют ярко выраженные основные свойства.
Катионы железа (II) Fe 2 + легко окисляются кислородом воздуха до катионов железа (III) Fe 3 + . Поэтому белый осадок гидроксида железа (II) приобретает зеленую окраску, а затем становится бурым, превращаясь в гидроксид железа (III):

Оксид железа (III) Fe2O3 и соответствующий ему гидроксид железа (III) Fe(OH)3 также получают косвенно, например, по цепочке:

Из солей железа наибольшее техническое значение имеют сульфаты и хлориды.
Кристаллогидрат сульфата железа (II) FeSO4 • 7H2O, известный под названием железный купорос, применяют для борьбы с вредителями растений, для приготовления минеральных красок и в других целях. Хлорид железа (III) FeCl3 используют в качестве протравы при крашении тканей. Сульфат железа (III) Fe2(SO4)3 • 9H2O применяется для очистки воды и в других целях.
Физические и химические свойства железа и его соединений обобщены в таблице:




Качественные реакции на ионы Fe 2+ и Fe 3+
Для распознавания соединений железа (II) и (III) проводят качественные реакции на ионы Fe 2+ и Fe 3+ . Качественной реакцией на ионы Fe 2+ служит реакция солей железа (II) с соединением K3[Fe(CN)6], называемым красной кровяной солью. Это особая группа солей, которые называются комплексными, с ними вы познакомитесь в дальнейшем. Пока же нужно усвоить, как диссоциируют такие соли:
![]()
Реактивом на ионы Fe 3+ является другое комплексное соединение — желтая кровяная соль — K4[Fe(CN)6], которая в растворе диссоциирует аналогично:
![]()
Если в растворы, содержащие ионы Fe 2+ и Fe 3+ , добавить, соответственно, растворы красной кровяной соли (реактив на Fe 2+ ) и желтой кровяной соли (реактив на Fe 3+ ), то в обоих случаях выпадает одинаковый синий осадок:

Для обнаружения ионов Fe 3+ еще используют взаимодействие солей железа (III) с роданидом калия KNCS или аммония NH4NCS. При этом образуется ярко окрашенный ион FeNCNS 2+ , в результате чего весь раствор приобретает интенсивно красный цвет:
Источник https://uchitel.pro/%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB%D1%8B/
Источник https://bingoschool.ru/manual/klassifikacziya-metallov-metallyi-ix-splavyi-xarakteristiki-i-drugoe/
Источник https://chem-mind.com/2017/03/10/%D1%81%D0%B2%D0%BE%D0%B9%D1%81%D1%82%D0%B2%D0%B0-%D0%BF%D1%80%D0%BE%D1%81%D1%82%D1%8B%D1%85-%D0%B2%D0%B5%D1%89%D0%B5%D1%81%D1%82%D0%B2-%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB%D0%BE%D0%B2/