Содержание
Химические свойства металлов
Все металлы, в зависимости от их окислительно-восстановительной активности объединяют в ряд, который называется электрохимическим рядом напряжения металлов (так как металлы в нем расположены в порядке увеличения стандартных электрохимических потенциалов) или рядом активности металлов:
Li, K, Ва, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Рt, Au
Наиболее химически активные металлы стоят в ряду активности до водорода, причем, чем левее расположен металл, тем он активнее. Металлы, занимающие в ряду активности, место после водорода считаются неактивными.
Взаимодействие с простыми веществами
Металлы способны реагировать с простыми веществами, такими как кислород (реакция горения), галогены, азот, сера, водород, фосфором и углеродом. В реакцию взаимодействия с кислородом вступают все металлы (исключение составляют Au, Pt), в результате чего возможно образование трех различных продуктов — пероксидов, оксидов и надпероксидов:
K + O2 = KO2 (надпероксид калия)
Металлы средней активности (начиная с Al) и неактивные металлы реагируют с кислородом только при нагревании:
В реакцию взаимодействия с азотом способны вступать только активные металлы, в результате чего образуются азиды, причем при н.у. с азотом реагирует только литий, остальные активные металлы – только при нагревании:
Только активные металлы способны взаимодействовать с углеродом и водородом, причем в случае реакции с водородом – это только щелочные и щелочноземельные металлы:
2Na + H2 = NaH (гидрид натрия)
С серой реагируют все металлы кроме Au и Pt:
2K +S = K2S (сульфид калия)
Также металлы способны взаимодействовать с галогенами и фосфором:
2Na + Cl2 = 2NaCl (хлорид натрия)
3Ca + 2P = Ca3P2 (фосфид кальция)
Все реакции взаимодействия с простыми веществами носят окислительно-восстановительный характер, металлы в них окисляются, проявляя свойства восстановителей, т.е. демонстрируют способность отдавать электроны:
Fe ![]() -2e = Fe 2+ процесс окисления, железо — восстановитель
-2e = Fe 2+ процесс окисления, железо — восстановитель
S ![]() +2e = S 2- процесс восстановления, сера – окислитель
+2e = S 2- процесс восстановления, сера – окислитель
Взаимодействие металлов друг с другом
Металлы взаимодействуют друг с другом, образуя интерметаллические соединения:
Взаимодействие металлов с водой
Активные металлы (щелочные и некоторые щелочноземельные металлы — Ca, Sr, Ba) способны взаимодействовать с водой с образованием гидроксидов:
Металлы, характеризующиеся средней активностью (начиная с Al) вступают в реакцию с водой в более жестких условиях (наличие щелочной или кислотной среды и др. условия); при этом образуется соответствующий оксид и выделяется водород:
Неактивные металлы с водой не реагируют.
Реакции взаимодействия металлов с водой также относятся к ОВР и металлы в них являются восстановителями.
Взаимодействие металлов с кислотами
Металлы, стоящие в ряду активности до водорода способны реагировать с кислотами:
Неактивные металлы взаимодействуют с кислотами при особых условиях. Так, концентрированная серная кислота способна растворять медь (1), а при взаимодействии меди с концентрированной азотной кислотой в зависимости от её концентрации (60% или 30%) образуются различные продукты реакции (2, 3):
Взаимодействие металлов с солями
Более активные металлы способны взаимодействовать с солями, образованными менее активными металлами, и вытеснять их (металлы) из солей:
Какой из перечисленных металлов легче всего окисляется на воздухе1)алюминий2)магний3)натрий4)железо?

Выберите самые электропроводные металлы а)золото б)серебро в)натрий г)железо д)медь е)марганец ж)алюминий з)магний?
Выберите самые электропроводные металлы а)золото б)серебро в)натрий г)железо д)медь е)марганец ж)алюминий з)магний.

Из перечисленных металлов выберите самый активный металл : медь, кальций, алюминий, серебро, железо?
Из перечисленных металлов выберите самый активный металл : медь, кальций, алюминий, серебро, железо.

Тепло — и электропроводность : МЕДИ?
Тепло — и электропроводность : МЕДИ.

Какой из металлов натрий магний алюминий является наиболее сильным восстановителем Почему?
Какой из металлов натрий магний алюминий является наиболее сильным восстановителем Почему.

ПОМОГИТЕ ПОЖАЛУЙСТА?
Оксид натрия Оксид магния оксид алюминия оксид железа(2) оксид железа(3) Хлорид натрия Хлорид магния Хлорид алюминия хлорид железо(2) хлорид железо(3) Нейтрид натрия нейтрид магния Нейтрид алюминия Нейтрид железо(2) Нейтрид Железо(3) карбит Натрия карбит Магния карбит алюминия Карбит железа(2) карбит железа(3).

Какой из этих металлов легче всего реагирует с кислородом : натрий медь цинк алюминий?
Какой из этих металлов легче всего реагирует с кислородом : натрий медь цинк алюминий.

На воздухе легче всего окисляется : А) натрий ; В)магний ; Б) калий ; Г) кальций?
На воздухе легче всего окисляется : А) натрий ; В)магний ; Б) калий ; Г) кальций.

Какой металл не вытесняет водород из разбавленной кислоты магний алюминий натрий ртуть?
Какой металл не вытесняет водород из разбавленной кислоты магний алюминий натрий ртуть.

На воздухе легче всего окисляется : А) натрий ; В)магний ; Б) калий ; Г) кальций 20 балловНатрий не правильно точно?
На воздухе легче всего окисляется : А) натрий ; В)магний ; Б) калий ; Г) кальций 20 баллов
Натрий не правильно точно.

Какие из следующих металлов вытесняют водород из соляной кислоты : калий, барий?
Какие из следующих металлов вытесняют водород из соляной кислоты : калий, барий.
Ртуть, железо, медь, серебро, натрий, магний, алюминий, цинк?
На этой странице сайта вы найдете ответы на вопрос Какой из перечисленных металлов легче всего окисляется на воздухе1)алюминий2)магний3)натрий4)железо?, относящийся к категории Химия. Сложность вопроса соответствует базовым знаниям учеников 5 — 9 классов. Для получения дополнительной информации найдите другие вопросы, относящимися к данной тематике, с помощью поисковой системы. Или сформулируйте новый вопрос: нажмите кнопку вверху страницы, и задайте нужный запрос с помощью ключевых слов, отвечающих вашим критериям. Общайтесь с посетителями страницы, обсуждайте тему. Возможно, их ответы помогут найти нужную информацию.

Вот фотография с решением.

СН3 — СН(СН3) — СН(СН3) — СН(СН3) — СНОН — СНОН если правильно , то счет начинается с группы ОН.

6HCl + 2CrO3 — > 3Cl2 + 2 CrCl3 + 3H2O 2Cl( — ) — 2e — > Cl2(0) 3 ок — ие в — ль Cr( + 6) + 3e — > Cr( + 3) 2 в — ие ок — ль 2Ag + 2 H2SO4 — > Ag2SO4 + SO2 + 2H2O Ag(0) — 1e — > Ag( + ) 2 ок — ие в — ль S( + 6) + 2e — > S( + 4) 1 в — ие ок — ль.

Для 100 гр води 20% = 20 гр цукру 20 / 100 — — — х / 70 х = 70×20 / 100 = 14 гр.
Химические свойства простых веществ. Химические свойства сложных вещест
С развитием производства металлов (простых веществ) и сплавов связано возникновение цивилизации (бронзовый век, железный век).
Начавшаяся примерно $100$ лет назад научно-техническая революция, затронувшая и промышленность, и социальную сферу, также тесно связана с производством металлов. На основе вольфрама, молибдена, титана и других металлов начали создавать коррозионностойкие, сверхтвердые, тугоплавкие сплавы, применение которых сильно расширило возможности машиностроения. В ядерной и космической технике из сплавов вольфрама и рения делают детали, работающие при температурах до $3000°С$; в медицине используют хирургические инструменты из сплавов тантала и платины, уникальной керамики на основе оксидов титана и циркония.
И, конечно же, мы не должны забывать, что в большинстве сплавов используют давно известный металл железо, а основу многих легких сплавов составляют сравнительно «молодые» металлы — алюминий и магний.
Сверхновыми стали композиционные материалы, представляющие, например, полимер или керамику, которые внутри (как бетон железными прутьями) упрочнены металлическими волокнами из вольфрама, молибдена, стали и других металлов и сплавов — все зависит от поставленной цели и необходимых для ее достижения свойств материала.
Вы уже имеете представление о природе химической связи в кристаллах металлов. Напомним на примере одного из них — натрия, как она образуется. На рисунке изображена схема кристаллической решетки натрия. В ней каждый атом натрия окружен восемью соседями. У атома натрия, как и у всех металлов, имеется много свободных валентных орбиталей и мало валентных электронов. Электронная формула атома натрия: $1s^<2>2s^<2>2p^<6>3s^<1>3p^<0>3d^<0>$, где $3s, 3p, 3d$ — валентные орбитали.
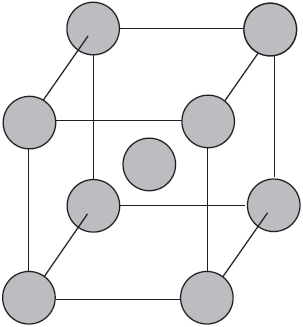
Единственный валентный электрон атома натрия $3s^1$ может занимать любую из девяти свободных орбиталей — $3s$ (одна), $3р$ (три) и $3d$ (пять), ведь они не очень отличаются по уровню энергии. При сближении атомов, когда образуется кристаллическая решетка, валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются с одной орбитали на другую, осуществляя связь между всеми атомами кристалла металла.
Такую химическую связь называют металлической. Металлическую связь образуют элементы, атомы которых на внешнем слое имеют мало валентных электронов по сравнению с большим числом внешних энергетически близких орбиталей. Их валентные электроны слабо удерживаются в атоме. Электроны, осуществляющие связь, обобществлены и перемещаются по всей кристаллической решетке в целом нейтрального металла.
Веществам с металлической связью присущи металлические кристаллические решетки, которые обычно изображают схематически так, как показано на рисунке. Катионы и атомы металлов, расположенные в узлах кристаллической решетки, обеспечивают ее стабильность и прочность (обобществленные электроны изображены в виде черных маленьких шариков).
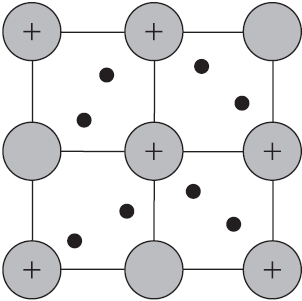
Металлическая связь — это связь в металлах и сплавах между атомионами металлов, расположенными в узлах кристаллической решетки, осуществляемая обобществленными валентными электронами.
Некоторые металлы кристаллизуются в двух или более кристаллических формах. Это свойство веществ — существовать в нескольких кристаллических модификациях — называют полиморфизмом.
Например, железо имеет четыре кристаллических модификации, каждая из которых устойчива в определенном температурном интервале:
- $α$ — устойчива до $768°С$, ферромагнитная;
- $β$ — устойчива от $768$ до $910°С$, неферромагнитная, т.е. парамагнитная;
- $γ$ — устойчива от $910$ до $1390°С$, неферромагнитная, т.е. парамагнитная;
- $δ$ — устойчива от $1390$ до $1539°С$ ($t°_ <пл.>железа), неферромагнитная.
Олово имеет две кристаллические модификации:
- $α$ — устойчива ниже $13,2°С$ ($ρ=5,75 г/см^3$). Это серое олово. Оно имеет кристаллическую решетку типа алмаза (атомную);
- $β$ — устойчива выше $13,2°С$ ($ρ=6,55 г/см^3$). Это белое олово.
Белое олово — серебристо-белый очень мягкий металл. При охлаждении ниже $13,2°С$ он рассыпается в серый порошок, т.к. при переходе $β→α$ значительно увеличивается его удельный объем. Это явление получило название «оловянной чумы».
Конечно, особый вид химической связи и тип кристаллической решетки металлов должны определять и объяснять их физические свойства.
Каковы же они? Это металлический блеск, пластичность, высокая электрическая проводимость и теплопроводность, рост электрического сопротивления при повышении температуры, а также такие значимые свойства, как плотность, высокие температуры плавления и кипения, твердость, магнитные свойства.
Давайте попробуем объяснить причины, определяющие основные физические свойства металлов.
Почему металлы пластичны?
Механическое воздействие на кристалл с металлической кристаллической решеткой вызывает смещение слоев ион-атомов друг относительно друга, а так как электроны перемещаются по всему кристаллу, разрыв связей не происходит, поэтому для металлов характерна большая пластичность.
Аналогичное воздействие на твердое вещество с ковалентными связями (атомной кристаллической решеткой) приводит к разрыву ковалентных связей. Разрыв связей в ионной решетке приводит к взаимному отталкиванию одноименно заряженных ионов. По этому вещества с атомными и ионными кристаллическими решетками хрупкие.
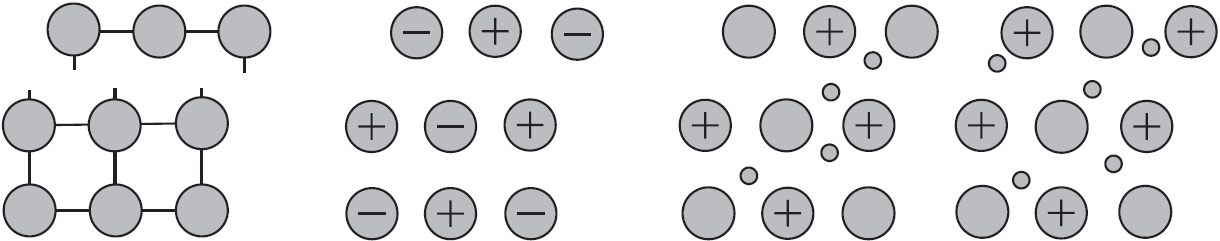
Наиболее пластичные металлы — это $Au, Ag, Sn, Pb, Zn$. Они легко вытягиваются в проволоку, поддаются ковке, прессованию, прокатыванию в листы. Например, из золота можно изготовить золотую фольгу толщиной $0,003$ мм, а из $0,5$ г этого металла можно вытянуть нить длиной $1$ км.
Даже ртуть, которая, как вы знаете, при комнатной температуре жидкая, при низких температурах в твердом состоянии становится ковкой, как свинец. Не обладают пластичностью лишь $Bi$ и $Mn$, они хрупкие.
Почему металлы имеют характерный блеск, а также непрозрачны?
Электроны, заполняющие межатомное пространство, отражают световые лучи (а не пропускают, как стекло), причем большинство металлов в равной степени рассеивают все лучи видимой части спектра. Поэтому они имеют серебристо-белый или серый цвет. Стронций, золото и медь в большей степени поглощают короткие волны (близкие к фиолетовому цвету) и отражают длинные волны светового спектра, поэтому имеют светло-желтый, желтый и медный цвета.
Хотя на практике металл не всегда нам кажется светлым телом. Во-первых, его поверхность может окисляться и терять блеск. Поэтому самородная медь выглядит зеленоватым камнем. А во-вторых, и чистый металл может не блестеть. Очень тонкие листы серебра и золота имеют совершенно неожиданный вид — они имеют голубовато-зеленый цвет. А мелкие порошки металлов кажутся темно-серыми, даже черными.
Наибольшую отражательную способность имеют серебро, алюминий, палладий. Их используют при изготовлении зеркал, в том числе и в прожекторах.
Почему металлы имеют высокую электрическую проводимость и теплопроводны?
Хаотически движущиеся электроны в металле под воздействием приложенного электрического напряжения приобретают направленное движение, т. е. проводят электрический ток. При повышении температуры металла возрастают амплитуды колебаний находящихся в узлах кристаллической решетки атомов и ионов. Это затрудняет перемещение электронов, электрическая проводимость металла падает. При низких температурах колебательное движение, наоборот, сильно уменьшается и электрическая проводимость металлов резко возрастает. Вблизи абсолютного нуля сопротивление у металлов практически отсутствует, у большинства металлов появляется сверхпроводимость.
Следует отметить, что неметаллы, обладающие электрической проводимостью (например, графит), при низких температурах, наоборот, не проводят электрический ток из-за отсутствия свободных электронов. И только с повышением температуры и разрушением некоторых ковалентных связей их электрическая проводимость начинает возрастать.
Наибольшую электрическую проводимость имеют серебро, медь, а также золото, алюминий, наименьшую — марганец, свинец, ртуть.
Чаще всего с той же закономерностью, как и электрическая проводимость, изменяется теплопроводность металлов.
Она обусловлена большой подвижностью свободных электронов, которые, сталкиваясь с колеблющимися ионами и атомами, обмениваются с ними энергией. Происходит выравнивание температуры по всему куску металла.
Механическая прочность, плотность, температура плавления у металлов очень сильно отличаются. Причем с увеличением числа электронов, связывающих ион-атомы, и уменьшением межатомного расстояния в кристаллах показатели этих свойств возрастают.
Так, щелочные металлы ($Li, K, Na, Rb, Cs$), атомы которых имеют один валентный электрон, мягкие, с небольшой плотностью (литий — самый легкий металл с $ρ=0,53 г/см^3$) и плавятся при невысоких температурах (например, температура плавления цезия $29°С$). Единственный металл, жидкий при обычных условиях, — ртуть — имеет температуру плавления, равную $–38,9°С$.
Кальций, имеющий два электрона на внешнем энергетическом уровне атомов, гораздо более тверд и плавится при более высокой температуре ($842°С$).
Еще более прочной является кристаллическая решетка, образованная ионами скандия, который имеет три валентных электрона.
Но самые прочные кристаллические решетки, большие плотности и температуры плавления наблюдаются у металлов побочных подгрупп V, VI, VII, VIII групп. Это объясняется тем, что для металлов побочных подгрупп, имеющих неспаренные валентные электроны на d-подуровне, характерно образование очень прочных ковалентных связей между атомами, помимо металлической, осуществляемой электронами внешнего слоя с $s$-орбиталей.
Вспомните, что самый тяжелый металл — это осмий $Os$ с $ρ=22,5 г/см^3$ (компонент сверхтвердых и износостойких сплавов), самый тугоплавкий металл — это вольфрам $W$ с $t_<пл.>=3420°С$ (применяется для изготовления нитей накаливания ламп), самый твердый металл — это хром $Cr$ (царапает стекло). Они входят в состав материалов, из которых изготавливают металлорежущий инструмент, тормозные колодки тяжелых машин и др.
Металлы по-разному взаимодействуют с магнитным полем. Такие металлы, как железо, кобальт, никель и гадолиний выделяются своей способностью сильно намагничиваться. Их называют ферромагнетиками. Большинство металлов (щелочные и щелочноземельные металлы и значительная часть переходных металлов) слабо намагничиваются и не сохраняют это состояние вне магнитного поля — это парамагнетики. Металлы, выталкиваемые магнитным полем, — диамагнетики (медь, серебро, золото, висмут).
Напомним, что при рассмотрении электронного строения металлов мы разделили металлы на металлы главных подгрупп ($s-$ и $р-$элементы) и металлы побочных подгрупп (переходные $d-$ и $f-$элементы).
В технике принято классифицировать металлы по различным физическим свойствам:
а) плотности — легкие ($ρ < 5 г/см^3$) и тяжелые (все остальные);
б) температуре плавления — легкоплавкие и тугоплавкие.
Железо и его сплавы принято считать черными металлами, а все остальные — цветными.
Существуют классификации металлов по химическим свойствам.
Металлы с низкой химической активностью называют благородными (серебро, золото, платина и ее аналоги — осмий, иридий, рутений, палладий, родий).
По близости химических свойств выделяют щелочные (металлы главной подгруппы I группы), щелочноземельные (кальций, стронций, барий, радий), а также редкоземельные металлы (скандий, иттрий, лантан и лантаноиды, актиний и актиноиды).
Атомы металлов сравнительно легко отдают валентные электроны и переходят в положительно заряженные ионы, т.е. окисляются. В этом, как вам известно, заключается главное общее свойство и атомов, и простых веществ — металлов.
Металлы в химических реакциях всегда восстановители. Восстановительная способность атомов простых веществ — металлов, образованных химическими элементами одного периода или одной главной подгруппы Периодической системы Д.И. Менделеева, изменяется закономерно.
Электрохимический ряд напряжений металлов
Восстановительную активность металла в химических реакциях, которые протекают в водных растворах, отражает его положение в электрохимическом ряду напряжений металлов.

На основании этого ряда напряжений можно сделать следующие важные заключения о химической активности металлов в реакциях, протекающих в водных растворах при стандартных условиях ($t=25°С, р=1 атм$):
- Чем левее стоит металл в этом ряду, тем более сильным восстановителем он является.
- Каждый металл способен вытеснять (восстанавливать) из солей в растворе те металлы, которые в ряду напряжений стоят после него (правее).
- Металлы, находящиеся в ряду напряжений левее водорода, способны вытеснять его из кислот в растворе.
Восстановительная активность металла, определенная по электрохимическому ряду, не всегда соответствует положению его в Периодической системе. Это объясняется тем, что при определении положения металла в ряду напряжений учитывают не только энергию отрыва электронов от отдельных атомов, но и энергию, затрачиваемую на разрушение кристаллической решетки, а также энергию, выделяющуюся при гидратации ионов.
Металлы, являющиеся самыми сильными восстановителями (щелочные и щелочноземельные), в любых водных растворах взаимодействуют прежде всего с водой.
Например, литий более активен в водных растворах, чем натрий (хотя по положению в Периодической системе $Na$ — более активный металл). Дело в том, что энергия гидратации ионов $Li^+$ значительно больше, чем энергия гидратации $Na^+$, поэтому первый процесс является энергетически более выгодным.
Рассмотрев общие положения, характеризующие восстановительные свойства металлов, перейдем к конкретным химическим реакциям.
Взаимодействие металлов с неметаллами
1. С кислородом большинство металлов образуют оксиды — основные и амфотерные. Кислотные оксиды переходных металлов, например оксид хрома (VI) $CrO_3$ или оксид марганца(VII) $Mn_2O_7$, не образуются при прямом окислении металла кислородом. Их получают косвенным путем.
Щелочные металлы $Na, K$ активно реагируют с кислородом воздуха, образуя пероксиды:
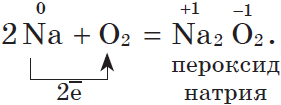
Оксид натрия получают косвенным путем, при прокаливании пероксидов с соответствующими металлами:
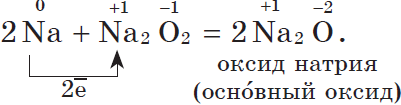
Литий и щелочноземельные металлы взаимодействуют с кислородом воздуха, образуя основные оксиды:
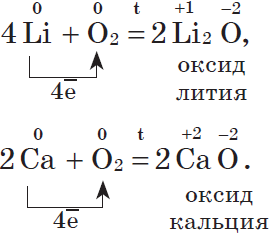
Другие металлы, кроме золота и платиновых металлов, которые вообще не окисляются кислородом воздуха, взаимодействуют с ним менее активно или при нагревании:
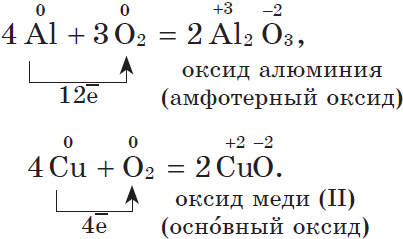
2. С галогенами металлы образуют соли галогеноводородных кислот, например:
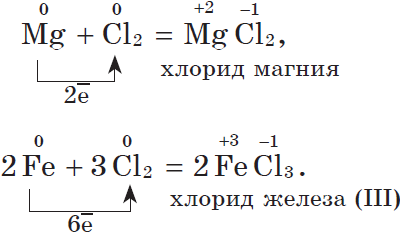
3. С водородом самые активные металлы образуют гидриды — ионные солеподобные вещества, в которых водород имеет степень окисления $–1$, например:
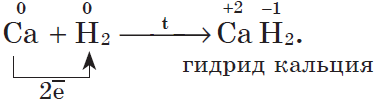
Многие переходные металлы образуют с водородом гидриды особого типа — происходит как бы растворение или внедрение водорода в кристаллическую решетку металлов между атомами и ионами, при этом металл сохраняет свой внешний вид, но увеличивается в объеме. Поглощенный водород находится в металле, по-видимому, в атомарном виде.
Существуют и гидриды металлов промежуточного характера.
4. С серой металлы образуют соли — сульфиды, например:
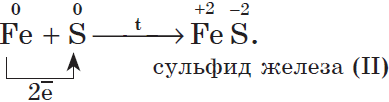
5. С азотом металлы реагируют несколько труднее, т.к. химическая связь в молекуле азота $N_2$ очень прочна; при этом образуются нитриды. При обычной температуре взаимодействует с азотом только литий:
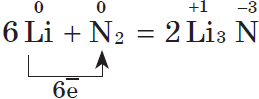
Взаимодействие металлов со сложными веществами
1. С водой. Щелочные и щелочноземельные металлы при обычных условиях вытесняют водород из воды и образуют растворимые основания — щелочи, например:
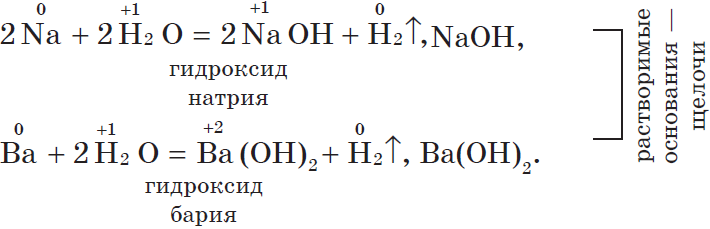
Другие металлы, стоящие в ряду напряжений до водорода, тоже могут при определенных условиях вытеснять водород из воды. Но алюминий бурно взаимодействует с водой, только если удалить с его поверхности оксидную пленку:
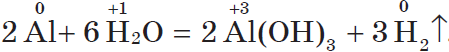
Магний взаимодействует с водой только при кипячении, при этом также выделяется водород:
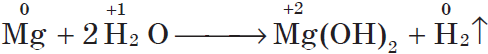
Если горящий магний внести в воду, то горение продолжается, т.к. протекает реакция: $2H_<2>+O_<2>=2H_2O$ (говорит водород). Железо взаимодействует с водой только в раскаленном виде:
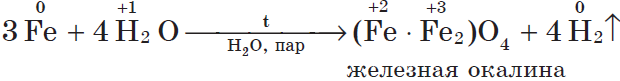
2. С кислотами в растворе ($HCl, H_2SO_<4(разб.)>, CH_3COOH$ и др., кроме $HNO_3$) взаимодействуют металлы, стоящие в ряду напряжений до водорода. При этом образуются соль и водород.
А вот свинец (и некоторые другие металлы), несмотря на его положение в ряду напряжений (слева от водорода), почти не растворяется в разбавленной серной кислоте, т.к. образующийся сульфат свинца $PbSO_4$ нерастворим и создает на поверхности металла защитную пленку.
3. С солями менее активных металлов в растворе. В результате такой реакции образуется соль более активного металла и выделяется менее активный металл в свободном виде.
Нужно помнить, что реакция идет в тех случаях, когда образующаяся соль растворима. Вытеснение металлов из их соединений другими металлами впервые подробно изучил Н.Н. Бекетов — крупный русский физико-химик. Он расположил металлы по химической активности в «вытеснительный ряд», ставший прототипом ряда напряжений металлов.
4. С органическими веществами. Взаимодействие с органическими кислотами аналогично реакциям с минеральными кислотами. Спирты же могут проявлять слабые кислотные свойства при взаимодействии со щелочными металлами:
Аналогично реагирует и фенол:
Металлы участвуют в реакциях с галогеналканами, которые используют для получения низших циклоалканов и для синтезов, в ходе которых происходит усложнение углеродного скелета молекулы (реакция А. Вюрца):
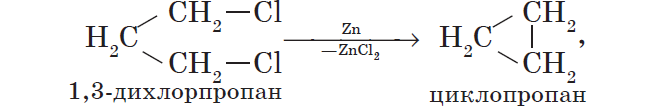
5. Со щелочами в растворе взаимодействуют металлы, гидроксиды которых амфотерны.
6. Металлы могут образовывать друг с другом химические соединения, которые получили общее название интерметаллических соединений. В них чаще всего не проявляются степени окисления атомов, которые характерны для соединений металлов с неметаллами. Например:
$Cu_3Au, LaNi_5, Na_2Sb, Ca_3Sb_2$ и др.
Интерметаллические соединения обычно не имеют постоянного состава, химическая связь в них в основном металлическая. Образование этих соединений более характерно для металлов побочных подгрупп.
Химические свойства щелочных металлов ($Na, K$)
Щелочные металлы — это элементы главной подгруппы I группы Периодической системы. На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемуся на большом удалении от ядра. Они легко отдают этот электрон, поэтому являются сильными восстановителями. Во всех соединениях щелочные металлы проявляют степень окисления $+1$. Все они типичные металлы, имеют серебристо-белый цвет, мягкие (режутся ножом), легкие и легкоплавкие. Активно взаимодействуют со всеми неметаллами:
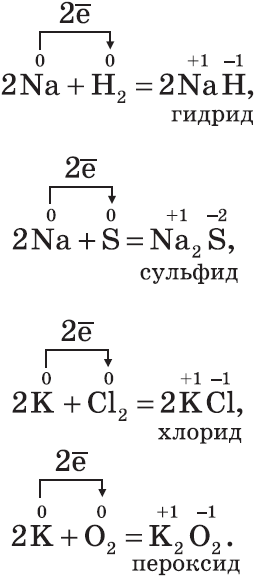
Все щелочные металлы при взаимодействии с кислородом (исключение — $Li$) образуют пероксиды. В свободном виде щелочные металлы не встречаются из-за их высокой химической активности.
Оксиды — твердые вещества, имеют основные свойства. Их получают, прокаливая пероксиды с соответствующими металлами:
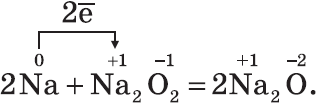
Гидроксиды $NaOH, KOH$ — твердые белые вещества, гигроскопичны, хорошо растворяются в воде с выделением теплоты, их относят к щелочам:
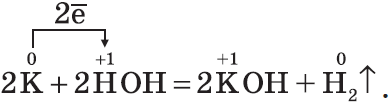
Соли щелочных металлов почти все растворимы в воде. Важнейшие из них: $Na_2CO_3$ — карбонат натрия; $Na_2CO_3·10H_2O$ — кристаллическая сода; $NaHCO_3$ — гидрокарбонат натрия, пищевая сода; $K_2CO_3$ — карбонат калия, поташ; $Na_2SO_4·10H_2O$ — глауберова соль; $NaCl$ — хлорид натрия, пищевая соль.
Химические свойства щелочноземельных металлов ($Ca, Mg$)
Кальций ($Ca$) является представителем щелочноземельных металлов, как называют элементы главной подгруппы II группы, но не все, а только начиная с кальция и вниз по группе. Это те химические элементы, которые, взаимодействуя с водой, образуют щелочи. Кальций на внеш нем энергетическом уровне содержит два электрона, степень окисления $+2$.
Физические и химические свойства кальция и его соединений представлены в таблице.
Магний ($Mg$) имеет такое же строение атома, как и кальций, степень его окисления также $+2$. Мягкий металл, но его поверхность на воздухе покрывается защитной пленкой, что немного снижает его химическую активность. Его горение сопровождается ослепительной вспышкой. $MgO$ и $Mg(OH)_2$ проявляют основные свойства. Хотя $Mg(OH)_2$ и малорастворим, но окрашивает раствор фенолфталеина в малиновый цвет.
Оксиды $MgO$ — твердые белые тугоплавкие вещества. В технике $CaO$ называют негашеной известью, а $MgO$ — жженой магнезией, их используют в производстве строительных материалов.
Реакция оксида кальция с водой сопровождается выделением теплоты и называется гашением извести, а образующийся $Ca(OH)_2$ — гашеной известью. Прозрачный раствор гидроксида кальция называется известковой водой, а белая взвесь $Ca(OH)_2$ в воде — известковым молоком.
Соли магния и кальция получают взаимодействием их с кислотами.
$CaCO_3$ — карбонат кальция, мел, мрамор, известняк. Применяется в строительстве. $MgCO_3$ — карбонат магния — применяется в металлургии для освобождения от шлаков. $CaSO_4·2H_2O$ — гипс. $MgSO_4$ — сульфат магния — называют горькой, или английской, солью, содержится в морской воде. $BaSO_4$ — сульфат бария — благодаря нерастворимости и способности задерживать рентгеновские лучи применяется в диагностике («баритовая каша») желудочно-кишечного тракта.
На долю кальция приходится $1,5%$ массы тела человека, $98%$ кальция содержится в костях.
Кальций и его соединения.
| Кальций | Оксид и гидроксид кальция | Соли кальция |
| 1. Серебристо-белый металл. 2. Активный металл, окисляется простыми веществами — неметаллами: $2Ca+O_2=2CaO$ $Ca+Cl_2=CaCl_2$ $Ca+S=CaS$ $Ca+H_2=CaH_2$ 3. Вытесняет водород из воды: $Ca+2H_2O=Ca(OH)_2+H_2↑$ 4. Вытесняет металлы из их оксидов (кальциотермия): $2Ca+ThO_2=Th+2CaO$ Получение Разложение электрическим током расплава хлорида кальция: $CaCl_2=Ca+Cl_2↑$ | 1. Порошки белого цвета. 2. Оксид кальция (негашеная известь) проявляет свойства основного оксида: а) взаимодействует с водой с образованием основания: $CaO+H_2O=Ca(OH)_2$ б) взаимодействует с кислотными оксидами: $CaO+SiO_2=CaSiO_3$ 3. Гидроксид кальция проявляет свойства сильного основания: $Ca(OH)_2=Ca^<2+>+2OH^<–>$ $Ca(OH)_2+CO_2=CaCO_3↓+H_2O$; $Ca(OH)_2+Ca(HCO_3)_2=2CaCO_3↓+2H_2O$$ Получение 1. Оксида — обжиг известняка: $CaCO_3=CaO+CO_2↑$ 2. Гидроксида — гашение негашеной извести: $CaO+H_2O=Ca(OH)_2$ | 1. Образует нерастворимый карбонат: $Ca^<2+>+CO_3^<2−>=CaCO_3↓$ и растворимый гидрокарбонат: $CaCO_<3(кр)>+CO_2+H_2O=Ca(HCO_3)_<2(р-р)>$ 2. Образует нерастворимый фосфат: $3Сa_<2+>+2PO_4^<3−>=Ca_3(PO_4)_2↓$ и растворимый дигидрофосфат: $Ca_3(PO_4)_<2(кр)>+4H_3PO_4=3Ca(H_2PO_4)_<2(р-р)>$ 3. Гидрокарбонат разлагается при кипячении или испарении раствора: $Ca(HCO_3)_2=CaCO_3↓+CO_2↑+H_2O$ 4. Обожженный природный гипс: $CaSO_4·2H_2O=CaSO_4·0,5H_2O+1,5H_2O$ затвердевает при взаимодействии с водой, снова образуя кристаллогидрат: $CaSO_4·0,5H_2O+1,5H_2O=CaSO_4·2H_2O$ |
Химические свойства алюминия
Алюминий ($Al$) — элемент главной подгруппы III группы Периодической системы. У него на внешнем энергетическом уровне три электрона, которые алюминий легко отдает при химических взаимодействиях. У атомов алюминия восстановительные свойства выражены ярче, чем у бора, т.к. у алюминия имеется промежуточный слой с восемью электронами ($2e↖<->; 8e↖<->; 3e↖<->$), который препятствует притяжению электронов к ядру. Алюминий имеет степень окисления $+3$.
Алюминий — серебристо-белый металл, $t°_<пл>=660°С$. Это самый распространенный металл земной коры, обладает высокой коррозионной стойкостью. Малая плотность алюминия ($2,7 г/<см^3>$) в сочетании с высокой прочностью и пластичностью его сплавов делают алюминий незаменимым в самолетостроении. Высокая электропроводность алюминия (в $1.6$ раза меньше, чем у меди) позволяет заменять медные провода более легкими — алюминиевыми.
Высокая химическая активность алюминия используется в алюминотермии, с помощью которой получают хром, ванадий, титан и другие металлы.
Прочность химической связи в оксиде $Al_2O_3$ обуславливает его механическую прочность, твердость. $Al_2O_3$ — корунд, абразивный материал. Искусственный рубин — $Al_2O_3$ с добавлением оксида хрома. Химические свойства алюминия и его соединений обобщены в таблице.
Алюминий и его соединения.
| Алюминий | Соединения алюминия | |
| Оксид алюминия | Гидроксид алюминия | |
| 1. Серебристо-белый легкий металл. 2. Окисляется на воздухе с образованием защитной пленки: $4Al+3O_2=2Al_2O_3$ 3. Вытесняет водород из воды: $2Al+6H_2O=2Al(OH)_3↓+3H_2↑$ 4. Взаимодействует с кислотами: $2Al^<0>+6H^<+>=2Al^<3+>+3H_2^0<↑>$ 5. Взаимодействует с водным раствором щелочи: $2Al+2H_2O+2NaOH=2NaAlO_2+3H_2<↑>$ 6. Вытесняет металлы из их оксидов (алюминотермия): $8Al+3Fe_3O_4=9Fe+4Al_2O_3+Q$ Получение Разложение электрическим током расплава оксида алюминия (в криолите): $2Al_2O_3=4Al+3O_2<↑>–3352 кДж$ | 1. Очень твердый порошок белого цвета 2. Амфотерный оксид, взаимодействует: а) с кислотами: $Al_2O_3+6H^<+>=2Al^<3+>+3H_2O$ б) со щелочами: $Al_2O_3+2OH^<–>=2AlO_2^<−>+H_2O$ Образуется: а) при окислении или горении алюминия на воздухе: $4Al+3O_2=2Al_2O_3$ б) в реакции алюминотермии: $2Al+Fe_2O_3=Al_2O_3+2Fe$; в) при термическом разложении гидроксида алюминия: $2Al(OH)_3=Al_2O_3+3H_2O$ | 1. Белый нерастворимый в воде порошок. 2. Проявляет амфотерные свойства, взаимодействует: а) с кислотами: $Al(OH)_3+3HCl=AlCl_3+3H_2O$ $Al(OH)_3+3H^<+>=Al^<3+>+3H_2O$ б) со щелочами: $Al(OH)_3+NaOH=NaAlO_2+2H_2O$ $Al(OH)_3+OH^<–>=AlO_2^<−>+2H_2O$ 3. Разлагается при нагревании: $2Al(OH)_3=Al_2O_3+3H_2O$ Образуется при: а) взаимодействии растворов солей алюминия с растворами щелочей (без избытка): $Al^<3+>+3OH^<–>=Al(OH)_3↓$ б) взаимодействии алюминатов с кислотами (без избытка): $AlO_2^<−>+H^<+>+H_2O=Al(OH)_3↓$ Соли алюминия в водных растворах гидролизуются: $Al^<3+>+H_2O⇄AlOH^<2+>+H^<+>$ $AlOH^<2+>+H_2O⇄Al(OH)_2^<+>+H^<+>$ $Al(OH)_2^<+>+H_2O⇄Al(OH)_<3>+H^<+>$ |
Химические свойства меди
Медь ($Cu$) — элемент побочной подгруппы первой группы. Электронная формула: ($. 3d^<10>4s^1$). Десятый d-электрон атома меди подвижный, т. к. переместился с $4s$-подуровня. Медь в соединениях проявляет степени окисления $+1(Cu_2O)$ и $+2(CuO)$.
Медь — мягкий, блестящий металл, имеющий красную окраску, ковкий и обладает хорошими литейными качествами, хороший тепло- и электропроводник. Температура плавления $1083°С$.
Как и другие металлы побочной подгруппы I группы Периодической системы, медь стоит в ряду активности правее водорода и не вытесняет его из кислот, но реагирует с кислотами-окислителями:
Под действием щелочей на растворы солей меди выпадает осадок слабого основания голубого цвета — гидроксида меди (II), который при нагревании разлагается на основный оксид $CuO$ черного цвета и воду:
Химические свойства цинка
Цинк ($Zn$) — элемент побочной подгруппы II группы. Его электронная формула следующая: ($. 3d^<10>4s^2$). Так как в атомах цинка предпоследний $d-$подуровень полностью завершен, то цинк в соединениях проявляет степень окисления $+2$.
Цинк — металл серебристо-белого цвета, практически не изменяющийся на воздухе. Обладает коррозионной стойкостью, что объясняется наличием на его поверхности оксидной пленки.
Цинк — один из активнейших металлов, при повышенной температуре реагирует с простыми веществами:
Цинк вытесняет водород из кислот:
Гидроксид цинка амфотерен, т. е. проявляет свойства и кислоты, и основания. При постепенном приливании раствора щелочи к раствору соли цинка выпавший вначале осадок растворяется (то же происходит и с алюминием):
Химические свойства хрома
На примере хрома ($Cr$) можно показать, что свойства переходных элементов меняются вдоль периода не принципиально: происходит количественное изменение, связанное с изменением числа электронов на валентных орбиталях. Максимальная степень окисления хрома $+6$. Металл в ряду активности стоит левее водорода и вытесняет его из кислот:
При добавлении раствора щелочи к такому раствору образуется осадок $Me(OH)_2$, который быстро окисляется кислородом воздуха:
Ему соответствует амфотерный оксид $Cr_2O_3$. Оксид и гидроксид хрома (в высшей степени окисления) проявляют свойства кислотных оксидов и кислот соответственно. Соли хромовой кислоты ($H_2CrO_4$) в кислой среде превращаются в дихроматы — соли дихромовой кислоты ($H_2Cr_2O_7$). Окисление сопровождается изменением окраски, т.к. соли хроматы желтого цвета, а дихроматы — оранжевого.
Соединения хрома обладают высокой окислительной способностью.
Химические свойства железа
Железо ($Fe$) — элемент побочной подгруппы VIII группы и 4-го периода Периодической системы. Как и положено металлу $4$-го периода, атомы железа имеют четыре энергетических уровня, но заполняется у них не последний, а предпоследний, третий от ядра, уровень. Распределение электронов таково: $2e↖<->;8e↖<->;14e↖<->;2e↖<->$. Подобно всем металлам, атомы железа проявляют восстановительные свойства, отдавая при химических взаимодействиях не только два электрона с последнего уровня и приобретая степень окисления $+2$, но и электрон с предпоследнего уровня, при этом степень окисления повышается до $+3$.
Железо — металл со всеми характерными свойствами металлов: высокими тепло- и электропроводностью, ковкостью, металлическим блеском, высокой $t°_<пл>=1540°С$ и плотностью $ρ=7,85 г/<см^3>$. Железо образует сплавы с неметаллами (углеродом) и другими металлами. Железо может намагничиваться, оно обладает ферромагнетизмом. Для железа характерны два ряда соединений: соединения железа (II) и железа (III). Химические свойства железа и его соединений приведены в таблице. Железо входит в состав крови человека (гемоглобин), содержится оно и в некоторых растениях: шпинате, салате, капусте.
Роль железа в жизни человека общеизвестна, об этом можно не говорить. Железо — это основа всей современной цивилизации.
Железо и его соединения.
| Железо | Оксиды железа (II) и (III) | Гидроксиды железа (II) и (III) |
| 1. Серебристо-белый металл. 2. Взаимодействует с простыми веществами: а) горит в кислороде: $3Fe+2O_2=Fe_3O_4$ б) реагирует с хлором: $2Fe+3Cl_2=2FeCl_3$ в) взаимодействует с серой: $Fe+S=FeS$ 3. Реагирует с растворами кислот: $Fe+2H^<+>=Fe^<2+>+H_2↑$ 4. Вытесняет водород из воды при сильном нагревании: $Fe+H_2O=FeO+H_2↑$ 5. Окисляется в присутствии воды и кислорода воздуха (с образованием ржавчины): $4Fe+6H_2O+3O_2=4Fe(OH)_3$ 6. Замещает менее активный металл в растворе его соли: $Fe+Cu^<2+>=Fe^<2+>+Cu$ Получение Восстановление оксидов железа оксидом углерода (II), водородом или алюминием: $Fe_3O_4+4CO=3Fe+4CO_2$ $FeO+H_2=Fe+H_2O$ $Fe_2O_3+2Al=2Fe+Al_2O_3$ | 1. Проявляют основные свойства, взаимодействуя с кислотами: $FeO+2H^<+>=Fe^<2+>+H_2O$ $Fe_2O_3+6H^<+>=2Fe^<3+>+3H_2O$ 2. Оксид железа (III) проявляет слабые амфотерные свойства, взаимодействуя при нагревании с основными оксидами с образованием ферритов: $MnO+Fe_2O_3=Mn(FeO_2)_2$ | 1. Проявляют свойства нерастворимых в воде оснований: а) взаимодействуют с кислотами: $Fe(OH)_2+2H^<+>=Fe^<2+>+2H_2O$ $Fe(OH)_3+3H^<+>=Fe^<3+>+3H_2O$ б) разлагаются при нагревании: $Fe(OH)_2=FeO+H_2O$ $2Fe(OH)_3=Fe_2O_3+3H_2O$ 2. Гидроксид железа (III) проявляет слабые амфотерные свойства, реагируя с горячими концентрированными растворами щелочей: $Fe(OH)_3+NaOH=NaFeO_2+2H_2O$ 3. Гидроксид железа (II) на воздухе окисляется в гидроксид железа (III): $4Fe(OH)_2+O_2+2H_2O=4Fe(OH)_3$ 4. Соли железа (II) и (III) гидролизуются: $Fe^<2+>+H_2O⇄FeOH^<+>+H^<+>$; $Fe^<3+>+H_2O⇄FeOH^<2+>+H^<+>$ |
Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния.
Простые вещества — неметаллы.
В простых веществах атомы неметаллов связаны ковалентной неполярной связью. Благодаря этому формируется более устойчивая электронная система, чем у изолированных атомов. При этом образуются одинарные (например, в молекулах водорода $Н_2$, галогенов $F_2, Br_2, I_2$), двойные (например, в молекулах серы $S_2$), тройные (например, в молекулах азота $N_2$) ковалентные связи.
Как вам уже известно, простые вещества — неметаллы могут иметь:
- Молекулярное строение. При обычных условиях большинство таких веществ представляют собой газы ($H_2, N_2, O_2, F_2, Cl_2, O_3$) или твердые вещества ($I_2, P_4, S_8$), и лишь один-единственный бром ($Br_2$) является жидкостью. Все эти вещества имеют молекулярное строение, поэтому летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярного взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
- Атомное строение. Эти вещества образованы длинными цепями атомов ($Cn, Bn, Sin, Sen, Ten$). Из-за большой прочности ковалентных связей они, как правило, имеют высокую твердость, и любые изменения, связанные с разрушением ковалентной связи в их кристаллах (плавление, испарение), совершаются с большой затратой энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма мала.
Многие элементы-неметаллы образуют несколько простых веществ — аллотропных модификаций. Как вы помните, это свойство атомов называют аллотропией. Аллотропия может быть связана и с разным составом молекул ($О_2, О_3$), и с разным строением кристаллов. Аллотропными модификациями углерода являются графит, алмаз, карбин, фуллерен.
Элементы-неметаллы, обладающие свойством аллотропии, обозначены в схеме звездочкой. Так что простых веществ — неметаллов гораздо больше, чем химических элементов — металлов. Вы знаете, что для большинства металлов, за редким исключением (золото, медь и некоторые другие), характерна серебристо-белая окраска. А вот у простых веществ — неметаллов гамма цветов значительно разнообразнее: $P, Se_<аморф.>$ — желтые; $Bа_<морф.>$ — коричневый; $О_<2(ж)>$ — голубой; $Si, As_<мет.>$ — серые; $Р_4$ — бледно-желтый; $I_<1(г)>$ — фиолетово-черный с металлическим блеском; $Br_<2(ж)>$ — бурая жидкость; $Cl_<2(г)>$ — желто-зеленый; $F_<2(г)>$ — бледно-зеленый; $S_<8(т)>$ — желтая.
Несмотря на большие различия в физических свойствах неметаллов, все-таки нужно отметить и некоторые их общие черты. Все газообразные вещества, жидкий бром, а также типичные ковалентные кристаллы — диэлектрики, т.к. все внешние электроны их атомов использованы для образования химических связей. Кристаллы непластичны, и любая деформация вызывает разрушение ковалентных связей. Большинство неметаллов не имеют металлического блеска.
Общие химические свойства неметаллов.
Как мы уже отмечали, для атомов неметаллов, а следовательно, и для образованных ими простых веществ характерны как окислительные, так и восстановительные свойства.
Окислительные свойства простых веществ — неметаллов.
1. Окислительные свойства неметаллов проявляются, в первую очередь, при их взаимодействии с металлами (как вы знаете, металлы — всегда восстановители):
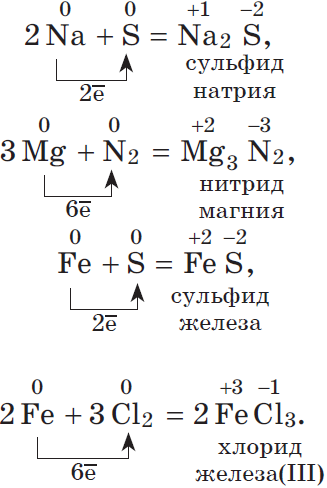
Окислительные свойства хлора $Cl_2$ выражены сильнее, чем у серы, поэтому и металл $Fe$, который имеет в соединениях устойчивые степени окисления $+2$ и $+3$, окисляется им до более высокой степени окисления.
2. Большинство неметаллов проявляют окислительные свойства при взаимодействии с водородом. В результате образуются летучие водородные соединения:
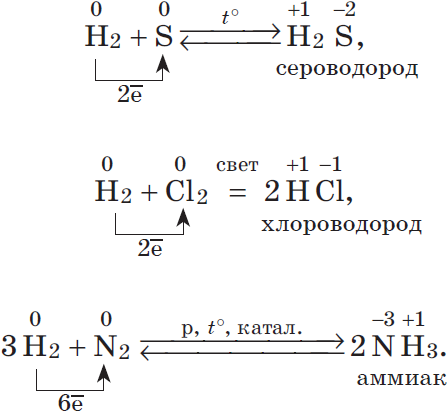
3. Любой неметалл выступает в роли окислителя в реакциях с теми неметаллами, которые имеют более низкое значение электроотрицательности:
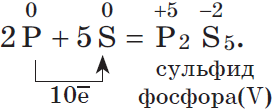
Электроотрицательность серы больше, чем у фосфора, поэтому она здесь проявляет окислительные свойства:
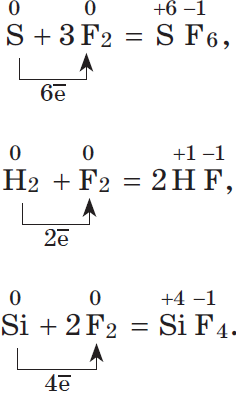
Электроотрицательность фтора больше, чем у всех остальных химических элементов, поэтому он проявляет свойства окислителя.
Фтор $F_2$ — самый сильный окислитель из неметаллов, проявляет в реакциях только окислительные свойства.
4. Окислительные свойства неметаллы проявляют и в реакциях с некоторыми сложными веществами.
Отметим, в первую очередь, окислительные свойства неметалла кислорода в реакциях со сложными веществами:
Не только кислород, но и другие неметаллы также могут быть окислителями в реакциях со сложными веществами — неорганическими (а, б) и органическими (в, г):
Сильный окислитель хлор $Cl_2$ окисляет хлорид железа (II) в хлорид железа (III);
Хлор $Cl_2$ как более сильный окислитель вытесняет иод $I_2$ в свободном виде из раствора иодида калия;
Галогенирование метана — характерная реакция для алканов;
Вы помните, конечно, качественную реакцию на непредельные соединения — обесцвечивание бромной воды.
Восстановительные свойства простых веществ — неметаллов. При рассмотрении реакций неметаллов друг с другом мы уже отмечали, что, в зависимости от значения их электроотрицательности, один из них проявляет свойства окислителя, а другой — свойства восстановителя.
1. По отношению ко фтору все неметаллы (даже кислород) проявляют восстановительные свойства.
2. Разумеется, неметаллы, кроме фтора, служат восстановителями при взаимодействии с кислородом:
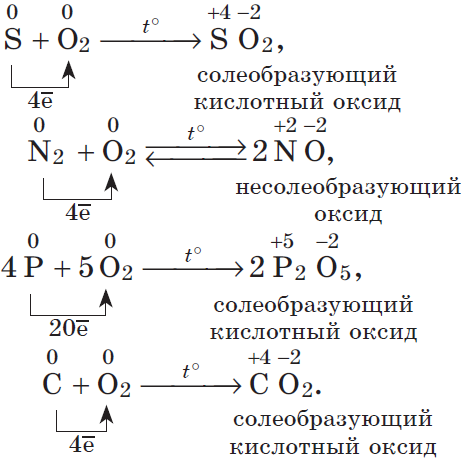
В результате реакций образуются оксиды неметаллов: несолеобразующие и солеобразующие кислотные. И хотя галогены непосредственно с кислородом не соединяются, известны их оксиды: $
↖<+4>
3. Многие неметаллы могут выступать в роли восстановителя в реакциях со сложными веществами — окислителями:
г)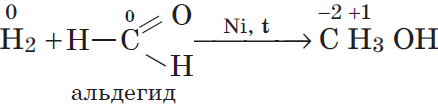
Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, и восстановителем. Это реакции самоокисления-самовосстановления (диспропорционирования):
Итак, подведем итоги. Большинство неметаллов могут выступать в химических реакциях как в роли окислителя, так и в роли восстановителя (восстановительные свойства не присущи только фтору $F_2$).
Водородные соединения неметаллов. Общим свойством всех неметаллов является образование летучих водородных соединений, в большинстве из которых неметалл имеет низшую степень окисления.
| Период | Группа | ||||
| III | IV | V | VI | VII | |
| $2$ | $ | $ | $ | $ | $ |
| $3$ | $ | $PH_3↙<фосфин>$ | $ | $ | |
| $4$ | $ | $ | $ | ||
| $5$ | $ | $↙<йодоводород>$ | |||
Среди приведенных формул веществ много таких, свойства, применение и получение которых вы изучали ранее: $CH_4, NH_3, H_2O, H_2S, HCl$.
Известно, что наиболее просто эти соединения можно получить непосредственно взаимодействием неметалла с водородом, т.е. синтезом:
$table 1.H_2+Cl_2=2HCl; 2.N_2+3H_2⇄2NH_3;>$ В промышленности так получают хлороводород и аммиак.
$table 3.C+2H_2=CH_4; 4.2H_2+O_2=2H_2O; 5.H_2+S⇄H_2S;>$ Синтезы метана, воды и сероводорода имеют в основном теоретическое значение.
Все водородные соединения неметаллов образованы ковалентными полярными связями, имеют молекулярное строение и при обычных условиях являются газами, кроме воды (жидкость).
Для водородных соединений неметаллов характерно различное отношение к воде. Метан и силан в ней практически нерастворимы. Аммиак при растворении в воде образует слабое основание — $NH_3·H_2O$.
При растворении в воде сероводорода, селеноводорода, теллуроводорода, а также галогеноводородов образуются кислоты с той же формулой, что и сами водородные соединения: $H_2S, H_2Se, H_2Te, HF, HCl, HBr, HI$.
Если сравнить кислотно-основные свойства водородных соединений, образованных неметаллами одного периода, например, второго ($NH_3, H_2O, HF$) или третьего ($PH_3, H_2S, HCl$), то можно сделать вывод о закономерном усилении их кислотных свойств и, соответственно, ослаблении основных. Это, очевидно, связано с тем, что увеличивается полярность связи Э—Н (где Э — неметалл).
Кислотно-основные свойства водородных соединений неметаллов одной подгруппы также отличаются. Например, в ряду галогеноводородов $HF, HCl, HBr, HI$ прочность связи Э—Н уменьшается, т. к. увеличивается длина связи. В растворах $HCl, HBr, HI$ диссоциируют практически полностью — это сильные кислоты, причем их сила увеличивается от $HF$ к $HI$. При этом $HF$ относится к слабым кислотам, что обусловлено еще одним фактором — межмолекулярным взаимодействием, образованием водородных связей $…Н—F…H—F…$. Атомы водорода связаны с атомами фтора $F$ не только своей молекулы, но еще и соседней.
Обобщая сравнительную характеристику кислотно-основных свойств водородных соединений неметаллов, сделаем вывод об усилении кислотных и ослаблении основных свойств этих веществ по периодам и главным подгруппам с увеличением атомных номеров образующих их элементов.
Кроме рассмотренных свойств, водородные соединения неметаллов в окислительно-восстановительных реакциях всегда проявляют свойства восстановителей, ведь в них неметалл имеет низшую степень окисления.
Химические свойства водорода.
В свободном состоянии водород существует в виде молекул $H_2$, атомы связаны в молекулу ковалентной неполярной связью.
Водород ($Н$) — самый легкий газ из всех газообразных веществ. Имеет самую высокую теплопроводность и самую низкую температуру кипения (после гелия). Малорастворим в воде. При температуре $–252,8°С$ и атмосферном давлении водород переходит в жидкое состояние.
1. Молекула водорода очень прочная, что делает ее малоактивной:
2. При обычных температурах водород вступает в реакцию с активными металлами:
образуя гидрид кальция, и с $F_2$, образуя фтороводород:
3. При высоких температурах получают аммиак:
и гидрид титана (металл в порошке):
4. При поджигании водород реагирует с кислородом:
5. Водород обладает восстановительной способностью:
Химические свойства галогенов: хлор, бром, йод.
У галогенов наиболее ярко выражены свойства неметаллов.
Внешний энергетический уровень у атомов галогенов содержит семь электронов, что соответствует номеру группы Периодической системы — VII. Два электрона занимают s-орбиталь, пять — $p$-орбитали. Для элементов этой группы при увеличении числа заполненных электронами уровней размер атомов возрастает, а прочность связи с ядром снижается.
Молекулы галогенов двухатомные ($Cl_2, Br_2, I_2$). Галогены — вещества молекулярного строения. Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы этих веществ. Хлор — газ желто-зеленого цвета, бром — красно-коричневая жидкость, йод — твердое вещество серо-фиолетового цвета. Водные растворы галогенов в воде называют хлорной, бромной и йодной водой.
1. Галогены — сильные окислители. Они окисляют простые и сложные вещества:
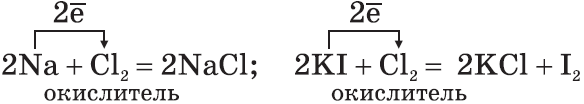
2. По окислительной активности каждый вышестоящий в Периодической таблице галоген является более сильным по отношению к нижестоящему. Поэтому каждый галоген вытесняет любой нижестоящий из его соединений:
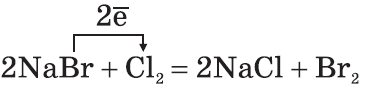
3. Галогены активно реагируют с неметаллами:
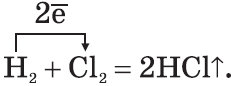 На свету взрывается.
На свету взрывается.
4. Галогены реагируют с водой, образуя атомарный кислород:
5. Галогены очень активны в присутствии воды. Так, сухой хлор хранят в железных баллонах, а во влажном хлоре железо быстро ржавеет (совместное действие с водой продуктов реакции — кислоты и атомарного кислорода).
Водный раствор хлороводорода $HCl$ называют соляной, или хлороводородной, кислотой. Ей присущи все свойства кислот. Соляная кислота принимает участие в пищеварении живых организмов. В огромных масштабах соляная кислота используется во многих отраслях промышленности: химической, нефтедобывающей и нефтеперерабатывающей.
Химические свойства кислорода.
Кислород ($O$) — самый распространенный элемент на Земле. Он находится в атмосфере ($21%$ по объему), в земной коре ($92%$), в гидросфере ($89%$).
Кислород находится в VI группе Периодической системы, в главной подгруппе. Кислород проявляет во всех соединениях валентность II. Это низшая валентность из шести возможных в этой группе.
Кислород образует молекулы O2. Это газ без запаха, цвета и вкуса. Плотность кислорода при $0°С$ и давлении $1$ атм. $1,43$ г/л, что в $1,11$ раза больше плотности воздуха. Кислород малорастворим в воде. При $20°С$ и атмосферном давлении в $100$ объемах воды растворяется $3$ объема $O_2$. Температура кипения кислорода равна $–183°С$; при этой температуре и давлении $1$ атм. кислород превращается в жидкость голубого цвета.
Кислород является одним из самых активных веществ, легко вступающих в химические реакции.
Взаимодействие веществ с кислородом называется реакцией окисления этих веществ. Кислород принимает участие в таких окислительных процессах: горение, дыхание, ржавление металлов, гниение растительных и животных останков.
Реакции окисления, сопровождающиеся выделением теплоты и света, называются реакциями горения:
а) горение простых веществ:
$C+O_2=CO_2; S+O_2=SO_2; 4P+5O_2=2P_2O_5;$
$3Fe+2O_2=Fe_3O_4$, или $FeO·Fe_2O_3$.
Эти процессы горения происходят быстро. Возможно и медленное горение — окисление:
б) горение сложных веществ:
У кислорода есть аллотропная модификация — озон $O_3$. Он образуется под воздействием солнечного излучения или электрического разряда:
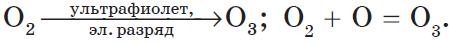
Озон обладает запахом свежести. Разный состав молекул кислорода и озона определяет их разные свойства. Молекула озона очень непрочная, легко вступает в химические реакции. Озон проявляет сильные окислительные свойства, разрушает органические вещества (резину), окисляет металлы ($Au, Pt, Ag$):
Химические свойства серы.
Атомы серы, как и атомы кислорода, имеют на внешнем энергетическом уровне $6
Сера ($S$) — твердое кристаллическое вещество желтого цвета, имеет молекулярную кристаллическую решетку, легко плавится, в воде нерастворима. Для серы характерна аллотропия. Ромбическая сера $S_8$ — стабильная модификация. Образует кристаллы октаэдрической формы лимонно-желтого цвета с $t°_<пл>=112,8°С$. Моноклинная сера имеет игольчатые кристаллы с $t°_<пл>=119,3°С$, легко переходит в ромбическую. Пластическая сера имеет линейное строение молекул, темно-коричневый цвет. Ее получают при выливании расплавленной при $160°С$ серы в холодную воду — образуется резиноподобная темно-коричневая масса.
В таблице обобщены химические свойства серы и ее соединений.
Сера и ее соединения.
| Сера | Соединения серы | |
| Оксиды серы | Серная кислота | |
| 1. При обычных условиях — твердое желтое кристаллическое вещество. 2. Горит в кислороде: $S+O_2=SO_2$ (проявляет восстановительные свойства). 3. Взаимодействует с металлами и водородом: $Fe+S=FeS$ $H_2+S=H_2S$ (проявляет окислительные свойства) В природе самородная сера $S$, сульфиды: $FeS_2$ (пирит), $CuS$; сульфаты: $CaSO_4·2H_2O$ (гипс), $Na_2SO_4$ | 1. При обычных условиях $SO_2$ — газ, $SO_3$ — жидкое вещество ($t°_<пл>=16,8°С$). 2. Проявляют свойства кислотных оксидов, взаимодействуя: — с водой: $SO_2+H_2O⇄H_2SO_3$ $SO_3+H_2O=H_2SO_4$ — со щелочами: $SO_2+2NaOH=Na_2SO_3+H_2O$ $SO_3+2NaOH=Na_2SO_4+H_2O$ — с основными оксидами: $SO_3+CaO=CaSO_4$ Получение: 1) оксида серы (IV) а) в промышленности: — горение серы $S+O_2=SO_2$ — обжиг пирита $4FeS_2+11O_2=2Fe_2O_3+8SO_2$ б) в лаборатории: $Na_2SO_3+H_2SO_4=Na_2SO_4+SO_2↑+H_2O$; 2) оксида серы (VI) в промышленности — каталитическое окисление оксида серы (IV): $2SO_2+O_2=2SO_3$ | 1. При обычных условиях — бесцветная тяжелая жидкость ($ρ≈2 г/см^3$), неограниченно растворимая в воде. 2. Сильная двухосновная кислота: $H_2SO_4=H^<+>+HSO_4^<->⇄2H^<+>+SO_4^<2->$ 3. Взаимодействует с металлами: $Zn+H_2SO_4=ZnSO_4+H_2↑$ В концентрированной кислоте пассивируются $Al$ и $Fe$. 4. Взаимодействует со щелочами, основаниями и амфотерными гидроксидами: $H_2SO_4+2NaOH=Na_2SO_4+2H_2O$ $H_2SO_4+Cа(OH)_2=CаSO_4+2H_2O$ $3H_2SO_4+2Al(OH)_3=Al_2(SO_4)_3+6H_2O$ 5. Взаимодействует с основными и амфотерными оксидами: $H_2SO_4+CuO=CuSO_4+H_2O$ $H_2SO_4+ZnO=ZnSO_4+H_2O$ 6. Концентрированная кислота гигроскопична:  Получение в промышленности в соответствии со схемой: $FeS_2(или S)<→>↖ |
Химические свойства азота.
Азот ($N$) — первый представитель главной подгруппы V группы Периодической системы. Его атомы содержат на внешнем энергетическом уровне пять электронов, из которых три — неспаренные. Значит, атомы азота могут присоединять три электрона, завершая внешний энергетический уровень, и вследствие этого приобретают степени окисления $–3$ в соединениях с водородом (аммиак $NH_3$) и с металлами (нитриды $Li_3N, Mg_3N_2$).
Отдавая свои внешние электроны более электроотрицательным элементам (фтору, кислороду), атомы азота приобретают степени окисления $+3$ и $+5$. Атомы азота проявляют восстановительные свойства в степенях окисления $+1, +2, +4$.
Азот существует в свободном состоянии в виде молекулы $N_2$, атомы связаны прочной ковалентной связью $N≡N$. Азот — бесцветный газ без запаха и вкуса, в атмосфере его содержится $78%$. Азот — составная часть живых организмов.
Важнейшими соединениями азота являются аммиак, азотная кислота и ее соли. Азотная кислота и аммиак производятся в промышленности в больших объемах, т.к. соли ($NH_4NO_3, KNO_3$) являются удобрениями. Азотная кислота используется для получения красителей, пластмасс, взрывчатых веществ, лекарств.
Азот — жизненно важный элемент, поэтому круговорот азота в природе обеспечивает им атмосферу, почву, растительные и живые организмы.
Источник http://ru.solverbook.com/spravochnik/ximiya/9-klass/ximicheskie-svojstva-metallov/
Источник https://himia.my-dict.ru/q/1765333_kakoj-iz-perecislennyh-metallov-legce-vsego/
Источник https://examer.ru/oge_po_himii/teoriya/himicheskie_svojstva_prostyh_veshhestv