Интересные факты про углерод – Интересные факты об углероде | Интересные факты
Углерод — химический элемент, занимающий шестое место в таблице Менделеева. На сегодняшний день нам известно более сотни химических элементов, и атомы всех элементов имеют похожее строение — положительно заряженное ядро, вокруг которого движутся электроны. Разница между элементами лишь в числе протонов в ядре атома. Тем не менее, почему-то именно углерод, имеющий в ядре атома шесть протонов, оказался самым важным и интересным по своим свойствам среди всех химических элементов. Интересные факты об углероде — в этом посте.
1) Углерод — основа жизни. Все органические вещества, составляющие основу тканей живых организмов, имеют в своём составе углерод. Именно благодаря уникальной способности атомов углерода соединяться в длинные цепочки в природе существуют очень большие и сложные, а также разнообразные по своим свойствам молекулы, из которых состоят живые организмы. Крупные органические молекулы (такие, как ДНК) могут содержать десятки и даже сотни миллионов атомов.
Число известных соединений углерода приближается к десяти миллионам, это в несколько раз больше, чем число соединений всех остальных элементов, вместе взятых. Не удивительно, что современная химия делится на 2 раздела, и один из них — органическая химия — изучает только соединения углерода, тогда как второй — неорганическая химия — всё остальное.
2) У углерода больше всего аллотропных видоизменений. Невероятно, но даже если взять чистый углерод, из него можно получить массу совершенно разных веществ. Ещё со школы большинство помнит о двух аллотропных модификациях углерода — графите и алмазе. И тот и другой состоят только из углерода, но благодаря различному расположению атомов имеют совершенно разные свойства. На самом деле аллотропных модификаций углерода много, и почти все обладают уникальными свойствами.
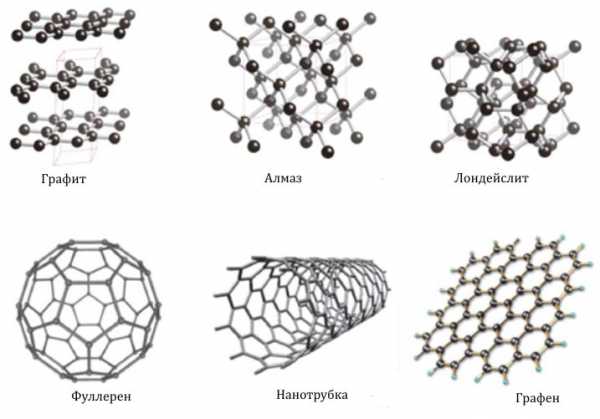
Некоторые из аллотропных модификаций углерода
Углеродные нанотрубки в десятки раз прочнее и в 6 раз легче стали, фуллерит в полтора раза твёрже алмаза, графен выдерживает чуть ли не в миллион раз более сильный электрический ток, чем медь, и на его основе можно делать сверхмалые транизисторы и другие элементы электронных схем.
А недавно из графена и углеродных нанотрубок китайские учёные смогли изготовить уникальный аэрогель, который, являясь твёрдым и прочным материалом, в несколько раз легче воздуха. Он способен растягиваться и сжиматься, не разрушаясь, а также может впитать жидкости в 900 раз больше собственной массы.

 Кирпич массой 2,5 кг на кусочке аэрогеля массой 2 грамма.
Кирпич массой 2,5 кг на кусочке аэрогеля массой 2 грамма.
3) Углерод — очень тугоплавкое вещество. Это самое тугоплавкое из простых веществ. Температура плавления углерода около 3700 градусов Цельсия (у вольфрама, из которого делают нити накала электрических лампочек, всего 3400). Большую температуру плавления имеют лишь соединения углерода. У сплава карбидов гафния и тантала температура плавления превышает 4200 градусов Цельсия.
4) Радиоуглеродный анализ. Под воздействием космических лучей из атмосферного азота каждый год образуется около 7,5 кг. радиоактивного изотопа углерода-14. Несмотря на столь малое количество радиоактивный углерод попадает из атмосферы в живые организмы, а после их смерти начинает постепенно распадаться. Это явление дало возможность довольно точно датировать останки ископаемых животных и растений и восстановить примерную картину эволюции жизни на Земле.
5) Углерод — компонент стали. Все мы знаем, какую роль сыграло железо в развитии цивилизации. Но чистое железо — очень пластичный и мягкий материал. Твёрдость железу придаёт углерод, который поступает в расплавленное железо при выплавке его из железной руды. При сплаве железа с углеродом получается сталь. В зависимости от процентного содержания углерода получаются стали с различными свойствами, подходящие для различных целей.
Похожие записи
Самые интересные факты о Углероде
Углерод — это невероятный элемент. Расположить атомы углерода в одну сторону, и они становятся мягкими, податливее графита.
Переустановите расположение, и — престо! — атомы образуют алмаз, один из самых твердых материалов в мире.
Углерод также является ключевым компонентом для большей части жизни на Земле; пигмент, который сделал первые рисунки; и основой для технологических чудес, таких как графен, который является материалом, более сильным, чем сталь, и более гибким, чем резина. [См. Периодическую таблицу элементов].
Углерод встречается в природе как углерод-12, что составляет почти 99% углерода во Вселенной; углерод-13, что составляет около 1%, а углерода-14, что составляет незначительную сумму от общего углерода, а это очень важно в знакомствах органических объектов.

Свойства углерода
Углерод является уникальным по своим свойствам, поскольку он образует ряд компонентов выше, чем общее добавление всех других элементов в сочетании друг с другом.
Физические и химические свойства углерода зависят от кристаллической структуры элемента.
- Атомный номер (число протонов в ядре): 6
- Атомный символ (на периодической таблице элементов): с
- Атомная масса (средняя масса атома): 12.0107
- Плотность: 2.2670 граммов на кубический сантиметр
- Фазы при комнатной температуре: Твердый
- Точка плавления: 6,422 градусов по Фаренгейту (3,550 градусов C)
- Точка кипения: 6,872 Ф (3,800 с) (сублимации)
- Количество изотопов: 15 общий; двух стабильных изотопов, в которых расположены атомы одного элемента с разным количеством нейтронов.
- Наиболее распространенных изотопов: углерода-12 (6 протонов, 6 нейтронов и 6 электронов) и углерода-13 (6 протонов, 7 нейтронов и 6 электронов)
- Радиус Vanderwaals 0.091 нм
- Ионный радиус 0.26 нм (-4) ; 0,015 нм (+4)
- Изотопы 3
- Электронные оболочки [ Он ] с 2S 2 2Р 2
- Энергия первой ионизации 1086.1 кДж.моль -1
- Энергия второй ионизации 2351.9 кДж.моль -1
- Энергия третьего ионизации 4618.8 кДж.моль -1
Углерод: от звезд к жизни
Согласно шестому по численности числу элементов во Вселенной, углерод образуется в внутри звезд в реакции, называемой тройным альфа-процессом, согласно Центру астрофизики.
В старых звездах, которые сжигали большую часть своего водорода, сохраняется оставшийся гелий. Каждое ядро гелия имеет два протона и два нейтрона. При очень высоких температурах — более 100 000 000 Кельв. (179,999,540,6 F) — ядра гелия начинают сливаться, сначала как пары в неустойчивые 4-протонные бериллиевые ядра, а в конечном итоге, по мере того, как появляются достаточное количество ядер бериллий, в бериллий и гелий. Конечный результат: атомы с шестью протонами и шестью нейтронами — углеродом.
Углерод — производитель шаблонов. Он может связываться с самим собой, образуя длинные упругие цепи, называемые полимерами. Он может также связываться с четырьмя другими атомами из-за его расположения электронов. Атомы расположены как ядро, окруженное электронным облаком, причем электроны движутся вокруг на разных расстояниях от ядра. Согласно данным Университета Калифорнии Дэвис, химики понимают эти расстояния как оболочки и определяют свойства атомов по тому, что находится в каждой оболочке.
У углерода есть две электронные оболочки, первая из которых содержит два электрона, а вторая — четыре из возможных восьми пространств. Когда атомы связаны, они делят электроны в их внешней оболочке. Углерод имеет четыре пустых пространства в своей внешней оболочке, что позволяет ему связываться с четырьмя другими атомами. (Он также может стабильно связываться с меньшим числом атомов путем образования двойных и тройных связей).
Другими словами, у углерода есть варианты. И он их использует: было обнаружено около 10 миллионов углеродных соединений, и ученые считают, что углерод является краеугольным камнем для 95 процентов известных соединений. Невероятная способность углерода связываться со многими другими элементами является основной причиной того, что это имеет решающее значение почти для всей жизни.
Углерод в организмах
Открытие углерода уходит в историю. Элемент был известен доисторическим людям в форме древесного угля. По словам Всемирной ассоциации угля, углерод как уголь по-прежнему является основным источником топлива во всем мире, обеспечивая около 30 процентов энергии во всем мире. Уголь также является ключевым компонентом в производстве стали, а графит, еще одна форма углерода, является обычной промышленной смазкой.
Углерод-14 представляет собой радиоактивный изотоп углерода, используемый археологами для современных организмов и останков. Углерод-14 естественным образом встречается в атмосфере. По словам Университета штата Колорадо, растения принимают его в дыхании, в котором они превращают сахара, полученные во время фотосинтеза, в энергию, которую они используют для роста и поддержания других процессов. Живые организмы включают углерод-14 в свои тела, употребляя в пищу растения или других животных, питающихся растениями. По данным Университета Аризоны, углерод-14 имеет период полураспада 5730 лет, а это означает, что после этого времени половина углерода-14 в образце распадается.
Поскольку организмы перестают принимать углерод-14 после смерти, ученые могут использовать период полураспада углерода-14 как своего рода часы, чтобы измерить, сколько времени прошло с момента смерти организма. Этот метод работает на некогда живых организмах, включая предметы из дерева или другого растительного материала.
Интересные факты о Углероде
Углерод получает свое название от латинского слова carbo, что означает уголь.
- Бриллианты и графит являются одними из самых твердых и самых мягких природных материалов, известных, соответственно. Единственная разница между ними — их кристаллическая структура.
- Согласно Энциклопедии Земли, углерод составляет 0,032 процента земной литосферы (коры и внешней мантии). Грубая оценка веса литосферы геологом Университета Ла Сальла Дэвидом Смитом составляет 300 000 000 000 000 000 000 000 (или 3 * 10 ^ 23) фунтов, что делает приблизительный вес углерода в литосфере 10 560 000 000 000 000 000 000 000 (или 1.056 * 10 ^ 22) фунтов.
- Двуокись углерода (атом углерода плюс два атома кислорода) составляет около 0,04 процента земной атмосферы, согласно Национальному управлению океанических и атмосферных исследований (NOAA) — увеличение по сравнению с доиндустриальными временами из-за сжигания ископаемого топлива.
- Окись углерода (атом углерода плюс один атом кислорода) является запахом газа, образующегося при сжигании ископаемого топлива. Угарный газ убивает путем связывания с гемоглобином, кислородсодержащим соединением в крови. Углекислый газ связывается с гемоглобином в 210 раз сильнее, чем кислород, связывается с гемоглобином, эффективно вытесняя кислород.
- Алмаз, самая яркая версия углерода, формируется под большим давлением глубоко в земной коре. Самый крупный алмаз из драгоценного камня, который когда-либо был найден, был алмазом Cullinan, который был обнаружен в 1905 году. Необработанный алмаз составлял 3 106,75 карата. Самый большой камень, вырезанный из алмаза, на 530,2 карата, является одним из Королевских Драгоценностей Соединенного Королевства и известен как Великая Звезда Африки.
- Согласно данным исследования 2009 года в журнале «Археологическая наука», татуировки Ötzi the Iceman, трупов которым 5300 лет, найденные в Альпах, были сделаны из углерода. Были сделаны небольшие разрезы на коже, уголь втирался, возможно, как часть лечения иглоукалыванием.
Новые молекулы углерода
Молекулы углерода — это давно изученный элемент, но это не значит, что его больше не найти. Фактически, тот же элемент, который наши доисторические предки жгли как древесный уголь, может стать ключом к технологическим материалам следующего поколения.
В 1985 году Рик Смалли и Роберт Керл из Университета Райса в Техасе и их коллеги обнаружили новую форму углерода. По словам Американского химического общества, испарив графит с помощью лазеров, ученые создали таинственную новую молекулу из чистого углерода. Эта молекула оказалась сферой шара, состоящей из 60 атомов углерода. Новая молекула углерода теперь более известна как «buckyball». Исследователи, которые её обнаружили, выиграли Нобелевскую премию по химии в 1996 году. Было установлено, что бакиболы препятствуют распространению ВИЧ, согласно исследованию, опубликованному в 2009 году в Журнале химической информации и моделирования; медицинские исследователи работают над прикреплением лекарств, молекулы к молекулам, к бакиболам, чтобы доставлять лекарства непосредственно на участки инфекции или опухоли в организме; это включает исследования Колумбийского университета.
С тех пор были обнаружены другие новые чистые молекулы углерода — фуллерены, в том числе эллиптические и углеродные нанотрубки с удивительными проводящими свойствами. Углеродная химия все еще достаточно горячая. Исследователи из Японии и США занимаются выяснением того, как связывать атомы углерода вместе с использованием атомов палладия, что позволяет производить сложные новые молекулы углерода.
Что такое Графен
 Графен
Графен
Говоря простым языком, графен, представляет собой тонкий слой чистого углерода; это отдельный, плотно уложенный слой атомов углерода, которые скреплены вместе в гексагональной гексагональной решетке. В более сложных условиях, это аллотроп углерода в структуре самолет из SP2 атомами с в молекуле длина связи 0.142 нм. Слоев графена, сложенных на вершине друг друга, образуют графит, с межплоскостным расстоянием 0.335 нм.
Это тончайшее соединение, известное человеку, в один атом толщиной, легкий материал известен (с 1 кв. м идет около 0.77 миллиграмм), сильнейший обнаруженное соединение (от 100 до 300 раз прочнее стали и с прочностью на жесткость 150,000,000 пс), лучшим проводником тепла, при комнатной температуре (в (4.84±0.44) × 10^3 к (5.30±0.48) × 10^3 Вт·м−1·К−1) а также лучший проводник электричества (исследования показали, подвижность электронов при значениях более 15 000 см2·в−1·с−1). Другие известные свойства графена его уникальные уровни поглощения света в πα ≈ 2.3% белого света, и его потенциальную пригодность для использования в спиновой транспорт.
Имея это в виду, вы могли быть удивлены знать, что углерод является вторым наиболее распространенным материалом в организме человека и четвертый по распространенности элемент во Вселенной (по массе), после водорода, гелия и кислорода. Это делает углерод химической основой для всех известных форм жизни на земле, поэтому графен вполне может быть экологически чистым, устойчивым решением для почти безграничного количества приложений. С момента открытия (или, точнее, механического получения) графена, достижения в рамках разных научных дисциплин взорвались, с огромными достижениями, особенно в области электроники и биотехнологии.
Углеродные нанотрубки
Углеродная нанотрубка (УНТ) представляет собой крохотную, соломенно-подобную структуру, состоящую из атомов углерода. Эти трубки чрезвычайно полезны в широком спектре электронных, магнитных и механических технологий. Диаметры этих трубок настолько малы, что они измеряются в нанометрах. Нанометр составляет одну миллиардную часть метра — примерно в 10 000 раз меньше человеческого волоса.
 Углеродные нанотрубки
Углеродные нанотрубки
Углеродные нанотрубки по меньшей мере в 100 раз прочнее стали, но только на одну шестую, как тяжелые, поэтому они могут добавлять силу практически к любому материалу. Они также лучше, чем медь при проведении электричества и тепла.
Нанотехнологии применяются чтобы превратить морскую воду в питьевую. В новом исследовании ученые из Национальной лаборатории Лоуренса Ливермора (LLNL) разработали процесс углеродных нанотрубок, который может вывести соль из морской воды гораздо эффективнее традиционных технологий.
В исследовании нанотрубок ученые подражали тому, как структурированы биологические мембраны: по существу матрица с порами внутри мембраны. Они использовали особенно мелкие нанотрубки — более чем в 50 000 раз тоньше человеческого волоса. Эти крошечные нанотрубки обеспечивают очень высокий поток воды, но настолько узкий, что через трубку может проходить только одна молекула воды. И самое главное, солевые ионы слишком велики, чтобы вписаться в трубку.
Исследователи считают, что новое открытие имеет важные последствия для следующего поколения как процессов очистки воды, так и технологий с высоким потоком мембран.
Источник: Территория знаний
Жмите кнопку «Поделиться» в соцсетях, чтобы не потерять информацию
Познавательные факты об углероде. Интересно знать
Углерод — это химический элемент, который существует во множестве форм, или так называемых аллотропных модификаций. Эти простые вещества одного и того же элемента имеют самые разнообразные свойства и различное строение, например, древесный уголь, графит или драгоценный алмаз. Больше познавательного об этом элементе расскажут факты об углероде.
- Еще в глубокой древности применяли способность углерода восстанавливать металлы из руд и «известей» и использовали этот элемент для выплавки металлов.
- Впервые углерод был признан элементарным веществом благодаря химику и естествоиспытателю Антуану Лавуазье. В конце XVIII века углерод (carbone) и получил такое название, хотя до этого его называли «чистым углем».
- Свободный углерод первым получил английский химик Смитсон Теннант в 1791 году. В результате своего эксперимента он пропустил пары фосфора над прокаленным мелом и получил фосфат кальция и углерод.
- Как уже упоминалось, углерод может существовать в нескольких формах, и одна из них — алмаз. К тому, что алмазы являются кристаллическим углеродом, первым пришел тот же Лавуазье, поставив опыт по сжиганию алмаза с помощью большой зажигательной машины. В то же время о том, что алмазы при сильном нагреве сгорают без следа, было известно давно. Например, в высшем свете в середине XVIII века был весьма популярен опыт по сжиганию алмазов.
- Другая форма свободного углерода, встречающая в природе, как и алмаз, — это графит. Когда-то алхимики считали его видоизмененным свинцом, но в 1740 году обнаружилось, что в графите нет каких-либо примесей свинца. В 1779 году графит считали особой минеральной формой угля, а через 20 лет был поставлен опыт по нагреванию алмаза, который превратился в графит, а после — в угольную кислоту.
- Углерод при определенном внешнем давлении может переходить в жидкую форму, в форме карбина углерод представляет собой мелкокристаллический черный порошок, а в соединении водородом, например, углерод имеет форму газа (метан).
- Графит переходит в форму алмаза при температуре 3000 К (ок. 2726,85 ºC) и давлении 11-12 ГПа.
- В парообразном состоянии и в форме разных соединений с водородом и азотом углерод есть в атмосфере Солнца, планет, а также был найден в железных и каменных метеоритах.
- Животные и растения примерно на 17% состоят из углерода, в организм человека этот элемент в объеме около 300 г в сутки поступает с пищей. Тело человека также содержит углерод, например, этот элемент составляет 2/3 массы мышечной ткани и 1/3 массы костей.
- Углерод, попадая в окружающую среду в виде сажи в составе выхлопных газов, при сжигании угля и других промышленных работах, может изменять региональный климат, а также негативно влияет на здоровье людей, в особенности на верхние дыхательные пути и легкие. Токсич
Углерод интересные факты — Знаешь как
ПОМОЩНИК МЕТАЛЛУРГА. Углерод— не металл. Но по некоторым характеристикам, в частности по теплопроводности и электропроводности, графит весьма «металлоподобен». Углерод — не металл, и тем не менее это один из важнейших для металлургии элементов. Именно благодаря ему совершенно непригодное в качестве конструкционного материала мягкое, слабое железо становится чугуном или сталью. В последние десятилетия получили распространение таки называемой графитизированные стали, в структуре которых есть свободные микрокристаллы графита. В основном эти стали идут на производство инструмента, коленчатых валов, штампов в поршней, потому что им свойственна большая, чем у иных нелегированных сталей , прочность и твёрдость .
Как восстановитель углерод применяют не только в производстве чугуна , но и цветных металлов Практически в роли восстановителя выступает кокс, в котором углерода 97—98%. А вот древесный уголь — первый, видимо, восстановитель в черной металлурги — в цветной металлургии вашего времени выступает в ином качество. Из него делают так называемый покровный слой, предохраняющий расплавленный металл от окисления.
Не обходится без углерода и производство алюминия — металл нарастает на графитовом катоде.
А в доменном процессе обычно участвует не только элементный углерод (в виде коксе), но и одно ив соединений элемента № 6. Обыкновенные плотные известняки применяют в качестве флюсов при выплавке чугуна из железных руд, содержащих в качестве пустой породы кремнезем и глинозем.
ПОКА ЕЩЕ ОСНОВА. Уголь, нефть, горючие сланцы, торф, при родным газ — материальная основа теплоэнергетики прошлого, настоящего и ближайшего будущего. Потому что, как ни радужны перспективы атомной энергетики, еще довольно много лет атом будет ходить в подсобных. Пока его доля в производстве электроэнергии сравнительно мала. Со временем роли, видимо, перемежится. Тогда «подсобниками» станут нынешние гегемоны— природные топлива на углеродной основе. И, видимо, придет время, когда горючие ископаемые будут целиком идти на химическую переработку. Пока же большая часть их отправляется в топки и двигатели, которые по существу тоже топки.
СИНТЕЗ АЛМАЗА. В декабре 1954 г. американская фирма «Дженерал электрик» сообщила, что сотрудники этой фирмы Холл, Банди и другие получили искусственные алмазы в виде мелких треугольных пластин. Процесс синтеза вели под давлением порядка 100 тыс. атм. и при температуре 2600°С. Катализатором был тантал, а если говорить точнее, то алмаз из графита получали на тонкой пленке карбида тантала, образовывавшейся в ходе алмазного синтеза.
Впрочем, еще раньше, в феврале 1953 г., первые искусственные алмазы получила группа Эрика Гуннара Лундблада (Швеция), но шведские ученые не торопились с публикацией результатов своих .
С тех пор, с середины 50-х годов XX в., успешные работы по промышленному синтезу алмазов ведутся в ряде стран. В нашей стране эту работу возглавляли В. Н, Бакуль и академик Л. Ф. Верещагин. Известно, например, что в середине 70-х годов Горьковский автомобильный завод расходовал в год до 400 тыс. каратов искусственных алмазов. Один завод — 80 кг алмазов! Примерно столько же «тратил» их Сестрорецкпй инструментальный завод и некоторые другие предприятия.
В мире уже производятся и синтетические алмазы ювелирного качества; обходятся они намного дороже природных.
Промышленный синтез алмазов — большое достижение науки и техники. Ученые шли к нему многие десятилетия. Большинство попыток, предпринимавшихся в прошлом, заканчивались неудачей. Но были и проблески. О двух из них и о синтезе алмаза в метеоритном веществе рассказывают следующие заметки.
МЕТЕОРИТ… СЪЕЛИ. Немаловажной вехой в осознании возможности образования алмазов вне земной коры послужило обнаружение алмазных крупинок в метеорите, упавшем 10 (по старому стилю) сентября 1886 г. возле деревни Новый Урей Краснослободского уеада Пензенской губернии .
Крупинки алмаза были обнаружены в метеоритном веществе преподавателями Петербургского лесного института доцентом-минералогом Михаилом Васильевичем Ерофеевым и профессором химии Павлом Александровичем Лачиновым (известен больше всего работами по холестерину, которыми занимался в последние годы жизни).
Осколки метеорита «Новый Урей» были присланы в Петербург бывшим студентом Лесного института учителем Павлом Ивановичем Барышниковым.
Приводим выдержки из его письма директору Лесного института: «…Рано поутру несколько новоурейских крестьян верстах в трех от деревни пахали свое поле… Вдруг совершенно неожиданно сильный свет озарил всю окрестность; затем черев несколько секунд раздался страшный треск, подобный пушечному выстрелу или взрыву, за ним второй, более сильный. Вместе с шумом в нескольких саженях от крестьян упал на землю огненный шар; вслед за этим шаром невдалеке над лесом опустился другой, значительно больше первого. Все явление продолжалось не более минуты.
Обезумевшие от страха крестьяне не знали, что делать, они попадали на землю и долго не решались сдвинуться с места… Наконец один из них, несколько ободрившись, отправился к тому месту… и, к удивлению своему, нашел неглубокую яму; в середине ее, углубившись до половины в землю, лежал очень горячий камень черного цвета. Тяжесть камня поразила крестьян….
Затем они отправились к лесу разыскать второй, больший камень, но все усилия их были напрасны: лес в этом месте представляет много болот и топей, и найти аэролита им не удалось: по всей вероятности, он упал в воду.
На следующий день один из крестьян того же Урейского выселка отправился на свое поле посмотреть копны гречихи. Здесь совершенно случайно им найден был такой же точно камень, какой принесли накануне его соседи. Камень тоже образовал вокруг себя ямку; часть камня была в земле… Дальнейшие поиски крестьян в окрестностях Нового Урея не привели ни к чему. Следовательно, выпало всего три куска. Самый большой из них упал, без сомнения, в лесу в болото; второй по величине, упавший при крестьянах на пашне, приобретен мною и отослан Вам для минералогического кабинета института и, наконец, третий, найденный крестьянином в гречихе, съеден…
Крупинки аэролита считались положительно универсальным лекарством. Распространились нелепые слухи о «чудесном исцелении», требования на «христов камень» усилились; счастливый владелец метеорита пользовался случаем и продавал камешек чуть не на вес золота, выказывая при этом слабости настоящего завзятого аптекаря. Прием «христова камня» производился таким образом: пациент, купивши ничтожный кусочек метеорита , толок и растирал его в порошок и затем, смешав с водой, благоговейно выпивал, творя молитву и крестное знамение…»
За открытие алмазов в метеорите Российская Академия наук присудила Ерофееву и Лачинову Ломоносовскую премию. А каких-либо следов того, что хоть кто-нибудь обратил внимание па беспросветную темноту крестьян, история не сохранила.
Небесное тело (вернее, часть его), присланное Барышниковым в институт, весило 1762,3 г; позже были получены еще два осколка — весом 21,95 и 105,45 г. Не считая двух десятков граммов, израсходованных Ерофеевым и Лачиновым на анализы, метеорит сохранился.
Его можно видеть и сейчас в Ленинградском горном музее .
КАНДИДАТ В САМЫЕ ПРОЧНЫЕ? В 1975 г. были опубликованы расчеты, проведенные советскими химиками В. В. Коршаком, В. И. Касаточкиным и К. Е. Перепелкиным, согласно которым наибольшая теоретическая прочность из всех имеющихся на Земле веществ должна быть у линейного полимера углерода — карбина. Разумеется, такой ультрапрочный карбин должен быть изготовлен в виде бездефектных нитевидных кристаллов. Раньше считали, что теоретически самое прочное вещество — графит (13 тыс. кг/мм2), для карбина же вычисленная величина предельной прочности почти вдвое больше — 22—23 тыс. кг/мм2.
Что нужно, чтобы материал был очень прочным? Во-первых, высокие значения энергии химических связей. Во-вторых, направления этих связей должны по возможности совпадать и идти вдоль оси кристалла. В-третьих, если вещество полимерного строения, нужно, чтобы степень его полимеризации была высокой. Четвертое обязательное условие — отсутствие в макромолекуле «слабых мест» и слабых связей. Все эти условия соблюдены в карбине, поэтому рекордные значения расчетной теоретической прочности, в общем, не удивительны.
КАРБИН В ПРИРОДЕ. В 1970 г. геофизики из Института Карнеги обнаружили в метеоритном кратере Рис на территории ФРГ новый минерал, состоящий на 99,99% из углерода. Но это, определенно, не были ни алмаз, ни графит. Исследования показали, что минерал из кратера Рис скорее всего представляет собой природную разновидность синтезированного несколькими годами раньше карбина. ВОЗРАСТ — ПО 14С. Метод определения возраста исторических находок по содержанию в них радиоактивного изотопа углерода 14С разработан известным физиком, лауреатом Нобелевской премии Фрэнком Уиллардом Либби.
Углерод-14 — один из природных радиоактивных изотопов, период его полураспада 5570 лет.
Поток космических протонов, летящих со скоростью, близкой к скорости света, непрерывно бомбардирует Землю. Уже в верхних слоях атмосферы протоны сталкиваются с ядрами азота и кислорода. При таких столкновениях атомы разрушаются, в результате чего получаются свободные нейтроны, моментально захватываемые ядрами элементов воздуха, в первую очередь, конечно, ядрами атомов азота. И тогда происходит одно из чудес, признаваемых наукой,— взаимопревращение элементов: азот становится углеродом, только не простым, а радиоактивным углеродом-14. Ядра углерода-14, распадаясь, испускают электроны и вновь превращаются в ядра азота.
Зная период полураспада изотопа, нетрудно подсчитать, сколько его теряется за любой промежуток времени. Подсчитали, что за год на Земле распадается примерно 7 кг радиоуглерода. Это означает, что на нашей планете естественным путем поддерживается постоянное количество этого изотопа — в результате ядерных реакций, идущих в атмосфере, Земля ежегодно «приобретает» около 7 кг 14С.
Земная атмосфера углеродом не богата. В ней всего 0,03% (по объему) двуокиси углерода СО2. Но в пересчете на вес это не так уж мало: общее содержание углерода в атмосфере — около 600 млн. т. И в каждом биллионе молекул атмосферной С02 есть один атом 14С. Эти атомы вместе с обычными усваиваются растениями, а оттуда попадают в организмы животных и человека. В любом живом организме есть радиоуглерод, который постепенно распадается и обновляется. В грамме «живого» углерода каждую минуту происходят 14 актов радиоактивного распада. Опыт показывает, что концентрация этого изотопа одинакова во всем живом на нашей планете, хотя в силу некоторых геофизических причин радиоуглерод «приземляется» преимущественно в полярных районах.
Но вот организм гибнет и перестает быть эвеном непрерывно идущего па Земле круговорота углерода. Новый радиоуглерод в него уже не поступает, а радиоактивный распад продолжается. Через 5570 лет количество радиоуглерода в отмершем организме уменьшится вдвое, и в грамме углерода, извлеченного из дерева, срубленного 5570 лет назад, чувствительные счетчики за минуту зафиксируют уже не 14, а лишь 7 актов распада. Поэтому с помощью радиоуглерода можно определить возраст практически
Интересные факты об углероде | VivaReit
Среди множества химических элементов из Периодической системы Д.И. Менделеева представителя под номером 6 можно по праву считать «царственным». Углерод образует миллионы органических и неорганических соединений. Причина многообразия заключается в уникальности строения его атомов. Для него свойственно явление аллотропии. Такие разные вещества алмаз, графит и другие – это все углерод.
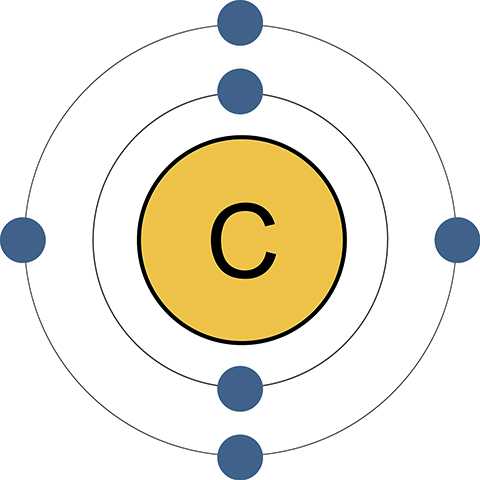
Строение атома
На внешней энергетической оболочке находятся 4 электрона, ближе к ядру – еще 2. Полностью заполненной считается «заветная восьмерка». Имеющаяся ровно половина от нее дает возможность атому как принимать дополнительные электроны на вакантные места, так и отдавать. Таким образом, углерод обладает самым широким диапазоном электронных переходов.
Его сосед по главной подгруппе кремний имеет столько же крайних отрицательно заряженных частиц в ядре. Но у последнего элемента гораздо больше общее количество электронов (14), что осложняет их прием и передачу. Так, в молекуле углекислого газа СО2 углерод отдает все 4 крайних электрона более электроотрицательному элементу – кислороду. А в метане СН4 принимает столько же от водорода.
Волшебная аллотропия
Причина фантастического явления заключается в разном строении кристаллических решеток. Углерод имеет атомную, но ее подвиды удивляют:
- У алмаза в виде тетраэдра.
- Графита – плоская.
- Карбина – линейная.
- Фуллерена – экзотическая.
Атомы углерода в кристаллической решетке вещества графита лежат в одной плоскости. Они прочно связаны, образуют шестиугольники. Между их слоями связи слабые – след от карандаша остается на бумаге. А вот температуру графит выдерживает высокую. Из него изготовляют углероды, замедлители нейронов (ядерных частиц) в реакторах, твердые смазки.

Алмазы и их истории
Известное с древности вещество получило название «твердейший» – «алмас» (на арабском языке), «несокрушимый» – «адамас» (греческом). Алмазы имеют персональную единицу измерения массы: 1 карат равен 0,2 г. Прозрачные камни ограняют, бриллиантами украшают изделия.
У крупных алмазов зачастую детективные истории. В российском фонде содержатся 7 исторических камней. Так, экземпляр «Шах» (87 каратов) был найден в 16 веке. Он хранился у индийских вельмож, потом оказался у монголов и менял еще не раз своих хозяев. В 1739 году попал в Персию. Через 90 лет персидские власти им пытались откупиться за убийство русского дипломата-поэта А.С. Грибоедова.

Полезная адсорбция
Древесный уголь и сажа – это тоже углерод. Первый получают в результате сухой перегонки древесины. Благодаря своей пористой поверхности, уголь имеет способность поглощать растворенные вещества и газы. Эффективность адсорбции зависит от его пористости.
Технически поглотительную способность увеличивают, обрабатывая уголь водяным горячим паром. Полученный образец называется активированным. Реализуется карболен через аптечную сеть. Помогает лекарственное средство при диспепсических симптомах (тошноте, рвоте, поносе), отравлении, интоксикации организма.
Угарный, углекислый газы и другие соединения
С кислородом углерод образует оксиды, с металлами – карбиды. Куски серого цвета (соединение с кальцием) газосварщики применяют с целью получения ацетилена. Газы-оксиды углерода бесцветные и не имеют запаха. Но на этом их общие свойства ограничиваются. Угарный – малорастворим в воде. Он очень ядовитый.
На основе углекислого газа производят «сухой лед» для хранения пищевых продуктов. Данное соединение углерода не поддерживает горение. Применяется для тушения очагов возгорания. Используют углекислый газ для создания пищевой соды, шипучих напитков (лимонада, шампанского).
Противогаз на углероде
Действие противогазов основано на адсорбции активированного угля, Устройство защищает человека от опасных примесей, имеющихся в воздухе. Впервые противогазы, изобретенные русским химиком Н.Д. Зелинским, использовались во время первой мировой войны.
Углерод в природе
«Карбонеум», так звучит название химического элемента по латыни. Главным карбонатным минералом считается кальцит. Природный формат его: мел, мрамор, известняк. Углекислый газ содержится в выдыхаемом живыми организмами воздухе. Вблизи фабрик, заводов, транспортных магистралей концентрация его больше. Образуется оксид при гниении, горении, тлении органических веществ.
Дословный перевод элемента на русский язык – «рождающий уголь». В соленых водах океанов и морей оксида углерода-4 больше, чем в воздухе. До 99% элемента содержится в каменном угле, 72% – буром, 57% – торфе. Нефть – это смесь водородных соединений углерода, находящихся в разных агрегатных состояниях (жидком, газообразном, твердом). Все источники участвуют в круговороте элемента в природе. Углерод является основой живой природы.
Жесткая вода
Соли угольной кислоты обуславливают жесткость воды. Такая жидкость неудобна в употреблении. Она оставляет следы белого цвета на одежде, мебели, накипь на посуде. Жесткая вода не промывает волосы и плохо мылится. В ней дольше развариваются овощи, мясо, крупы, бобовые. Чтобы сделать ее мягкой следует добавлять техническую соду, кипятить.

Другие факты об углероде
- При высоких давлении и температуре из графита производят искусственные алмазы, их применяют в технических целях (стеклорезы, сверла).
- Самое большое количество углекислого газа поступает в атмосферу в результате извержения вулканов.
- В истории Земли выделяют целый период в Палеозойской эре, который носит название карбона или каменноугольного. Именно в то время появились первые крылатые насекомые, акулы, пресмыкающиеся.
- Главной составной частью природного газа являются углеводороды.
- Раствор углекислого газа окрашивает лакмусовую бумажку (индикатор) в красный цвет. При стоянии новая проверка приводит к тому, что лакмус возвращает себе прежнюю фиолетовую окраску.
- Понятие «карат» появилось в древности. Так называли косточку аравийского дерева, имеющую точный вес. Природные «гирьки» использовали ювелиры при взвешивании изделий.
- Натуральный алмаз горит ослепительным пламенем. Единственным продуктом реакции является углекислый газ.
- Противоядие при отравлении угарным газом – это вдыхание чистого кислорода, свежего воздуха.
Интересные факты о углероде
Наслаждайтесь огромным количеством интересных фактов о углероде. Углерод играет огромную роль в мире, в котором мы живем: от углекислого газа в воздухе до графита в вашем карандаше, вы найдете его отпечаток повсюду.
Узнайте больше об использовании углерода, углеродном атоме, углеродных свойствах, углеводородах, углеродной структуре, углеродном волокне, окиси углерода, углеродном следе и других удивительных фактах углерода.
Углерод — это химический элемент с символом С и атомным номером 6.
Слово углерод происходит от латинского слова carbo, что означает уголь.
Углерод образует большое количество соединений, больше, чем любой другой элемент. Из-за своей готовности связываться с другими неметаллическими элементами, его часто называют строительным блоком жизни.
Хотя углерод образует множество различных соединений, он является относительно нереактивным элементом.
Существует несколько аллотропов (разных форм) углерода с тремя наиболее известными из них — аморфный углерод (уголь, сажа и т. Д.), Алмаз и графит.
Свойства алмаза и графита очень разные: алмаз прозрачный и очень твердый, а графит черный и мягкий (достаточно мягкий, чтобы писать на бумаге).
Графит используется для его теплоизоляции (более низкой скорости теплопередачи). Это также очень хороший проводник или электричество.
Углеродные атомы в графите связаны в плоских гексагональных решетках и слоисты в листах.
Углерод является 4-м наиболее распространенным элементом во Вселенной (после водорода, гелия и кислорода). Это 15 наиболее распространенный элемент в земной коре, в то время как это второй по распространенности элемент в организме человека (за кислородом).
У углерода есть самая высокая точка плавления всех элементов, приблизительно 3500 ° C (3773 K, 6332 ° F).
Углеводороды — это органические соединения, полностью состоящие из молекул, содержащих только водород и углерод. Органическая химия включает изучение углеводородов.
Простейшим углеводородным соединением является метан (Ch5).
Углерод был обнаружен ранними человеческими цивилизациями в форме древесного угля и сажи.
Термин «углеродный след» относится к объему выбросов парниковых газов, вызванных страной, организацией или отдельным лицом.
Углеродный цикл — это процесс, при котором происходит обмен углерода между всеми частями Земли и ее живыми организмами. Это жизненно важно для жизни на Земле, позволяя углероду постоянно использоваться повторно и повторно.
Углерод находится в атмосфере Земли в виде двуокиси углерода (CO2). Хотя он составляет лишь небольшой процент атмосферы, он играет важную роль, в том числе, будучи использованными растениями во время фотосинтеза.
Окись углерода (СО) очень токсична как для человека, так и для животных. Он образуется в условиях, когда кислорода недостаточно для образования углекислого газа (CO2). Во многих странах мира отравление угарным газом является самым распространенным видом смертельного отравления.
Углеродное волокно — это прочный материал, состоящий из тонких волокон, состоящих в основном из атомов углерода, которые соединены вместе в микроскопических кристаллах. Это очень полезно для приложений, требующих высокой прочности и низкого уровня восемь.
Ископаемые виды топлива, такие как метан и сырая нефть (бензин), играют большую роль в современной экономике.
Пластмассы изготавливаются из углеродных полимеров. Углерод используется для образования сплавов с железом, таких как углеродистая сталь.
Графит и глина объединяются, чтобы привести свинец в карандаши.
Древесный уголь обычно используется для гриля пищи на барбекю.
Интересное про химический элемент углерод
Углерод может быть сияющим и твердым. Он может быть мягким и сыпучим. Он может выглядеть как футбольный мяч. Углерод является основой всего живого на Земле, и он же может уничтожить жизнь на нашей планете. Едва ли не чудом кажется то, что и сияющий алмаз, и черный уголь составлены из одного и того же элемента. Но наш мир полон таких чудес, и всем им есть или вскоре будет найдено объяснение.
Углерод является одним из самых распространенных элементов. Он находится в самом верху периодической таблицы, между бором и азотом. Атомный номер углерода — 6, химический знак — С. Это четвертый по распространенности элемент в нашей Вселенной после водорода, гелия и кислорода и пятнадцатый по содержанию в коре Земли. Если водород и гелий, как считается, сформировались во время Большого Взрыва, то углерод был создан при помощи альфа-частиц в процессе взрывов сверхновых, так называемом нуклеосинтезе сверхновых.
Примерно двадцать процентов человеческого тела составляет углерод
Мэй Найман, профессор неорганической химии в Государственном университете Орегона, говорит, что углерод имеет почти неограниченные возможности для использования. Найман отмечает, что углерод имеется во всех известных нам формах жизни и входит в состав сахаров и жиров. Он формирует цепи и кольца в химическом процессе, называемом катенация. Каждое живое существо, прежде всего, имеет в своей основе углерод. Только потом идут азот, водород, кислород и другие элементы. Животные, растения, каждая живая клетка на нашей планете являются результатом катенации. Наше тело на 18,5% состоит из углерода. И все же он является важным элементом неорганической химии. Из него состоят камни и минералы.
Две формы углерода были открыты совсем недавно
Углерод предстает перед нами в виде графита, алмазов, фуллеренов и графенов. Все зависит от структуры углерода. Графит содержит многочисленные тонкие слои углерода, соединившего молекулы в двумерной связи, и когда грифель карандаша проходит по бумаге, он оставляет их на ней. Алмазы являются сложной трехмерной структурой. Такие связи можно разрушить, только прилагая огромную энергию. Это придает алмазу его невероятную прочность. Фуллерены были открыты в 1985 году, когда группа ученых облучила графит лазером и получила углеродный газ, состоящий из ранее неизвестных сферических молекул, в которых насчитывалось 60 и 70 атомов. Они получили название в честь Бакминстера Фуллера, изобретателя, который прославился созданием геодезических куполов со сложной, напоминающей футбольный мяч структурой. За открытие новой формы углерода Роберт Керл, Харольд Крото и Ричард Смолли получили Нобелевскую премию в области химии за 1996 год. В 2004 году был открыт графен. Это сделали Андрей Гейм и Константин Новоселов. Ученые использовали обычную клейкую ленту-скотч для того, чтобы отделить слой углерода в один атом толщиной. Это позволяет перенести графен на подложку для последующего промышленного использования. За свое открытие ученые в 2010 году получили Нобелевскую премию по физике.
Еще по теме:
На экзопланетах, где много углерода, нет земной жизни
Углерод
Углерод по праву считается одним из самых важных элементов на нашей планете. Он образует больше соединений, чем любой другой элемент.
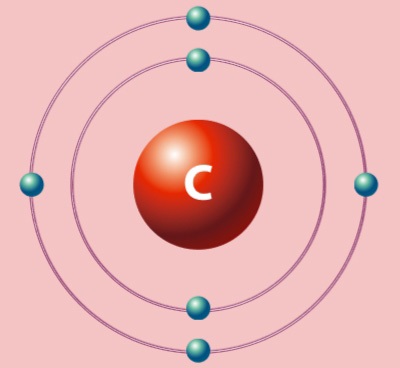
Основные характеристики
Необычность углерода заключается в том, что он может существовать в различных формах, которые принято называть аллотропными модификациями или аллотропиями. Все аллотропии углерода отличаются молекулярным строением, именно поэтому у каждой модификации свои химические и физические свойства.
Одним из самых известных аллотропов углерода является алмаз — прозрачное кристаллическое вещество. Это самый твердый минерал из известных на Земле, более того, теплопроводность алмаза также самая высокая по сравнению со всеми прочими элементами.
А вот графит — другая модификация углерода — один из самых мягких материалов. Графит является очень хорошим проводником электричества.

В отличие от остальных аллотропов, аморфный углерод в форме древесного угля способен образовывать длинные цепочки молекул, соединяя атомы углерода между собой.
Углерод в природе
Углерод встречается в природе как в свободном виде, так и в качестве компонента различных соединений. Углерод — основной элемент известняков, бурого и каменного угля, нефти, торфа и природных газов. Углерод окружает нас повсюду: он находится в атмосфере в виде углекислого газа СO2.
Использование углерода
В настоящее время ученые уверены в безграничных перспективах использования графена. Они даже говорят о том, что из этого материала можно построить космический лифт, на котором получится подняться на околоземную орбиту!
Благодаря аллотропным модификациям углерод нашел самое широкое применение практически во всех отраслях нашей жизни. В форме угля, нефти и природного газа углерод является одним из важнейших источников энергии. Он входит в состав самых востребованных сплавов — стали и чугуна. Бриллианты — ограненные и шлифованные алмазы — нашли применение в ювелирной промышленности и считаются одними из самых дорогих драгоценных камней.

Круговорот углерода в природе
Ты уже знаешь, что одним из наиболее важных и востребованных элементов для всех живых существ является углерод: даже в организме человека его количество составляет 1/5 часть массы тела.
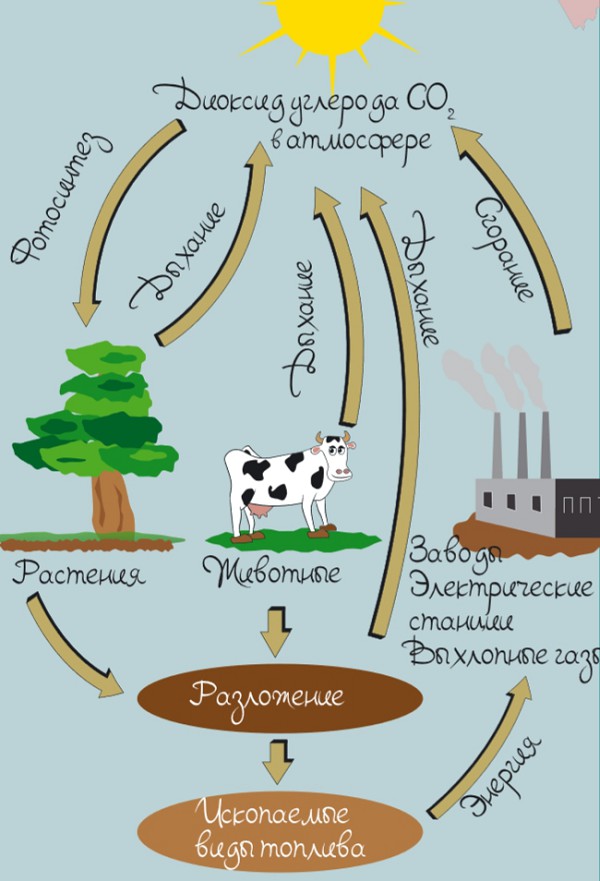
В атмосфере Земли и Мировом океане находятся запасы углерода в виде углекислого газа (СO2). И именно этот углерод востребован так называемыми поглотителями.
Как происходит процесс поглощения углерода?
- Путем фотосинтеза, который необходим для роста и развития растений. Из воздуха растения поглощают молекулы углекислого газа, затем при помощи солнечного света и воды углерод превращается в кислород и сахар.
- При помощи Мирового океана, воды которого также способны поглотить избыток углерода из атмосферы. Диоксид углерода, или углекислый газ (СO2), находящийся в воздухе, вступает в реакцию с морской водой, в результате чего в океане образуется углекислота. Это вещество идет на формирование раковин морских организмов, которые, в конечном итоге, превращаются в осадочные породы, например известняк.

Одновременно с поглощением углерода происходит и обратный процесс — его возвращение в атмосферу, причем различными путями:
- Дыхание. Каждое живое существо во время дыхания поглощает кислород, а выделяет углекислый газ.
- Гниение (разложение). Живые организмы умирают и с течением времени разлагаются. Когда это происходит, углерод либо возвращается в атмосферу, либо остается в Земле в виде ископаемых видов топлива.
- Горение. В процессе горения древесины или природного топлива углерод высвобождается и возвращается в атмосферу.

Человек и природа
Удивительная особенность природы заключается в балансе и гармонии всех веществ и элементов. Но, к сожалению, деятельность человека нередко приводит к нарушению этой гармонии, в том числе и цикла углерода.
Постоянно увеличивающееся количество сжигаемого топлива (нефти, газа, угля) способствует большим выбросам в атмосферу углекислого газа.
Вырубка лесов существенно сокращает количество растений, которые выделяют в атмосферу кислород, так необходимый для всего живого.
Постоянное загрязнение вод морей и океанов отходами производства неизбежно ведет к ухудшению качества воды и гибели морских организмов.
Источник http://buildoman.ru/raznoe-2/interesnye-fakty-pro-uglerod-interesnye-fakty-ob-uglerode-interesnye-fakty.html
Источник http://sitekid.ru/himiya/uglerod.html
Источник